نشوء حيوي للمتقدرة
النشوء الحيوي للمتقدرة (بالإنجليزية: Mitochondrial biogenesis) هو العملية التي تزيد بها الخلايا أعداد المتقدرات.[1][2] وُصفت لأول مرة بواسطة جون هولوسي في عقد 1960، حين اكتُشِف أن التدريب على التحمل الجسدي أحدث مستويات أعلى من المحتوى المتقدري وهو الأمر الذي يؤدي إلى امتصاص أكبر للجلوكوز بواسطة العضلات.[3] يُنشَّط النشوء الحيوي للمتقدرات بواسطة عدة إشارات مختلفة أثناء أوقات الإجهاد الخلوي أو استجابة لمنبهات محيطية مثل التمرين الهوائي.[1][2][4]
خلفية
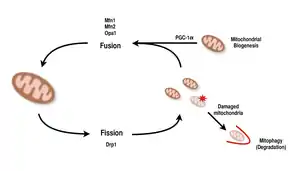
قدرة المتقدرات على التضاعف الذاتي متجذرة في في تاريخها التطوري. يُعتقد بشكل شائع أن المتقدرات سليلة خلايا شكلت علاقات تعايش داخلي مع متقلبات ألفا، وأن لها جينومها الخاص من أجل التضاعف.[5] مع ذلك، تقترح أدلة حديثة أن المتقدرات ربما تكون تطورت من دون تكافل (تعايش داخلي).[6] المتقدرة هي منظم مفتاحي لنشاط الخلية الأيضي وهي عضية مهمة كذلك في إنتاج وتفكيك الجذور الحرة.[7] من المعروف أن الأعداد الكبيرة من المتقدرات أمر يحمي الخلية.
تنتج المتقدرات من نسخ وترجمة جينات كل من الجينوم النووي والجينوم المتقدري. مصدر معظم البروتينات المتقدرية من الجينوم النووي، مع كون الجينوم المتقدري يشفر أجزاء من بروتينات سلسلة نقل الإلكترون وبعض جزيئات الرنا الريبوسومي والرنا الرسول المتقدرية. النشوء الحيوي للمتقدرة يزيد من إنزيمات الأيض المتوفرة من أجل عمليتي: تحلل الجلوكوز والفسفرة التأكسدية وهذا يؤدي في النهاية إلى قدرة متقدرية أكبر في العمليات الأيضية. اعتمادا على طاقة الركائز المتوفرة وحالة الخزدلة الخلوية، يمكن أن تزيد الخلية أو تُنقص ن أعداد وحجم متقدرات.[8] يختلف عدد المتقدرات وأحجامها تبعا لنوع الخلية والسياق المحدد لاحتياج الطاقة، حيث ينظِم التوازن بين الاندماج والانقسام المتقدري توزيع، شكل وحجم، ووظيفة المتقدرات.[9][8]
الشيخوخة
تم إظهار أن قدرة النشوء الحيوي للمتقدرات تنخفض مع العمر، وهذا الانخفاض في وظيفة المتقدرات له صلة بأمراض السكري والأمراض الوعائية القلبية.[10][11][12] يمكن للشيخوخة والأمراض إحداث تغيرات في مستويات التعبير عن البروتينات التي لها دور في آليات انقسام واندماج المتقدرات، وبذلك إنشاء متقدرات ذات اختلال وظيفي.[13][14] تربط إحدى الفرضيات النتائجَ الضارة للشيخوخة بفقدان القسيمات الطرفية وهي القطع الطرفية من الصبغيات التي تحمي المعلومات الجينية من التحلل والتفكك.[11][14] وفقدان القسيمات الطرفية مرتبط بانخفاض الوظيفة المتقدرية.[14][11] رُبِط العوز في إنزيم الناسخ العكسي للقسيمات الطرفية (TERT) الذي يلعب دورا في الحفاظ على القسيمات الطرفية وصيانتها بالبروتين p53 المنشط، والذي قوم بتثبيط جين PGC-1α المنظم لعملية النشوء الحيوي للمتقدرات.[14][13][11] وعليه، تم ربط فقدان القسيمات الطرفية والإنزيم الناسخ العكسي لها الذي تسببه الشيخوخة بنشوء حيوي متقدري عليل.[11][13][14] تم كذلك توضيح أن التعبير عن كيناز البروتين المنشط بالأدينوسين أحادي الفوسفات (AMPK) ينخفض مع التقدم في السن، وهو أمر ربما يساهم أيضا في تثبيط التخليق الحيوي للمتقدرات.[5][14]
مراجع
- Valero T (2014). "Editorial (Thematic Issue: Mitochondrial Biogenesis: Pharmacological Approaches)". Current Pharmaceutical Design. 20 (35): 5507–5509. doi:10.2174/138161282035140911142118. hdl:10454/13341. PMID 24606795. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). "Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches". Current Pharmaceutical Design. 20 (35): 5619–33. doi:10.2174/1381612820666140306095106. PMID 24606801. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Holloszy JO (April 2011). "RRegulation of Mitochondrial Biogenesis and GLUT4 Expression by Exercise". Comprehensive Physiology. 1 (2): 921–40. doi:10.1002/cphy.c100052. ISBN 9780470650714. PMID 23737207. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Boushel R, Lundby C, Qvortrup K, Sahlin K (October 2014). "Mitochondrial plasticity with exercise training and extreme environments". Exercise and Sport Sciences Reviews. 42 (4): 169–74. doi:10.1249/JES.0000000000000025. PMID 25062000. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jornayvaz FR, Shulman GI (2010). "Regulation of mitochondrial biogenesis". Essays in Biochemistry. 47: 69–84. doi:10.1042/bse0470069. PMC 3883043. PMID 20533901. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harish A, Kurland CG (December 2017). "Mitochondria are not captive bacteria". Journal of Theoretical Biology. 434: 88–98. doi:10.1016/j.jtbi.2017.07.011. PMID 28754286. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME (May 2004). "Effects of short- and medium-term calorie restriction on muscle mitochondrial proton leak and reactive oxygen species production". American Journal of Physiology. Endocrinology and Metabolism. 286 (5): E852-61. doi:10.1152/ajpendo.00367.2003. PMID 14736705. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mishra P, Chan DC (February 2016). "Metabolic regulation of mitochondrial dynamics". The Journal of Cell Biology. 212 (4): 379–87. doi:10.1083/jcb.201511036. PMC 4754720. PMID 26858267. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (June 2016). "Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity". Neurobiology of Disease. 90: 3–19. doi:10.1016/j.nbd.2015.10.011. PMID 26494254. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Handy DE, Loscalzo J (June 2012). "Redox regulation of mitochondrial function". Antioxidants & Redox Signaling. 16 (11): 1323–67. doi:10.1089/ars.2011.4123. PMC 3324814. PMID 22146081. الوسيط
|CitationClass=تم تجاهله (مساعدة) - David R (April 2011). "Ageing: Mitochondria and telomeres come together". Nature Reviews. Molecular Cell Biology. 12 (4): 204. doi:10.1038/nrm3082. PMID 21407239. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hagen TM, Wehr CM, Ames BN (November 1998). "Mitochondrial decay in aging. Reversal through supplementation of acetyl-L-carnitine and N-tert-butyl-alpha-phenyl-nitrone". Annals of the New York Academy of Sciences. 854: 214–23. doi:10.1111/j.1749-6632.1998.tb09904.x. PMID 9928432. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M, et al. (February 2011). "Telomere dysfunction induces metabolic and mitochondrial compromise". Nature. 470 (7334): 359–65. doi:10.1038/nature09787. PMC 3741661. PMID 21307849. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sahin E, DePinho RA (May 2012). "Axis of ageing: telomeres, p53 and mitochondria". Nature Reviews. Molecular Cell Biology. 13 (6): 397–404. doi:10.1038/nrm3352. PMC 3718675. PMID 22588366. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء الخلوي والجزيئي
