قسيم طرفي
القُسَيْمٌ الطَرَفِيّ[1][2][3][4][5] أو القطعة النهائية[6] أو التيلومير (بالإنجليزية: Telomere) هو منطقة من تسلسل نووي كثير التكرار يتوضع عند نهاية الصبغيات تعمل تماما كنهاية رباط الحذاء النحاسية أو البلاستيكية. الفائدة الرئيسية للقسيم الطرفي تظهر أثناء عملية تضاعف الحمض النووي، ففي كل مرة يتضاعف فيها يتوقف معقد إنزيم بلمرة الحمض النووي قبل النهاية ببضعة مئات من القواعد النووية، فلو كان هذا القسيم الطرفي غير موجود لحدث فقدان لمعلومات وراثية مهمة ونتج عن ذلك خلل كبير في عمل الخلايا الحية ومنتجاتها البروتينية (يمكن تشبيه القسيم الطرفي "برباط حذاء " يربط بين سلسلتي الدنا).
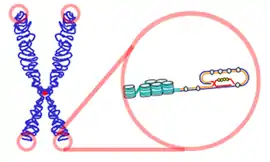
تتابعات القسيم الطرفي تقصر في كل جيل يمر على الخلية الجسمية بمعدل مائة قاعدة كل انقسام وذلك بسبب طبيعة انقسام الحمض النووي نصف المحافظ .
تتميز الخلايا الجنسية عن الخلايا الجسدية بوجود جينات للقسيم الطرفي والتي تعمل على إعادة بناء أجزاء القسيم الطرفي المتهدم بعد كل دورة تمر بها الخلية.
ويعتبر تآكل القسيم الطرفي في الخلية سببا رئيسيا من الأسباب التي يعزي إليها العلماء موت الخلية الحيوي حيث أن الخلية تتوقف عن الانقسام واستكمال عملياتها الحيوية عندما يصل حجم القسيم الطرفي إلى حد معين لا تنقسم الخلية بعده.
الاكتشاف

في 1970 في وقت مبكر، المفكر الروسي Alexei Olovnikov أول من عرف أن الكروموسومات لا تستطيع تكرار نهايتها بشكل كامل. بناء على هذا، واستيعاب Hayflick Leonard فكرة تقليل انقسام الخلية الجسدية، اقترح Olovnikov أن تسلسل الحمض النووي تفقد في كل مرة يتضاعف فيها حتى تصل الخسارة إلى مستوى حرج، عند نقطة نهاية الانقسام.[7][8] ومع ذلك، تنبؤ Olovnikov ليست معروفة على نطاق واسع إلا من قبل حفنة من الباحثين الذين يدرسون الشيخوخة الخلوية والتخليد[9] في 1970 كان هناك اعتراف بأن آلية تقصير التيلومير عادة يحد الخلايا لعدد محدد من الانقسامات، ولم يكن هناك أي دراسة أجريت على الحيوانات تشير إلى أن هذه يمكن أن تكون مسؤولة عن الشيخوخة على مستوى الخلية. كما لم يكن هناك اعتراف بأن آلية تعيين حد للأعمار.[10][11]
الطبيعة والوظيفة
الهيكل والوظيفة والتطور البيولوجي
التيلوميرات هي تسلسل متكرر من النيوكليوتيدات تقع في نهاية الكروموسومات في معظم الكائنات الحية حقيقية النواة. في الفقاريات، تسلسل النيوكليوتيدات في التيلومير هو T T A G G G. معظم بدائيات النوى ، التي تفتقر إلى هذا الترتيب الخطي، لا تمتلك التيلومير.أما البروتين المعقد الذي يعرف باسم shelterin يعمل على حماية نهايات التيلوميرات من الاعتراف بها كحبل مزدوج (double-strands) عن طريق تثبيط إعادة التركيب المثلي (Homologous recombination (HR و النهاية غير متجانسة الانضمام (non-homologous end joining (NHEJ .[12][13] في معظم بدائيات النوى، الكروموسومات دائرية، وبالتالي، لم يكن هناك نهايات تعاني من تكرار نهاية الحمض النووي السابق لأوانه. جزء صغير من كروموسومات البكتيريا (مثل تلك الموجودة في السبحية ، الأجرعية ، و بوريليا ) هي خطية و تمتلك التيلوميرات، التي تختلف كثيرا عن تلك التي توجد في كروموسومات الخلايا حقيقية النواة في هيكلها ووظائفها. البناء المعروف للتيلوميرات البكتيرية تأخذ شكل بروتينات منضمة إلى نهايات الكروموسومات الخطية، أو حلقات دبوس الشعر للحمض النووي المفرد في نهايات الكروموسومات الخطية.[14] في الخلايا حقيقية النوى، الانزيمات التي تساعد في نسخ الحمض النووي لا تستطيع نسخ التسلسل الذي يوجد في نهاية الكروموسومات (أو على نحو أدق ألياف الكروماتيد). وبالتالي، هذه المتتاليات والمعلومات التي تحملها قد تضيع. لهذا السبب التيلوميرات تعد في غاية الأهمية لنجاح عملية انقسام الخلايا. ولكن الخلية لديها أنزيم يدعى التيلوميراز، يقوم باضافة تسلسل النيوكليوتيدات المتكررة لنهايات الحمض النووي. في معظم الكائنات الحية حقيقية النواة متعددة الخلايا، التيلوميراز يبقى نشطا فقط في الخلايا الجرثومية، بعض أنواع من الخلايا الجذعية مثل الخلايا الجذعية الجنينية، وبعض خلايا الدم البيضاء . يمكن إعادة تنشيط التيلومير إضافة إلى إعادة تعيين العودة إلى حالة جنينية عن طريق نقل نواة الخلية الجسدية.[15] هناك نظريات تدعي أن تقصير ثابت للتيلومير في كل مرة يتم فيها نسخ الحمض النووي في الخلايا الجسدية قد يكون له دور في الشيخوخة وفي الوقاية من السرطان. وذلك لأن التيلومير بمثابة نوع من التأخير الزمني، يتم تشغيله في نهاية المطاف بعد عدد معين من الانقسامات الخلوية ومما أدى إلى خسارة من المعلومات الوراثية الحيوية من كروموسوم الخلية مع الشعب المقبلة. طول التيلومير يختلف كثيرا بين الأنواع، من حوالي 300 زوج قاعدي في الخميرة [16] لالاف القواعد في البشر، وعادة تتكون من صفائف غنية في جوانين ، من ستة إلى ثماني ازواج من القواعد المكررة. التيلومير في الخلايا حقيقية النواة تنتهي عادة مع 3′ single-stranded-DNA overhang، وهو أمر ضروري لصيانة التيلومير. وقد تم تحديد البروتينات المتعددة التي ترتبط في التيلومير في الحمض النووي [17] هذه الوظيفة لصيانة التيلومير والسد. التيلوميرات تشكل حلقة كبيرة تسمى حلقات شريط الحامض النووي، أو حلقات T. وهنا، الحمض النووي المفرد يلتف كدائرة طويلة، تستقر من خلال ارتباط البروتينات في التيلومير.[18] في نهاية حلقة T،التيلومير على الحمض النووي المفرد يحتفظ بمنطقة الحمض النووي المزدوج من خلال تعطيل (double-helical DNA) ، وزوج قاعدي من واحد من فروع اثنين. وهذا الشكل الثلاثي يسمى حلقة النزوح أو حلقة D .[19]
تقصير التيلومير في البشر يمكن أن تحدث الشيخوخة تنسخي، التي تقف انقسام الخلايا. ويبدو أن هذه الآلية لمنع عدم الاستقرار الجيني وتطور السرطان في خلايا الإنسان القديمة عن طريق الحد من عدد من الانقسامات الخلوية. ومع ذلك، تقصير التيلوميرات تعوق الوظيفة المناعية التي قد تزيد أيضا من قابلية السرطان.[20]
Shelterin
في النهاية البعيدة جدا من التيلومير هو 300 زوج قاعدة في السلسة المفردة الذي يشكل حلقة T. هذه الحلقة هي مماثلة ل عقدة ، والتي تساعد في استقرار التيلومير، ومنع نهاية التيلومير من الاعتراف بها كنقاط كسر عن طريق آلية إصلاح الحمض النووي. ينبغي نهاية غير متجانسة الانضمام تحدث في نهايات التيلومير، والكروموسومات انصهار ينتج. ترتبط حلقة T معا من قبل العديد من البروتينات، تلك أبرزها TRF1، TRF2، POT1، TIN1، وTIN2، يشار إليها (sheltrin complex) . في البشرcomlex shelterin تتكون من ستة بروتينات التي تم تحديدها كما TRF1، TRF2، TIN2، POT1، TPP1، وRAP1 .[12]
التيلوميراز والسرطان
التيلوميراز هو الانزيم الطبيعي الذي يشجع إطالة التيلومير. وهي نشطة في الخلايا الجذعية ،الخلايا الجرثومية، بصيلات الشعر، و 90 في المئة من الخلايا السرطانية، ولكن هذا التعبير منخفض أو غير موجود في الخلايا الجسدية. وظائف التيلوميراز إضافة قواعد لنهايات التيلوميرات. وتعتبر الخلايا التي تتمتع بنشاط كافي من التيلوميراز خالدة بالمعنى ولا تدخل ما يسمى موت الخلايا المبرمج. لهذا السبب، ينظر التيلوميراز كهدف محتمل للأدوية المضادة للسرطان (مثل شركة جيرون حاليا في التجارب السريرية على البشر و telomestatin) [21] وقد أظهرت الدراسات التي تستخدم خروج المغلوب الفئران أن دور التيلومير في السرطان على حد سواء يمكن أن تحد من نمو الورم، وكذلك تعزيز تكون الأورام، وهذا يتوقف على نوع من الخلايا والسياق الجيني.[22][23] التيلوميراز هو "مجمع بروتين نووي ريبوزي" تتكون من البروتين والحمض النووي الريبي التمهيدي التسلسل الذي يعمل على حماية النهايات الطرفية للصبغيات من تكسيرها من قبل الانزيمات. التيلوميرات (وتصرفات التيلوميراز) ضرورية لأنه، أثناء النسخ المتماثل، البلمرة DNA يمكن أن تكون الحمض النووي فقط في الاتجاه 5 'إلى 3' ,ويمكن القيام بذلك عن طريق إضافة النيوكليوتيدات إلى RNA (التي تم وضعها في نقاط مختلفة على طول الحمض النووي).
التيلومير في نهاية الحمض النووي تمنع الكروموسوم من التقصير خلال النسخ (مع فقدان المعلومات الوراثية) عن طريق استخدام "التيلوميراز لتكوين الحمض النووي على نهاية الكروموسوم. وتشمل هذه مجموعة فرعية من البروتين المتخصصة الناسخ العكسي على الانزيمات المعروفة باسم التيلوميراز (TERT ( telomerase reverse transcriptases وتشارك في تكوين التيلومير في البشر وغيرها الكثير، ولكن ليس كل الكائنات الحية. لأن آليات تكرار الحمض النووي تتأثر من الأكسدة وذلك لأن الانزيم TERT منخفض جدا في معظم أنواع الخلايا البشرية. التيلوميرات تقصر في كل مرة تنقسم فيها الخلية، من بين أنواع الخلايا التي تتميز بكثرة الانقسام (مثل الخلايا الجذعية وبعض خلايا الدم البيضاء )، ومع ذلك، عند زيادة مستوى TERT يتم التقليل من تكسير التيلومير أو منعه كليا. بالإضافة إلى TERT ، يحتوي التيلوميراز أيضا على قطعة من الحمض النووي الريبي المعروفة باسم (TERC Telomerase RNA component ) أو Telomerase RNA) TR). في البشر، تسلسل TERC التيلومير هو سلسلة متكررة من TTAGGG، بين 3 و 20 كيلو قاعدة في الطول. تختلف تسلسل التيلومير من نوع إلى نوع، ولكن، بشكل عام، ضفيرة واحدة غنية G مع عدد أقل من السيزيوم.
السرطان
التيلومير مهمة للحفاظ على سلامة الجينوم وتشير الدراسات إلى أن ضعف التيلومير أو تقصير تكتسب عادة خلال عملية تنمية الورم.[24] التيلوميرات القصيرة يمكن أن تؤدي إلى عدم الاستقرار الجيني، وفقدان كروموسوم وتشكيل نقل المواقع غير متبادلة. والتيلوميرات في الخلايا السرطانية هم أقصر بكثير من المحيطة بالأنسجة الطبيعية.[25][26] وقد وجدت الدراسات الرصدية التيلوميرات القصيرة في العديد من أنواع السرطان: بما في ذلك البنكرياس والعظام والبروستاتا والمثانة والرئة والكلى والرأس والعنق. وبالإضافة إلى ذلك، تم العثور على الأشخاص الذين يعانون من أنواع عديدة من السرطان لامتلاك التيلوميرفي الكريات البيض أقصر من الاصحاء.[27] تشير التحليلات الحديثة إلى أن 1,4- 3 أضعاف زيادة خطر الإصابة بسرطان لمن لديهم أقصر تيلومير مقابل أطول تيلومير [28][29] ولكن الزيادة في الخطر تختلف حسب العمر والجنس ونوع الورم والاختلافات في عوامل نمط الحياة.
انظر أيضًا
المراجع
- "Al-Qamoos القاموس - English Arabic dictionary / قاموس إنجليزي عربي". www.alqamoos.org. مؤرشف من الأصل في 23 أغسطس 2017. اطلع عليه بتاريخ 23 أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "القاموس الطبّي الموحّد". مكتبة لُبنان ناشِرون. مؤرشف من الأصل في 28 فبراير 2019. اطلع عليه بتاريخ 16 آب/أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "قاموس مرعشي الطبّي". مكتبة لُبنان ناشِرون. مؤرشف من الأصل في 16 أغسطس 2017. اطلع عليه بتاريخ 16 آب/أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "القاموس الطبّي للجيب". مكتبة لُبنان ناشِرون. مؤرشف من الأصل في 16 أغسطس 2017. اطلع عليه بتاريخ 16 آب/أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "معنى Telomere في معجم وقاموس المعاني الجامِع". موقع المعاني. مؤرشف من الأصل في 16 أغسطس 2017. اطلع عليه بتاريخ 16 آب/أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - كتاب الأحياء للصف الثاني الثانوي العلمي، المملكة الأردنية الهاشمية، طبعة عام 1997، صفحة 79، بند الكروموسومات الاصطناعية.
- Olovnikov, Alexei M. (1971). [Principle of marginotomy in template synthesis of polynucleotides]
|trans-title=بحاجة لـ|title=(مساعدة). Doklady Akademii Nauk SSSR (باللغة الروسية). 201 (6): 1496–99. PMID 5158754. الوسيط|CitationClass=تم تجاهله (مساعدة) - Olovnikov AM (September 1973). "A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon". J. Theor. Biol. 41 (1): 181–90. doi:10.1016/0022-5193(73)90198-7. PMID 4754905. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "No Nobel physiology and medicine award for Russian gerontologist Aleksey Olovnikov". Telegraph. October 21, 2009. مؤرشف من الأصل في 11 مارس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harrison's Principles of Internal Medicine, Ch. 69, Cancer cell biology and angiogenesis, Robert G. Fenton and Dan L. Longo, p. 454.
- "Portfolio". مؤرشف من الأصل في 1 ديسمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Blasco, Maria; Paula Martínez (21 Jun 2010). "Role of shelterin in cancer and aging". Aging Cell. 9 (5): 653–66. doi:10.1111/j.1474-9726.2010.00596.x. PMID 20569239. مؤرشف من الأصل في 26 يناير 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lundblad, 2000; Ferreira et al., 2004
- Maloy, Stanley (July 12, 2002). "Bacterial Chromosome Structure". مؤرشف من الأصل في 5 أكتوبر 2018. اطلع عليه بتاريخ 22 يونيو 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Robert P. Lanza, Jose B. Cibelli, Catherine Blackwell, Vincent J. Cristofalo, Mary Kay Francis, Gabriela M. Baerlocher, Jennifer Mak, Michael Schertzer, Elizabeth A. Chavez, Nancy Sawyer, Peter M. Lansdorp, Michael D. West1 (28 April 2000). "Extension of Cell Life-Span and Telomere Length in Animals Cloned from Senescent Somatic Cells" (PDF). ساينس. مؤرشف من الأصل (PDF) في 3 مارس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Shampay , Szostak J.W., Blackburn E.H.; Szostak; Blackburn (1984). "DNA sequences of telomeres maintained in yeast". Nature. 310 (5973): 154–57. doi:10.1038/310154a0. PMID 6330571. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Williams, TL; Levy, DL; Maki-Yonekura, S; Yonekura, K; Blackburn, EH (2010). "Characterization of the yeast telomere nucleoprotein core: Rap1 binds independently to each recognition site". J. Biol. Chem. 285: 35814–24. doi:10.1074/jbc.M110.170167. PMC 2975205. PMID 20826803. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T; Comeau; Rosenfield; Stansel; Bianchi; Moss; De Lange (1999). "Mammalian telomeres end in a large duplex loop". Cell. 97 (4): 503–14. doi:10.1016/S0092-8674(00)80760-6. PMID 10338214. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Burge S, Parkinson G, Hazel P, Todd A, Neidle S; Parkinson; Hazel; Todd; Neidle (2006). "Quadruplex DNA: sequence, topology and structure". Nucleic Acids Res. 34 (19): 5402–15. doi:10.1093/nar/gkl655. PMC 1636468. PMID 17012276. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Eisenberg DTA (2011). "An evolutionary review of human telomere biology: The thrifty telomere hypothesis and notes on potential adaptive paternal effects". American Journal of Human Biology. 23 (2): 149–67. doi:10.1002/ajhb.21127. PMID 21319244. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Philippi C, Loretz B, Schaefer UF, Lehr CM.; Loretz; Schaefer; Lehr (April 2010). "Telomerase as an emerging target to fight cancer – Opportunities and challenges for nanomedicine". Journal of Controlled Release. 146 (2): 228–40. doi:10.1016/j.jconrel.2010.03.025. PMID 20381558. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "p53 deficiency rescues the adverse effects of telomere loss and cooperates with telomere dysfunction to accelerate carcinogenesis". Cell. 97 (4): 527–38. May 1999. doi:10.1016/S0092-8674(00)80762-X. PMID 10338216. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Short dysfunctional telomeres impair tumorigenesis in the INK4a(delta2/3) cancer-prone mouse". Cell. 97 (4): 515–25. May 1999. doi:10.1016/S0092-8674(00)80761-8. PMID 10338215. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Raynaud, CM; Sabatier, L; Philipot, O; Olaussen, KA; Soria, JC (2008). "Telomere length, telomeric proteins and genomic instability during the multistep carcinogenic process". Crit Rev Oncol Hematol. 66: 99–117. doi:10.1016/j.critrevonc.2007.11.006. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Blasco, MA; Lee, HW; Hande, MP; Samper, E; Lansdorp, PM; et al. (1997). "Telomere shortening and tumor formation by mouse cells lacking telomerase RNA". Cell. 91 (1): 25–34. doi:10.1016/s0092-8674(01)80006-4. PMID 9335332. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Artandi, SE; Chang, S; Lee, SL; Alson, S; Gottlieb, GJ; et al. (2000). "Telomere dysfunction promotes non-reciprocal translocations and epithelial cancers in mice". Nature. 406: 641–45. doi:10.1038/35020592. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Willeit Peter, Willeit Johann, Mayr Anita, Weger Siegfried, Oberhollenzer Friedrich, Brandstätter Anita, Kronenberg Florian, Kiechl Stefan; Willeit; Mayr; Weger; Oberhollenzer; Brandstätter; Kronenberg; Kiechl (2010). "Telomere length and risk of incident cancer and cancer mortality". JAMA. 304 (1): 69–75. doi:10.1001/jama.2010.897. PMID 20606151. مؤرشف من الأصل في 11 فبراير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ma, H; Zhou, Z; Wei, S; et al. (2011). "Shortened telomere length is associated with increased risk of cancer: a meta-analysis". PLOS ONE. 6 (6): e20466. doi:10.1371/journal.pone.0020466. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wentzensen, IM; Mirabello, L; Pfeiffer, RM; Savage, SA (2011). "The association of telomere length and cancer: a meta-analysis". Cancer Epidemiol Biomarkers Prev. 20 (6): 1238–50. doi:10.1158/1055-9965.epi-11-0005. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الأحياء
