نسبة السعة الحرارية
معامل ثبات الاعتلاج أو نسبة السعتين الحراريتين في التحريك الحراري (بالإنجليزية: Isentrope ratio) نسبة الحرارة النوعية عند ثبات الضغط إلى الحرارة النوعية عند ثبات الحجم لغاز (انظر أسفله). له تأثير كبير علي انضغاط الغاز، ويرمز له بالرمز "كابا" κ أو "غاما" . يستخدمه الكيميائيون والمهندسون. وتشكل "كابا" κ الأس التي يرفع إليها حجم الغاز ، في العلاقة الأتية:
تنطبق هذه المعادلة على عملية متساوية الإنتروبية لنظام مكون من غاز مثالي. V هو حجم الغاز ، و p الضغط.
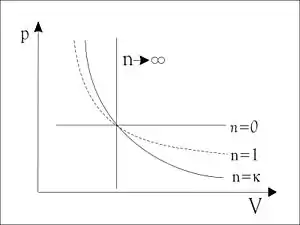
ونسمي تغير حالة نظام بأنها عملية متساوية الإنتروبية عندما تكون عملية كظومة عكوسية ، مثل مسلك الهواء في أحجام كبيرة. أما في التقنية فالتوربين البخاري ليس مثال لها حيث يكون البخار كثيف ويحتك بالتوربين أحتكاكا شديدا ، كما يحدث انضغاط وتمدد للبخار مما تزيد من إنتروبية البخار (قارن آلة كظومة) والقانون الثاني للديناميكا الحرارية).
يوضح الرسم البياني المجاور عدة حالات لعمليات في الديناميكا الحرارية.
علاقة κ بالحرارة النوعية
نسبة السعتين الحراريتين ويرمز لها ( kappa) هي النسبة بين الحرارة النوعية عند ثبات الضغط () إلى الحرارة النوعية عند ثبات الحجم () لغاز. ويستخدم الكيميائيون "كابا " لهذه النسبة ، ويستخدم المهندسون الميكانيكيون الرمز k لها. .[1]
حيث السعة الحرارية لواحد مول من الغاز أو الحرارة النوعية ل 1 جرام من الغاز. كما ترمز إلى ثبات الضغط و إلى السعة الحرارية عند ثبات الحجم.
اهميتها لحساب الشغل
لكي نوضح أهمية نسبة الحرارتين النوعيتين لغاز نفترض التجربة الآتية:
نفترض أن لدينا أسطوانة ذات مكبس تحتوي على الهواء. فيكون الضغط داخل الأسطوانة مساويا للضغط الخارجي. وعندما نقوم بتسخين الاسطوانة وترتفع درجة حرارة الهواء فيها ونمنع المكبس من الحركة للاحتفاظ بالحجم ثابتا نجد ان الضغط يرتفع . وعند الوصول إلى درجة الحرارة المطلوبة نوقف عملية التسخين.
ثم نسمح للمكبس بالحركة فيتمدد الهواء في الاسطوانة بدون تبادل للحرارة مع الوسط المحيط (عملية كظومة adiabatic expansion). وتعني حركة المكبس أن شغلا ميكانيكيا يتم ، بذلك يبرد الهواء داخل الأسطوانة وتهبط درجة حرارتة عن درجة الحرارة العالية التي كان عليها. ولكي نُعيد درجة الحرارة العالية المطلوبة في الأسطوانة لا بد من تسخين الاسطوانة من جديد مع افتراض أن المكبس حر الحركة. فنجد أن هذا التسخين الجديد يلزمة حرارة أكثر عن كمية الحرارة التي أمددنا بها هواء الأسطوانة في المرة السابقة عند ثبات الحجم، ولنفترض بنسبة 40%.
- في حالة أن كان المكبس ممنوعا من الحركة ، كانت الحرارة التي امددنا بها الغاز متناسبة مع الحرارة النوعية عند ثبات الحجم ,
- أما في الحالة الثانية عندما كان المكبس حرا الحركة فكانت الحرارة اللازمة لرفع درجة حرارة الهواء إلى نفس الدرجة متناسبة مع السعة الحرارية عند ثبات الضغط .
وبناء على ذلك تكون نسبة السعة الحرارية في هذا المثال 4و1.
وجدنا أن الحرارة النوعية عند ثبات الضغط تكون مصحوبة بشغل يعمله النظام حيث يزداد الحجم. وتطبق السعة الحرارية عند ثبات الحجم عندما تكون مساوية للصفر ، أي لا يكون هناك شغلا عمله النظام. هذه الحرارة الزائدة بنسبة 40 % هي التي تحولت إلى شغل ميكانيكي.
علاقة بدرجة حرية الجزيئات
وجدنا أن نسبة السعتين الحراريتين هي حاصل قسمة السعة الحرارية عند ثبات الضغط (cp) على السعة الحرارية للغاز عند ثبات الحجم (cV). هذه القيمة تعتمد على عدد درجات الحرية Z لجزيئ الغاز ، طبقا للعلاقة :
- or. .
حيث :
Z = درجات حرية الحركة الانتقالية + درجات حرية الحركة الدورانية + 2 درجات حرية الحركة الاهتزازية (انظردرجة حرية).
ويعتمد عدد درجات الحرية للجزيئ على العدد الذري وعلى توزيع الذرات في الجزيئ من الغاز. وفي نفس الوقت تعتمد على درجة الحرارة حيث أن دوران الجزيئ حول نفسه (مثل دوران الأرض حول نفسها) وكذلك الحركة الاهتزازية للذرات في الجزيئ يبدأ في درجات الحرارة العالية. وبانخفاض درجة الحرارة "تتصلب " بعض تلك حرية الدوران وعلى الأخص تتصلب حرية اهتزاز الذرات في الجزيئ.
تبلغ κ = 1,402 للهواء الجاف عند الظروف القياسية ، وهي تعادل في ذلك 3 درجات حرية للحركة الانتقالية و 2 درجة حرية للحركة الدورانية (جزيئ الهواء يتكون من 3 ذرات ، وشكله "قريب" من جزيئ ثنائي الذرات ولهذا فله 2 درجة حرية دورانية فقط لأنه لا يدور حول محور الروابط في الجزيئ ، أما الجزيئات الكبيرة فيمكنها الدوران حول ثلاثة محاور وتكون لها 3 درجات حرية دورانية) ، والحركة الاتهتزازية لا تكون نشطة في دراجات الحرارة المنخفضة. أما في درجات الحرارة العالية تكتسب الجزيئات درجات حرية أكثر من الحريات الاهتزازية عن بسبب تفكك الجزيئات والتأين. وبالنسبة إلى الهواء الرطب فيمكن خلال عملية تمدد الهواء وانخفاض درجة حرارته أن ينفصل المما يعمل على خفض قيمة κ (بسبب تحرر حرارة التكثف).
يمكن تعيين κ بواسطة تجربة روشاردت. ونعطي هنا :السعة الحرارية المولية عند ثبات الحجم
| 1-غاز أحادي الذرة | |||
| 2-غاز ثنائي الذرات | |||
| 3-غاز ثلاثي الذرات |
معامل ثبات الاعتلاج لبعض الغازات
يلاحظ أن الغازات الأحادية الذرات مثل : الهيليوم والنيون والزينون لها معامل ثبات اعتلاج كبير ويبلغ 66و1.
| معامل ثبات الاعتلاج لبعض الغازات | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Temp, | Gas | κ | Temp, | Gas | κ | Temp, | Gas | κ | ||
| –181 °C | H2 | 1,60 | 0 °C | Tr. Luft | 1,40 | 20 °C | NO | 1,40 | ||
| –76 °C | 1,45 | 400 °C | 1,39 | 20 °C | N2O | 1,31 | ||||
| 20 °C | 1,41 | 1000 °C | 1,37 | –181 °C | N2 | 1,47 | ||||
| 100 °C | 1,40 | 2000 °C | 1,32 | 15 °C | 1,40 | |||||
| 400 °C | 1,39 | 0 °C | CO2 | 1,31 | 1000 °C | 1,36 | ||||
| 1000 °C | 1,36 | 20 °C | 1,30 | 20 °C | Cl2 | 1,34 | ||||
| 2000 °C | 1,32 | 100 °C | 1,28 | –115 °C | CH4 | 1,41 | ||||
| 20 °C | He | 1,66 | 400 °C | 1,24 | –74 °C | 1,35 | ||||
| 20 °C | H2O | 1,33 | 1000 °C | 1,20 | 20 °C | 1,32 | ||||
| 100 °C | 1,32 | 2000 °C | 1,18 | 15 °C | NH3 | 1,31 | ||||
| 200 °C | 1,31 | 20 °C | CO | 1,40 | 19 °C | Ne | 1,64 | |||
| 500 °C | 1,30 | –181 °C | O2 | 1,45 | 19 °C | Xe | 1,66 | |||
| –180 °C | Ar | 1,76 | –76 °C | 1,42 | 19 °C | Kr | 1,68 | |||
| 20 °C | 1,67 | 20 °C | 1,40 | 15 °C | SO2 | 1,29 | ||||
| 400 °C | 1,39 | 360 °C | Hg | 1,67 | ||||||
| 1000 °C | 1,34 | 15 °C | C2H6 | 1,22 | ||||||
| 2000 °C | 1,31 | 16 °C | C3H8 | 1,13 | ||||||
المراجع
- Fox, R., A. McDonald, P. Pritchard: Introduction to Fluid Mechanics 6th ed. Wiley
انظر أيضا
- تجربة روشاردت
- معامل الحجم
- قابلية انضغاط
- سعة حرارية
- عملية متساوية الإنتروبية
- عملية متساوية الضغط
- عملية متساوية الحجم
- عملية كظومة
- آلة كظومة
- قانون الغازات المثالية
- ديناميكا حرارية
- دالة الحالة
- عمل (ترموديناميك)
- ميكانيك لاغرانج
- معادلة هاميلتون
- ستة درجات حرية
- طاقة حرارية
- تغير حالة
- بوابة الكيمياء
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
