مستقبل كيموكين
مستقبلات الكيموكين (بالإنجليزية: Chemokine receptor) هي مستقبلات سيتوكين موجودة على مستوى سطح خلايا معينة يمكنها التفاعل مع نوع من السيتوكينات تسمى كيموكين.[1][2] يصل عدد هذه المستقبلات إلى 20 مستقبلا كيميائيا متميزا تم اكتشافه لدى البشر.[3] تأخذ كل منها بنية عبر غشائية سباعية (7TM) شبيهة بالرودوبسين، تقوم بالارتباط مع بروتين G لنقل الإشارات داخل خلية، مما يجعل هذه المستقبلات أعضاء في عائلة كبيرة من المستقلات المقترنة بالبروتين G. يؤدي تفاعل هذه المستقبلات مع ربيطات الكيموكين الخاصة بها، إلى تدفق أيونات الكالسيوم (Ca2+) داخل الخلايا (تأشير الكالسيوم). يؤدي هذا إلى استجابات الخلية، بما فيها بدأ عملية تعرف باسم الانجذاب الكيميائي والتي تقوم بنقل الخلية إلى الموقع المطلوب في الجسم.
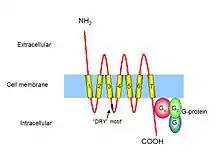
تنقسم مستقبلات الكيموكين إلى أربع عائلات مختلفة، مقابلة للعائلات الفرعية الأربعة المميزة للكيموكين التي تربطها : مستقبلات كيموكين CX، مستقبلات كيموكين CC، مستقبلات كيموكين CX3 ومستقبلات كيموكين XC. تختلف العائلات الأربعة من مستقبلات الكيموكين في تباعد بقايا السيستين بالقرب من النهاية الأمينية للمستقبل.[4]
الخصائص الهيكلية
مستقبلات الكيموكين هي واحدة من المستقبلات المقترنة بالبروتين G، تحتوي على 7 مجالات عبر غشائية.[5] تكون غالبا على سطح كريات الدم البيضاء، مما يجعله واحدة من مستقبلات شبيه الرودوبسين. هناك ما يقرب من 19 من مستقبلات الكيموكين المختلف التي تم تحديدها حتى الآن، تشترك كلها في العديد من الميزات الهيكلية المشتركة. تتألف هذه المستقبلات من حوالي 350 حمضا أمينيا، تنقسم إلى نهاية أمينية قصيرة وحمضية، سبعة مجالات عبر غشائية حلزونية مع ثلاث حلقات محبة للماء داخل خلوية وثلاثة خارج خلوية، بالإضافة إلى نهاية كربوكسيلية داخل خلوية تحتوي على بقايا سيرين وثريون التي تعمل كمواقع فسفرة خلال عملية تنظيم المستقبلات. ترتبط أول حلقتين خارج خلوية من مستقبلات الكيموكين ببعضهما البعض بواسطة رابطة ثنائي كبريتيد بين بقايا السيستئين المحفوظة. ترتبط النهاية الأمينية لمستقبلات الكيموكين بواحد من الكيموكين أو أكثر، وذلك مهم لخصوصية اللجين. تقترن بروتينات G في المقابل بمستقبلات الكيموكين على مستوى النهاية الكربوكسيلية لهذه الأخيرة، وهو أمر مهم لتأشير المستقبلات بعد ارتباط اللجين. على الرغم من أن مستقبلات الكيموكين تشترك في هوية الأحماض الأمينية العالية في تسلسلاتها الأولية، فإنها ترتبط عموما بعدد محدود من اللجينات.[6] تعد مستقبلات الكيموكين زائدة عن الحاجة من حيث وظيفتها، ذلك لأن العديد من الكيموكين قادرة على الارتباط بمستقبل واحدة.[4]
تحويل الاشارة
يعتمد التأشير بواسطة مستقبلات الكيموكين داخل الخلايا على بروتينات G المجاورة. توجد هذه الأخيرة )البروتينات G( كمثلوث مغاير؛ وهي تتألف من ثلاث وحدات فرعية متميزة. عندما يرتبط جزيء ثنائي فسفات الغوانوزين بوحدة البروتين G، يكون البروتين G في حالة غير نشطة. بعد ارتباط لجين (ربيطة) الكيموكين، تقترن مستقبلات الكيموكين بالبروتينات G. الشئ الذي يسمح بتبادل ثنائي فسفات الغوانوزين مقابل جزيء آخر يسمى ثلاثي فوسفات الغوانوزين، مع تفكك الوحدات الفرعية المختلفة لبروتين G. تقوم الوحدة الفرعية المسماة Gα بتنشيط إنزيم يعرف باسم "فسفوليباز C" (PLC) للارتباط بغشاء الخلية. يعمل الفسفوليباز C على شبك الفسفاتيديل إينوسيتول (4، 5) ثنائي الفوسفات (PIP2)، لتشكيل جزيئي مرسال ثاني يدعى ثلاثي فوسفات الإينوسيتول (IP3) وثنائي غليسيريد (DAG)؛ يقوم ثنائي الغليسيريد بتنشيط إنزيم آخر يسمى "كيناز البروتين C" (PKC)، في المقابل يؤدي تشكل ثلاثي فوسفات الإينوسيتول إلى إطلاق الكالسيوم من المخزون داخل الخلية. تعزز هذه الأحداث مزيدا من تتالي التأشير، لإحداث استجابة خلوية.[7]
على سبيل المثال، عندما يرتبط الكيموكين إنترلوكين 8 (إنترلوكين 8) بمستقبلاته المحددة، CXCR1 أو CXCR2، فإن ارتفاع الكالسيوم داخل الخلايا يؤدي إلى تنشيط إنزيم الفسفوليباز D (PLD) الذي يعمل على بدء سلسلة تأشير داخل الخلايا تدعى باسم مسار البروتين كيناز المنشط للميتوجين. في الوقت نفسه، تعمل الوحدة الفرعية α للبروتين G (Gα) مباشرة على تنشيط إنزيم يدعى باسم "بروتين التيروزين كيناز" (PTK)، والذي يعمل بدوره على فسفر بقايا السيرين والثريونين في ذيل مستقبلات الكيموكين، مما يسبب إخماد حساسيتها أو تعطيلها.[7] يعمل مسار بروتين كيناز المنشط للميتوجين الذي تم إطلاقه على تنشيط آليات خلوية محددة تشارك في الانجذاب الكيميائي، وزوال الحبيبات، وإطلاق أيونات الأكسيد الفائق، بالإضافة إلى تغيرات في رغابة جزيئات التصاق خلوية تدعى انتغرينات.[6]
تلعب الكيموكينات ومستقبلاتها دورا حاسما في الانبثاثات السرطانية لأنهم يشاركون في التسربات (تسرب الخلايا سرطانية عبر الشعيرات الدموية لدخول الأعضاء)، الأورام الخبيثة الصغيرة، وتولد الأوعية.[4] يشبه دور الكيموكين هذا بشكل مدهش وظيفته الطبيعية المتمثلة في توطين كريات الدم البيضاء في موقع الالتهاب.[4]
الانتقاء الطبيعي لمستقبلات الكيموكين C5 (CCR5)
يستخدم فيروس العوز المناعي البشري مستقبلات الكيموكين CCR5 لاستهداف وإصابة الخلايا التائية المضيفة عند البشر. حيث يعمل على إضعاف الجهاز المناعي عن طريق تدمير الخلايا التائية المساعدة CD4+، ما يجعل الجسم أكثر عرضة للعدوى الأخرى. CCR5-Δ32 هو البديل الأليلي لجين CCR5 بعد تعرضه لطفرة نادرة تؤدي لحذف 32 زوجا، ينتج عنها مستقبلات مبتورة. الأشخاص الذين يحملون هذا الأليل يقاومون بشكل طبيعي مرض الإيدز، ذلك أن فيروس العوز المناعي البشري لا يستطيع الارتباط بمستقبلات الكيموكين CCR5 غير الوظيفية. هناك تواتر مرتفع بشكل غير عادي لهذا الأليل لدى السكان القوقازيين الأوروبيين.[8] عزا معظم الباحثين التردد الحالي لهذا الأليل إلى اثنين من الأوبئة الرئيسية التي سبق وانتشرت على مر تاريخ البشرية : الطاعون والجدري. على الرغم من أن هذا الأليل قد نشأ قبل ذلك بكثير، إلا أن تواتره قد ارتفع بشكل كبير منذ حوالي 700 عام.[8] هذا ما دفع العلماء إلى الاعتقاد بأن الطاعون الدبلي كان بمثابة ضغط انتقائي قاد في نهاية المطاف إلى ارتفاع تردد الأليل CCR5-Δ32.
كانت هناك تكهنات بأن الأليل المتحول قد وفر الحماية ضد اليرسينيا الطاعونية، التي تعد عاملا مسببا للطاعون. دحضت العديد من الدراسات التي أجريت على الفئران في الحية هذه الإدعاءات، بعدما تبين عدم إظهار أي تأثير وقائي لأليل CCR5-Δ32 عند الفئران المصابة ببكتيريا اليرسينيا الطاعونية.[9][10]
هناك نظرية أخرى اكتسبت فيما بعد مزيدا من الدعم العلمي، ذلك أنها تربط التردد الحالي للأليل مع وباء الجدري. على الرغم من أن الطاعون قد أودى بحياة عدد أكبر من الأشخاص في فترة زمنية معينة، إلا أن مرض الجدري قد استمر في حصد مزيد من الأرواح على مراحل.[8] بما أن تاريخ الجدري قد يعود إلى حوالي 2000 عام، فإن فترة زمنية أطول من شأنها أن تمنح الجدري وقتا كافيا لممارسة ضغط انتقائي بالنظر إلى الأصل السابق لـCCR5-Δ32.[8] توفر النماذج الوراثية السكانية التي تحلل التوزيع الجغرافي والزمني للطاعون والجدري دليلا أقوى على أن الجدري المحدد للأليل CCR5-Δ32.[8] يمتلك الجدري معدل وفيات أعلى من الطاعون، وغالبا ما يصيب الأطفال دون سن العاشرة.[8] من وجهة نظر تطورية، ينتج عن هذا خسارة أكبر للقدرة التناسلية للسكان، مما قد يفسر زيادة الضغط الانتقائي للجدري الذي أدى في التهاية إلى حدوث الطفرة. من الناحية الإحصائية، كان الجدري أكثر انتشارا في المناطق التي لوحظت فيها ترددات أعلى لـ CCR5-Δ32. ينتمي الورم المخاطي والجدري الكبير إلى نفس مجموعة الفيروسات وقد ثبت أن الورم المخاطي يستخدم أيضا مستقبل الكيموكين CCR5 لدخول مضيفه.[11] علاوة على ذلك، ومن ناحية أخرى فإن اليرسينيا هي بكتيريا متميزة بيولوجيا عن الفيروسات ومن غير المرجح أن تكون لها آلية مماثلة للانتقال.
عائلات مستقبلات الكيموكين
تنقسم مستقبلات الكيموكين إلى أربع عائلات فرعية، تضم كل منها عددا من الأعضاء؛ هي كالآتي:
- مستقبلات الكيموكين CXC (تتكون من سبعة أعضاء)
- مستقبلات الكيموكين CC (مكونة من عشرة إلى أحد عشر عضوا)
- مستقبلات الكيموكين C (عضو واحد، XCR1)
- مستقبلات الكيموكين CX3C (عضو واحد، CX3CR1).
اكتشفت حتى الآن خمسين من الكيموكينات، يرتبط معظمها بعائلات CXC وCC.[4] هناك أساسا نوعان من الكيموكينات المرتبطة بهذه المستقبلات هما الكيموكينات الالتهابية و الكيموكينات الاستتبابية. يتم التعبير عن الكيموكينات الالتهابية عند تنشيط الكريات البيضاء، في حين أن الكيموكينات الاستتبابي تظهر تعبيرا مستمرا.[3]
انظر أيضا
مراجع
- Murphy PM, Baggiolini M, Charo IF, Hébert CA, Horuk R, Matsushima K, Miller LH, Oppenheim JJ, Power CA (2000). "International union of pharmacology. XXII. Nomenclature for chemokine receptors". Pharmacol. Rev. 52 (1): 145–76. PMID 10699158. مؤرشف من الأصل (abstract page) في 09 أغسطس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Murphy PM (2002). "International Union of Pharmacology. XXX. Update on chemokine receptor nomenclature". Pharmacol. Rev. 54 (2): 227–9. doi:10.1124/pr.54.2.227. PMID 12037138. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Allen, Samantha J.; Crown, Susan E.; Handel, Tracy M. (2007-01-01). "Chemokine: receptor structure, interactions, and antagonism". Annual Review of Immunology. 25: 787–820. doi:10.1146/annurev.immunol.24.021605.090529. ISSN 0732-0582. PMID 17291188. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kakinuma, Takashi; Hwang, Sam T. (2006-04-01). "Chemokines, chemokine receptors, and cancer metastasis". Journal of Leukocyte Biology. 79 (4): 639–651. doi:10.1189/jlb.1105633. ISSN 0741-5400. PMID 16478915. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Arimont A, Sun S, Smit MJ, Leurs R, de Esch IJ, de Graaf C (2017). "Structural Analysis of Chemokine Receptor-Ligand Interactions". J Med Chem. 60 (12): 4735–4779. doi:10.1021/acs.jmedchem.6b01309. PMC 5483895. PMID 28165741. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Murdoch C, Finn A (2000). "Chemokine receptors and their role in inflammation and infectious diseases". Blood. 95 (10): 3032–43. PMID 10807766. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Murdoch, Craig; Finn, Adam (2000). "Chemokine receptors and their role in inflammation and infectious diseases". Blood. 95: 3032–3043. PMID 10807766. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Galvani, Alison P.; Slatkin, Montgomery (2003-12-09). "Evaluating plague and smallpox as historical selective pressures for the CCR5-Delta 32 HIV-resistance allele". Proceedings of the National Academy of Sciences of the United States of America. 100 (25): 15276–15279. doi:10.1073/pnas.2435085100. ISSN 0027-8424. PMC 299980. PMID 14645720. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mecsas, Joan; Franklin, Greg; Kuziel, William A.; Brubaker, Robert R.; Falkow, Stanley; Mosier, Donald E. (2004-02-12). "Evolutionary genetics: CCR5 mutation and plague protection". Nature. 427 (6975): 606. doi:10.1038/427606a. ISSN 1476-4687. PMID 14961112. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Styer, Katie L.; Click, Eva M.; Hopkins, Gregory W.; Frothingham, Richard; Aballay, Alejandro (2007-07-01). "Study of the role of CCR5 in a mouse model of intranasal challenge with Yersinia pestis". Microbes and Infection / Institut Pasteur. 9 (9): 1135–1138. doi:10.1016/j.micinf.2007.04.012. ISSN 1286-4579. PMC 2754264. PMID 17644454. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lalani, A. S.; Masters, J.; Zeng, W.; Barrett, J.; Pannu, R.; Everett, H.; Arendt, C. W.; McFadden, G. (1999-12-03). "Use of chemokine receptors by poxviruses". Science. 286 (5446): 1968–1971. doi:10.1126/science.286.5446.1968. ISSN 0036-8075. PMID 10583963. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الأحياء
- بوابة الكيمياء الحيوية
