ثنائي كبريتيد
ثنائي الكبريتيد هي مجموعة وظيفية صيغتها 'R−S−S−R. وتسمى كذلك رابطة-SS وأحيانا جسر ثنائي الكبريتيد، وتُشتق عادة من تفاعل مجموعتي ثيول. الرابطة عبارة عن بيركبريتيد (بيرسلفيد)، مقارنة بالمجانس بيروكسيد ('R−O−O−R)، لكن هذا النمط من التسمية نادر الاستخدام باستثناء الإشارة إلى الهيدروكبريتيدات (مركبات R−S−S−H).

في الكيمياء العضوية يرمز ثنائي الكبريتيد عادة إلى الأنيون S22− (−S−S−) على سبيل المثال ثنائي كلوريد ثنائي الكبريت.
ثنائيات كبريتيد عضوية
ثنائيات الكبريتيد المتناظرة هي مركبات صيغتها R2S2، ومعظم ثنائيات الكبريتيد المتواجدة في كيمياء الكبريت العضوية متناظرة. ثنائيات الكبريتيد غير المتناظرة (تسمى كذلك ثنائيات الكبريت المتباينة) هي مركبات صيغتها 'RSSR وهي أقل شيوعا في الكيمياء العضوية، لكن معظم ثنائيات الكبريتيد في الطبيعية غير متناظرة.
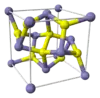 |  | 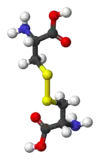 | 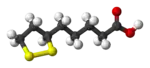 | 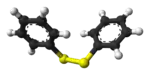 |
FeS2 "ذهب المغفلين" | S2Cl2 مركب كيميائي صناعي شائع | سيستين رابط تشابكي في العديد من البروتينات | حمض الليبويك فيتامين | Ph2S2 مركب كيميائي صناعي شائع |
خصائص
روابط ثنائي الكبريتيد قوية، مع طاقة تفكك رابطة قدرها 60 كيلو كالوري/مول (251 كيلوجول.مول-1)، لكنها أضعف بـ 40% من الروابط C−C وC−H، في الغالب رابطة ثنائي الكبريتيد هي "الوصلة الأضعف" في العديد من الجزيئات. فضلا عن ذلك، لكونها تعكس قابلية استقطاب الكبريت ثنائي التكافؤ، رابطة S-S عرضة للتفكك بواسطة الكواشف القطبية سواء المحبة للإلكترون أو خاصة المحبة للنواة (Nu):[1]
- −RS−SR + Nu− → RS−Nu + RS
طول رابطة ثنائي الكبريتيد حوالي 2.05 أنغستروم، أطول بحوالي 0.5 أنغستروم عن الرابطة C-C. الدوران حول المحور S-S عرضة للحاجز المنخفض [الإنجليزية]. تُظهر رابطة ثنائي الكبريتيد تفضيلا خاصا للزويا الزوجية التي تقارب 90°، وحين تقترب الزاوية من 0° أو 180° يكون ثنائي الكبريتيد مؤكسدا أفضل بشكل معتبر. تسمى ثنائيات الكبريتيد التي يكون فيها الجذران R متماثلان بالمتناظرة، ومن الأمثلة: ثنائي فينيل ثنائي الكبريتيد وثنائي ميثيل ثنائي الكبريتيد. حين لا يكون الجذران R متماثلان، يقال عن المركب أنه ثنائي كبريتيد غير متناظر أو مختلط.[2]
رغم أن هدرجة ثنائي الكبريتيد في العادة غير عملية، إلا أن ثابت توازن التفاعل يمنح قياسا لاحتمال الاختزال المعياري لثنائي الكبريتيد:
- RSSR + H2 → 2 RSH
قيمة القياس حوالي -250 ميلي فولت مقابل قطب الهيدروجين المعياري (الأس الهيدروجيني =7). بالمقارنة احتمال الاختزال المعياري للفيريدوكسين هو حوالي -430 ميلي فولت.
طالع أيضاً
مراجع
- Cremlyn, R. J. (1996). An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons. ISBN 0-471-95512-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sevier, C. S.; Kaiser, C. A. (2002). "Formation and transfer of disulphide bonds in living cells". Nature Reviews Molecular Cell Biology. 3 (11): 836–847. doi:10.1038/nrm954. PMID 12415301. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء الحيوية
- بوابة الكيمياء
