متلازمة انحلال الدم اليوريمية
متلازمة انحلال الدم اليوريمية[1] أو متلازمة انحلال الدم اليوريميائية[2] (م.ا.د.ي.) وتسمى أيضاً (متلازمة-Gasser) (بالإنجليزية: Hemolytic-uremic syndrome)، هي مرض يأخذ بأوعية الدم الدقيقة وبذلك فهو أحد ضربَيْ اعْتِلالِ الأَوعِيَةِ الدَّقيقَةِ الخُثارِيّ.[3][4][5] إذ تدمر لأسباب مختلفة- غالباً سموم البكتيريا- الخلايا وتؤذَى وظيفة الكلية. هذه المتلازمة النادرة تصيب الأطفال والرضّع بالدرجة الأولى وتكون بذلك السبب الأشيع لقصور كلوي حاد.
| Hemolytic-uremic syndrome | |
|---|---|
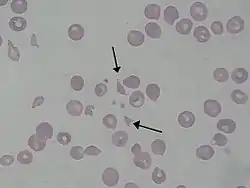 كريات منفلقة كما ترى لدى مريض مصاب بمتلازمة انحلال الدم اليوريمي كريات منفلقة كما ترى لدى مريض مصاب بمتلازمة انحلال الدم اليوريمي | |
| معلومات عامة | |
| الاختصاص | طب الكلى |
| من أنواع | اعتلال الكلية |
| الإدارة | |
| أدوية | |
الوبائيات
تعد الأرجنتين الدولة التي لديها أعلى معدل إصابة.[6][7][8][9] في الولايات المتحدة يقدر معدل الإصابة الإجمالي بـ 2.1 حالة لكل 100000 شخص / سنة، مع ذروة حدوث تتراوح بين ستة أشهر وأربع سنوات من العمر[10]، في عام 2006 ظهر وباء الإشريكية القولونية الضارة في الولايات المتحدة بسبب تلوث السبانخ.[10]
الخصائص والأشكال
تمتاز الـ م.ا.د.ي. بـــ :
- فقْرِ الدَّمِ الانْحِلالِيِّ النَّاجِمِ عَن اعْتِلالِ الأَوعيةِ الدَّقيقة (فقدان الكريات الحمر بأذية الأوعية الدقيقة).
- قِلَّةِ الصُّفَيحات.
- قصور كلوي حاد.
إن وجدت علامات المرض الثلاث فإنه يُدعى متلازمة انحلال الدم اليوريمي الاعتلالي المعوي الكلي، أما إذا وجدت علامتان فيدعى متلازمة انحلال الدم اليوريمي الاعتلالي المعوي الغير كلي. تُقسم متلازمة انحلال الدم اليوريمي عادة إلى ضربٍ نمطي مصحوبٍ بإسهال، سببه غالباً العدوى وضرب لا نمطي لا يصحبه إسهال. كلا الضربين يظهر عند الأطفال والكبار. الضرب النمطي يظهر غالباً عند الأطفال، أما اللانمطي فيظهر عند الكبار.
الأعراض
بعد تناول الطعام الملوث، يمكن أن تظهر الأعراض الأولى للعدوى من يوم إلى 10 أيام ولكن عادة 3-4 أيام.[11] بعد ذلك ويمكن أن تشمل هذه الأعراض الإسهال (الذي غالبًا ما يكون دمويًا)، وتشنجات في المعدة، وحمى خفيفة، أو إقياء[12] يؤدي إلى الجفاف وندرة البول.[11]
تظهرالمتلازمة عادةً بعد 5-10 أيام من ظهور الأعراض الأولية، وكما يمكن أن تظهر بعد 3 أسابيع.[12] تشمل الأعراض: الخمول، انخفاض إنتاج البول، الدم في البول، الفشل الكلوي، انخفاض عدد الصفيحات الدموية، تدمير خلايا الدم الحمراء (فَقْرُ الدَّمِ الانْحِلالِيُّ النَّاجِمُ عَن اعْتِلالِ الأَوعِيَةِ الدَّقيقَة). يمكن أن يحدث ارتفاع ضغط الدم واليرقان (لون أصفر في الجلد وبياض العين) ونوبات ونزيف.[12] في الجلد. في بعض الحالات، هناك تغيرات عصبية بارزة.[13][14][15]
عادةً ما يُظهر الأشخاص المصابون بمتلازمة انحلال الدم اليوريمية أعراض اعتلال الأوعية الدقيقة الخثاري ، والتي يمكن أن تشمل آلامًا في البطن [16]، انخفاض عدد الصفائح الدموية[17]، ارتفاع إنزيم نازع لهيدروجين اللاكتات LDH (مادة كيميائية تنطلق من الخلايا التالفة، وبالتالي فهي علامة على الضرر الخلوي).[18][18]
فقر الدم (انخفاض عدد خلايا الدم الحمراء)، فصيمات كروية (أجزاء خلايا الدم الحمراء التالفة تُرى بفحص اللطاخة الدموية)[17][18] ، ارتفاع الكرياتينين (منتج نفايات بروتينية ينتج عن التمثيل الغذائي للعضلات ويتم التخلص منه كلويًا) [19]، بيلة بروتينية (تدل على إصابة الكلى)[20]، تخليط(هذيان)[16] ، التعب[21]، التورم(الوذمة)[22] والغثيان/الإقياء[23] والإسهال.[24] بالإضافة إلى ذلك، يعاني المرضى المصابون بـ AHUS عادةً من ظهور مفاجئ لعلامات وأعراض جهازية مثل الفشل الكلوي الحاد[17]، وارتفاع ضغط الدم[21] ، احتشاء عضلة القلب (النوبة القلبية)[25]، السكتة الدماغية[16]، مضاعفات الرئة، التهاب البنكرياس وكبد، نوبة صرع وغيبوبة.[17][20][26][27][28]
الأسباب
الــ م.ا.د.ي. النمطية سببها الرئيسي بكتيريا الأمعاء المنتجة لسم-Shiga: الإشريكيّة القولونية أو إشريكية قولونية أخرى منتجة للـ Vero-toxin أو شيغيلة زحارية. وبما أن البكتيريا في هذا المرض لا تغادر الأمعاء ولا تجتاز الغشاء القاعدي لظهارة الأمعاء ولا تصل إلى الدم، فإننا في هذه الحالة لا نتحدث عن عدوى بل عن انسمام بكتيري. الإصابة بــ م.ا.د.ي. له أيضاً علاقة بالعدوى الفيروسية، وخاص في الإنفلونزا (النزلة الوافدة). الــ م.ا.د.ي. اللانمطية سببها زرع نقي العظم أو معالجة كابتة للمناعة بعد الزرع أو في الحمل أو السرطان أو العلاج الكيميائي أو نقص المناعة المكتسب. كما أن العوامل الجينية لها دور أيضاً.
التشخيص
أوجه التشابه بين متلازمة انحلال الدم اليوريمي النموذجية وغير النمطية وبين فرفرية نقص الصفيحات التخثرية تجعل التشخيص التفريقي ضروريًا.[27][29] تتميز جميع هذه الاعتلالات الدقيقة الخثارية الجهازية الثلاثة المسببة للأمراض بنقص الصفيحات وانحلال الدم الجزئي، بالإضافة إلى واحد أو أكثر مما يلي: الأعراض العصبية (على سبيل المثال: التخليط، والتشنجات الدماغية، والنوبات)؛ القصور الكلوي، ارتفاع الكرياتينين، انخفاض معدل الترشيح الكبيبي المقدر، تحليل البول غير الطبيعي)؛ وأعراض الجهاز الهضمي (مثل الإسهال والغثيان أو الإقياء وآلام البطن والتهاب المعدة والأمعاء).[21][24] لا يستبعد وجود الإسهال كسبب لاعتلال الأوعية الدقيقة الخثاري، حيث يعاني 28٪ من المرضى الذين يعانون من متلازمة انحلال الدم غير النمطية من الإسهال و/أو التهاب المعدة والأمعاء. غالبًا ما يتم التشخيص الأول لمتلازمة انحلال الدم غير النمطية في سياق عدوى أولية مسببة للمكملات، وقد تم أيضًا تورط ذيفان الشيغيلا كمحفز يحدد المرضى الذين يعانون من متلازمة انحلال الدم غير النمطيةaHUS. بالإضافة إلى ذلك ، ففي إحدى الدراسات تم اكتشاف طفرات في الجينات التي تشفر العديد من البروتينات التنظيمية التكميلية في 8 من 36 (22٪) مريضًا تم تشخيصهم بمتلازمة الانحلالي- اليوريمي النمطي. ومع ذلك فإن عدم وجود طفرة جينية تنظيمية مكملة محددة لا تمنع الانحلالي غير النمطي.[30]
يفتقر حوالي 50٪ من المرضى الذين يعانون من متلازمة انحلال الدم اليوريمية غير النمطية إلى طفرة يمكن تحديدها في الجينات المنظمة التكميلية.
تدعم المتابعة التشخيصية التشخيص التفريقي لاعتلال الأوعية الدقيقة الجهازي الخثاري. يؤكد الاختبار الإيجابي سبب متلازمة انحلال الدم اليوريمية النمطية ويؤكد النقص الشديد Shiga -oxin / EHEC ADAMTS13 (أقل من ≤5٪ من المستويات الطبيعية) تشخيص فرفرية نقص الصفيحات الخثارية.[31]
العلاج
يشمل العلاج الرعاية الداعمة وقد يشمل غسيل الكلى، والستيرويدات، ونقل الدم، وفصادة البلازما.[32][33] بينما يتم استخدام عقار إيكوليزوماب لعلاج متلازمة انحلال الدم اليوريمية غير النمطية، في حين لا يوجد دليل حتى عام 2018 يدعم استخدامه في الأشكال الرئيسية من متلازمة انحلال الدم الانحلالي.[32]
الإنذار
يحدث الفشل الكلوي الحاد في 55-70٪ من الأشخاص المصابين بمتلازمة انحلال الدم اليوريمي، على الرغم من استعادة ما يصل إلى 70-85٪ من وظائف الكلى.[34] المرضى الذين يعانون من متلازمة انحلال الدم غير النمطية لديهم نتائج سيئة بشكل عام ، مع تقدم ما يصل إلى 50 ٪ إلى الداء الكلوي بمراحله الأخيرة أو تلف الدماغ الذي لا رجعة فيه. يموت ما يصل إلى 25٪ خلال المرحلة الحادة.[34] ومع ذلك ، مع العلاج القوي ، ينجو أكثر من 90٪ من المرضى من المرحلة الحادة لمتلازمة انحلال الدم اليوريمي. ما يقرب من ثلث الأشخاص الذين يعانون من متلازمة انحلال الدم اليوريمية يعانون من خلل في وظائف الكلى بعد عدة سنوات ، ويحتاج عدد قليل منهم إلى غسيل كلوي طويل الأمد. يعاني 8٪ من الأشخاص المصابين بمتلازمة انحلال الدم اليوريمية من مضاعفات أخرى مدى الحياة ، مثل ارتفاع ضغط الدم ، والنوبات ، والعمى ، والشلل ، وآثار إزالة جزء من القولون. معدل الوفيات الإجمالي من متلازمة انحلال الدم اليوريمي هو 5-15٪ الأطفال وكبار السن لديهم توقعات أسوأ.[35]
الوقاية
يتم تفادي الإصابة بالمرض بشكل كبير عن طريق إتباع الأتي:
- الحفاظ على النظافة
- فصل المواد الغذائية النيئة عن المطبوخة
- الطهي الجيد للأطعمة
- حفظ الأطعمة في درجات حرارة آمنة
- استخدام المياه والمواد الخام المأمونة
مراجع
- المعجم الموحد نسخة محفوظة 19 أغسطس 2017 على موقع واي باك مشين.
- قاموس تشخيص الأمراض نسخة محفوظة 19 أغسطس 2017 على موقع واي باك مشين.
- Robert Koch Institute. "Technical Report: EHEC/HUS O104:H4 Outbreak, Germany, May/June 2011" (PDF). Berlin, Germany: Robert Koch Institute. مؤرشف من الأصل (PDF) في 08 أبريل 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zoja, C; Buelli, S; Morigi, M (2010). "Shoga toxin-associated hemolytic uremic syndrome: pathophysiology of endothelial dysfunction". Pediatr Nephrol. 25 (11): 2231–2240. doi:10.1007/s00467-010-1522-1. PMID 20424866. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ståhl, A.-L.; Vazir-Sani, F.; Heinen, S.; et al. (2008). "Factor H dysfunction in patients with atypical hemolytic uremic syndrome contributes to complement deposition on platelets and their activation". Blood. 111 (11): 5307–5317. doi:10.1182/blood-2007-08-106153. PMID 18268093. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rivero, MA; Passucci, JA; Rodriguez, EM; Signorini, ML; Tarabla, HD; Parma, AE (2011). "Factors associated with sporadic verotoxigenic Escherichia coli infection in children with diarrhea from the Central Eastern Area of Argentina". Foodborne Pathogens and Disease. 8 (8): 901–6. doi:10.1089/fpd.2010.0800. PMID 21492023. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rivas, M; Caletti, MG; Chinen, I; Refi, SM; Roldán, CD; Chillemi, G; Fiorilli, G; Bertolotti, A; Aguerre, L; Sosa Estani, S (2003). "Home-prepared hamburger and sporadic hemolytic uremic syndrome, Argentina". Emerging Infectious Diseases. 9 (9): 1184–6. doi:10.3201/eid0909.020563. PMC 3016759. PMID 14531383. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rivero, MA; Padola, NL; Etcheverría, AI; Parma, AE (2004). "Enterohemorrhagic Escherichia coli and hemolytic–uremic syndrome in Argentina". Medicina. 64 (4): 352–6. PMID 15338982. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "What is HUS?" (PDF). مؤرشف من الأصل (PDF) في 10 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Corrigan JJ, Boineau FG (November 2001). "Hemolytic–uremic syndrome". Pediatr Rev. 22 (11): 365–9. doi:10.1542/pir.22-11-365. PMID 11691946. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "E.coli (Escherichia coli): Symptoms". مراكز السيطرة على الأمراض والوقاية منها. وزارة الصحة والخدمات البشرية. 2017-11-30. مؤرشف من الأصل في 26 يوليو 2020. اطلع عليه بتاريخ 22 نوفمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Hemolytic uremic syndrome (HUS)". Center for Acute Disease Epidemiology. Iowa Department of Public Health. مؤرشف من الأصل في 07 أغسطس 2020. اطلع عليه بتاريخ 21 نوفمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Boyer, O; Niaudet, P (August 2011). "Hemolytic Uremic Syndrome: New Developments in Pathogenesis and Treatments". Int J Nephrol. 2011: 908407. doi:10.4061/2011/908407. PMC 3159990. PMID 21876803. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kumar, V; Cotran, RS; Robbins, SL, المحررون (2002). Robbins Basic Pathology. Philadelphia, PA: Saunders. ISBN 978-0721692746. مؤرشف من الأصل في 10 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nathanson, S.; Kwon, T.; Elmaleh, M.; et al. (2010). "Acute neurological involvement in diarrhea-associated hemolytic uremic syndrome". Clin J Am Soc Nephrol. 5 (7): 1218–1228. doi:10.2215/CJN.08921209. PMC 2893076. PMID 20498239. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ohanian, M; Cable, C; Halka, K (2011). "Eculizumab safely reverses neurologic impairment and eliminates the need for dialysis in severe atypical hemolytic uremic syndrome". Clin Pharmacol. 3: 5–12. doi:10.2147/CPAA.S17904. PMC 3262387. PMID 22287852. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Loirat, C; Noris, M; Fremaux-Bacchi, V (2008). "Complement and the atypical hemolytic uremia syndrome in children". Pediatr Nephrol. 23 (11): 1957–1972. doi:10.1007/s00467-008-0872-4. PMC 6904381. PMID 18594873. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Caprioli, J.; Noris, M.; Brioschi, S.; et al. (2006). "Genetics of HUS: the impact of MCP, CFH, and IF mutations on clinical presentation, response to treatment, and outcome". Blood. 108 (4): 1267–1279. doi:10.1182/blood-2005-10-007252. PMC 1895874. PMID 16621965. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ariceta, Gema; Besbas, Nesrin; Johnson, Sally; et al. (2009). "Guideline for the investigation and initial therapy of diarrhea-negative hemolytic uremic syndrome". Pediatr Nephrol. 24 (4): 687–696. doi:10.1007/s00467-008-0964-1. PMID 18800230. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sellier-Leclers, A.-L.; Fremeaux-Bacchi, V.; Dragon-Durey, M.-A.; et al. (2007). "Differential impact of complement mutations on clinical characteristics in atypical hemolytic uremic syndrome". J Am Soc Nephrol. 18 (8): 2392–2400. doi:10.1681/ASN.2006080811. PMID 17599974. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Noris, M.; Caprioli, J.; Bresin, E.; et al. (2010). "Relative role of genetic complement abnormalities in infrequent and familial aHUS and their impact on clinical phemotype". Clin J Am Soc Nephrol. 5 (10): 1844–1859. doi:10.2215/CJN.02210310. PMC 2974386. PMID 20595690. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ståhl, A.-L.; Vazir-Sani, F.; Heinen, S.; et al. (2008). "Factor H dysfunction in patients with atypical hemolytic uremic syndrome contributes to complement deposition on platelets and their activation". Blood. 111 (11): 5307–5317. doi:10.1182/blood-2007-08-106153. PMID 18268093. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dragon-Durey, M.-A.; Sethi, S. K.; Bagga, A.; et al. (2010). "Clinical features of anti-factor H autoantibody-associated hemolytic uremic syndrome". J Am Soc Nephrol. 21 (12): 2180–2187. doi:10.1681/ASN.2010030315. PMC 3014031. PMID 21051740. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zuber, J; Le Quintrec, M; Sberro-Scussan, R; Loirat, C; Fremaux-Bacchi, V; Legendre, C (2011). "New insights into postrenal transplant hemolytic uremic syndrome". Nature Reviews Nephrology. 7 (1): 23–35. doi:10.1038/nrneph.2010.155. PMID 21102542. S2CID 2054556. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sallee, M; et al. (2010). "Myocardial infarction is a complication of factor H-associated atypical HUS". Nephrol Dial Transplant. 25 (6): 2028–2032. doi:10.1093/ndt/gfq160. PMID 20305136. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Noris, M; Remuzzi, G (2009). "Atypical hemolytic–uremic syndrome". نيو إنغلاند جورنال أوف ميديسين. 361 (17): 1676–1687. doi:10.1056/NEJMra0902814. PMID 19846853. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Benz, K; Amann, K (2010). "Thrombotic microangiopathy: new insights". Current Opinion in Nephrology and Hypertension. 19 (3): 242–247. doi:10.1097/MNH.0b013e3283378f25. PMID 20186056. S2CID 25429151. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mache, CJ; et al. (2009). "Complement inhibitor eculizumab in atypical hemolytic uremic syndrome". Clin J Am Soc Nephrol. 4 (8): 1312–1316. doi:10.2215/CJN.01090209. PMC 2723971. PMID 19556379. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zipfel, PF; Heinen, S; Skerka, C (2010). "Thrombotic microangiopathies: new insights and new challenges". Current Opinion in Nephrology and Hypertension. 19 (4): 372–378. doi:10.1097/MNH.0b013e32833aff4a. PMID 20539230. S2CID 28419. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gangnadoux, MF; Habib, R; Gubler, MC; Bacri, JL; Broyer, M (1996). "Long-term (15-25 years) outcome of childhood hemolytic–uremic syndrome". Clin Nephrol. 46 (1): 39–41. PMID 8832149. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zhen, XL; et al. (2010). "Multiple domains of ADAMTS13 are targeted by autoantibodies against ADAMTS13 in patients with acquired idiopathic thrombotic thrombocytopenic purpura". Haematologica. 95 (9): 1555–1562. doi:10.3324/haematol.2009.019299. PMC 2930958. PMID 20378566. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cody, EM; Dixon, BP (February 2019). "Hemolytic Uremic Syndrome". Pediatric Clinics of North America. 66 (1): 235–246. doi:10.1016/j.pcl.2018.09.011. PMID 30454746. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Hemolytic uremic syndrome". Genetic and Rare Diseases Information Center (GARD) (باللغة الإنجليزية). مؤرشف من الأصل في 29 يناير 2020. اطلع عليه بتاريخ 21 نوفمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Parmar, MS (2010). "Hemolytic–uremic syndrome". Medscape EMedicine. مؤرشف من الأصل في 08 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chu, P; Hemphill, RR (2004). "222: Acquired hemolytic anemia". Emergency Medicine: A Comprehensive Study Guide (الطبعة 6th). New York, NY: McGraw-Hill. ISBN 978-0-07-138875-7. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب
- بوابة مطاعم وطعام
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز