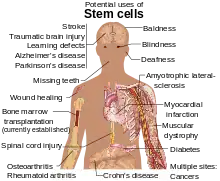
علاج بالخلايا الجذعية
تتحدث هذة المقالة عن العلاج الطبي. لمعرفة نوع الخلية شاهد الخلايا الجذعية.
العلاج باستخدام الخلايا الجذعية هو زراعة خلايا بشرية أو حيوانية لتعويض الخلايا أو الأنسجة التالفة في محاولة لعلاج الأمراض. قد يستخدم العلاج الخلوي والعلاج الجيني معا للوصول لأفضل النتائج. أي استخدام الخلايا الجذعية للعلاج أو الوقاية من مرض أو حالة معينة. و زراعة النخاع العظمي هو العلاج بالخلايا الجذعية الأكثر استخداما لكن بعض العلاجات المشتقة من دماء الحبل السري تستخدم أيضا. و لا يزال البحث جار في طريقه لتطوير مصادر مختلفة للخلايا الجذعية ولاستخدام هذه الخلايا في معالجة أمراض الأعصاب التنكسية، السكري، أمراض القلب وحالات اخرى. مع قدرة العلماء على عزل وزراعة خلايا الجنين الجذعية، ومع تزايد مقدرتهم في إنتاج الخلايا الجذعية عن طريق نقل نواة الخلية الجسدية وتقنيات لخلق الخلايا الجذعية المحفزة متعددة القدرات ظهر الجدل بما يتعلق بسياسة الإجهاض والاستنساخ البشري. كما أثارت الجهود التي تسوّق العلاج المرتكز على زراعة دماء الحبل السري المخزنة الجدل والخلاف.
الاستخدامات الطبية
معلومات اضافية: زرع الخلايا الجذعية المتعلقة بتكون الدم.
على مدى ثلاثين سنة، تم استخدام النخاع العظمي لعلاج مرضى السرطان المصابين بأمراض مثل ابيضاض الدم والورم اللمفي؛ هذا هو الشكل الوحيد من أشكال العلاج بالخلايا الجذعية الذي يمارس على نطاق واسع.[1][2][3] أثناء المعالجة الكيميائية، تموت معظم الخلايا المتنامية بالعوامل السامة للخلايا. مع ذلك لا تستطيع هذه المواد التمييز بين ابيضاض الدم أو الخلايا الورمية والخلايا الجذعية المتعلقة بتكون الدم الموجودة في النخاع العظمي. هذا هو الأثر الجانبي من استراتيجيات العلاج الكيميائي التقليدي الذي يحاول زرع الخلايا الجذعية عكسه؛ النخاع العظمي الصحي للمتبرع يعيد الخلايا الجذعية الفعالة لاستبدال الخلايا المفقودة والتالفة في جسم المضيف خلال فترة العلاج. الخلايا المزروعة تولد ايضًا استجابة مناعية تساعد على قتل الخلايا السرطانية؛ لكن هذة العملية قد تخرج عن السيطرة وتؤدي إلى داء الطعم حيال الثوي والذي يعد أخطر الآثار الجانبية لهذا العلاج.[4]
هنالك نوع آخر من العلاج باستخدام الخلايا الجذعية ويسمى بروشيمال، تمت الموافقة عليه بشروط في كندا عام 2012 للسيطرة على داء الطعم حيال الثوي الحاد في الأطفال الذين لم يستجيبوا للمنشطات.[5] إنه علاج جذعي خيفي يعتمد على علاج اللحمة المتوسطة الجذعية (MSCs) المشتقة من النخاع العظمي لدى المتبرع البالغ. يتم تنقية الMSCs من النخاع، زراعتهم وتعبئتهم، مع ما يصل إلى 10,000 جرعات مستمدة من متبرع واحد. تخزن الجرعات مجمدة لحين الحاجة إليها.[6]
وافقت إدارة الأغذية والعقاقير على خمسة منتجات للخلايا الجذعية المتعلقة بتكون الدم المستمدة من دماء الحبل السري، لعلاج أمراض الدم والمناعة.[7]
في 2014، أوصت وكالة الأدوية الأوروبية الموافقة على holoclar، علاج يشمل الخلايا الجذعية، لاستخدامها في الاتحاد الأوروبي. يستخدم holoclar للأشخاص الذين يعانون من نقص الخلايا الجذعية الحوفي الشديد بسبب حروق في العين.[8]
في مارس 2016 علاج Strimvelis شركة جلاكسو سميث كلاين (GSK 2696273) لعلاج -SCID ADA وأوصى للحصول على موافقة الاتحاد الأوروبي.[9]
البحث
التنكس العصبي
أجريت الأبحاث لمعرفة ما إذا يمكن استخدام الخلايا الجذعية لمعالجة تنكس الدماغ، كما هو الحال في مرض باركنسون، التصلب الجانبي الضموري والزهايمر.[10][11][12] وكانت هناك دراسات أولية تتعلق بالتصلب المتعدد .[13][14]
إن أدمغة البالغين الأصحاء تحتوي على خلايا جذعية عصبية تقسم إما للحفاظ على أعداد الخلايا الجذعية عامة، أو لتصبح خلايا السلف. في الحيوانات البالغة، تهاجر خلايا السلف داخل الدماغ وتعمل في المقام الأول للحفاظ على الخلايا العصبية للشم. تم الإبلاغ أن التفعيل الدوائي للخلايا الجذعية العصبية داخلية المنشأ يحث على الحماية العصبية والشفاء السلوكي في نماذج الفئران البالغة التي تعاني من اضطراب عصبي.[15][16][17]
إصابات الدماغ والحبل الشوكي
السكتة الدماغية وإصابات الدماغ الرضحية تؤدي إلى موت خلوي، يتميز بفقدان الخلايا العصبية و oligodendrocytes داخل الدماغ. كانت تجربة سريرية صغيرة تجري في اسكتلندا في عام 2013، حيث تم حقن الخلايا الجذعية في أدمغة مرضى السكتة الدماغية.[18]
أجريت دراسات سريرية وحيوانية لاستخدام الخلايا الجذعية في حالات إصابات الحبل الشوكي.[19][20][21]
القلب
تم مؤخرا الكشف عن الكثير من التناقضات [22] في الأعمال الأولية التي سجلت ل Bodo-Eckehard Strauer .[23] فمن خلال تجارب سريرية عديدة في بعض المختبرات تم إثبات العلاج بالخلايا الجذعية البالغة كوسيلة فعالة، ناجحة وآمنة في حالات الاحتشاءات القديمة [24] والحديثة[25] والفشل القلبي الغير ناتجة عن احتشاء العضلة القلبية.[26] بينما أثبتت الدراسات الأولية على الحيوانات نتائج علاجية رائعة [27][28] ، كانت التجارب السريرية ذات نتائج مقبولة إحصائيا.[29][30] ومن الأسباب المحتملة لهذا الاختلاف والفرق في النتائج أعمار المرضى [31] ، توقيت العلاج [32] ، وجود احتشاء بالعضلة القلبية مؤخرا.[33] ومن الممكن التغلب على هذه العوائق من خلال علاج إضافي يزيد فاعلية العلاج بالخلايا الجذعية [34] أو يجعل الطريقة أكثر فاعلية. أما عن الدراسات الحديثة فهي تختلف كثيرا بتقنيات المعالجة وأنواع الخلايا وتوقيت وطريقة العلاج والخصائص التي تمت دراستها مما يجعلها صعبة المقارنة وهنا تظهر الحاجة لأبحاث المقارنة .
ومن الخلايا الجذعية المستخدمة في علاج احتشاء عضلة القلب الخلايا الجذعية المشتقة من نخاع العظم الذاتي ومن الممكن استخدام خلايا جذعية ناضجة مشتقة من النسيج الشحمي (الدهني).[35] وقد كان استخدام الخلايا الجذعية الناضجة في علاج أمراض القلب متوافر تجاريا في خمس قارات على الأقل في عام 2007 [citation needed]
من الطرق المستخدمة بالعلاج:[10]
- توليد خلايا عضلية قلبية
- تحفيز نمو أوعية دموية جديدة لإعادة تأهيل الأنسجة المتضررة
- إفراز عوامل النمو
- استخدام طرق علاجية أخرى
ومن المحتمل تمايز خلايا نخاع العظم الناضجة إلى خلايا عضلية قلبية.[10]
حدثت أول عملية دمج ناجحة من الخلايا القلبية المشتقة من خلايا جنينية بشرية في خنازير غينية في أغسطس عام 2012، وقد تم تسجيل قوة انقباض القلب بعد أربعة أسابيع من تعريض الخنازير لجلطة قلبية وعلاجها وقد انقبضت الخلايا بقوة متزايدة ولكن لم يعرف ما إذا كانت النتائج الإيجابية قد حصلت بفعل التأثير الكهربائي الحركي الناتج من الخلايا البشرية. وستركز الأبحاث المستقبلية على زراعة الخلايا حول الأنسجة المتضررة بشكل قوي ومعرفة أي المصدرين (الخلايا الجذعية الجنينية أو الناضجة) هو الأكثر فاعلية في العلاج .[36]
وقد احتوت تقاريرعام 2013 - والتي تناولت التأثيرات القوية والمفيدة للخلايا الجذعية الذاتية المشتقة من نخاع العظم على وظيفة البطين في القلب - على الكثير من الاختلافات .[37] وبشكل عام، فإن عدد المرضى الذين أعلن عن تجريب العلاج بالخلايا الجذعية عليهم أكثر من عدد الخلايا الجذعية المعالجة في المختبرات، وقد تم إجراء تحقيق عالمي في هذا الموضوع أغلق في عام 2012 بدون أي نتائج وقد أعيد فتحه عام 2013 .[38]
وتعتبر فائدة استخدام المعالجة بالخلايا الجذعية للنسيج القلبي وتجديده بعد أي حالة فشل قلبي أو تضرر بالأنسجة من المجالات الطبية الواعدة .[39]
في البداية كانت التطورات في مجال المعالجة مرتبطة بشكل نسبي على قدرة خلايا نخاع العظم على التمايز إلى خلايا قلبية؛[27] بحيث كانت قدرة الخلايا غير المعدلة على التمايز إلى نسيج قلبي غير كافية، ولكنّ تطور تقنيات حديثة واعدة في مجال معالجة وتعديل الخلايا لتتمايز إلى خلايا قلبية مولدة قبل زراعتها سهّل هذه العملية .[40]
تكوين خلايا الدم
ما يميز الخلايا المناعية المرجعية البشرية أنها تسمح للجسم البشري في الدفاع عن نفسه من المستضدات سريعة التكيف. و مع ذلك فإن الجهاز المناعي هو عرضة للتفكك مع تكون المرض وبسبب الدور الحاسم الذي يلعبه في الدفاع العام، فإن تدهوره غالبًا ما يكون قاتل للكائن الحي ككل ويتم تشخيص أمراض الخلايا المكونة للدم وتصنيفها عبر التخصصات الفرعية لعلم الأمراض المعروفة باسم أمراض الدم خاصية الخلايا المناعية هي التي تسمح للجسم بالتعرف على المستضدات الغريبة مما يتسبب في مزيد من الصعوبة في علاج أمراض المناعة. يجب أن يتطابق النسيج المتبرع به مع أنسجة المتبرع له لنجاح عملية زراعة النسيج، ولكن الحصول على أنسجة متوافقة غير شائع، حتى بين الأقارب من الدرجة الأولى. إن البحوث باستخدام كل من الخلايا الجذعية المكونة للدم عند الكبار والخلايا الجذعية الجنينية فتحت المجال لدراسة آليات وطرق العلاج الممكنة لكثير من هذه الامراض.
يمكن توليد خلايا دم حمراء بشرية ناضجة تمامًا بواسطة خلايا جذعية مكونة للدم، والتي هي خلايا بدائية لتكوين الدم خارج الجسم البشري. في هذه العملية، تزرع الخلايا الجذعية المكونة للدم جنبًا إلى جنب مع الخلايا اللحمية، مما يخلق بيئة تحاكي ظروف نخاع العظام، وهو الموقع الطبيعي لنمو خلايا الدم الحمراء الإريثروبويتين، وهو عامل نمو، يضاف لجعل الخلايا الجذعية تستكمل التمايز النهائي لتكوين خلايا الدم الحمراء.[41] تطوير البحث العلمي في هذه التقنية من الممكن أن يحقق فوائد محتملة في مجالات العلاج بالجينات ونقل الدم والعلاج بالأدوية الموضعية.
الأسنان المفقودة
في عام 2004، اكتشف العلماء في كلية كنجز في لندن طريقة لزراعة(cultivate) سن كامل في الفئران[42] وكانوا قادرين على تنمية الأسنان المهندسة بيولوجيًا القائمة بذاتها في المختبر. إن الباحثين واثقون من أن تكنولوجيا تجدد الأسنان يمكن أن تستخدم لزراعة الأسنان الحية في المرضى البشر. من الناحية النظرية، الخلايا الجذعية المأخوذة من المريض يمكن أن (coaxed) في المختبر إلى أن تتحول إلى برعم السن، والتي عند زراعتها في اللثة سوف تعطي أسنانًا جديدة، ويتوقع أن تكون نمت في وقت أكثر من ثلاثة اسابيع.[43] وسوف تلتحم مع عظم الفك وتفرز مواد كيميائية تشجع الأعصاب والأوعية الدموية على الاتصال معها. وهذه العملية شبيهة لما يحدث عندما ينمو البشر أسنانهم الأصلية. لا يزال هنالك العديد من التحديات، مع ذلك، قبل أن تصبح الخلايا الجذعية خيارًا لاستبدال الأسنان المفقودة في المستقبل.[44][45]
لا يزال البحث مستمرًا في مختلف المجالات، في التماسيح التي هي(polyphyodonts) تنمو الأسنان اللاحقة لتصل إلى 50 مرة(أسنان بديلة صغيرة) تحت كل سن عملي ناضج للاستبدال مرة في السنة.[46]
إعادة نمو خلايا شعر القوقعة
أفادت الباحثة هيلير نجاحها في إعادة إنماء الخلايا الشعرية للقوقعة باستخدام خلايا جذعية جنينة.[47]
العمى وضعف الرؤية
منذ عام 2003، نجح الباحثون بزراعة خلايا القرنية الجذعية في العيون المتضررة لاستعادة النظر. "تحصد من الأجنة المجهضة صفائح من خلايا الشبكية المستخدمة من قبل الفريق، والتي يجدها بعض الناس مرفوضة." عندما تزرع هذه الصفائح على القرنية المتضررة، تحفز الخلايا الجذعية تجديد الإصلاح، واستعادة الرؤية في نهاية المطاف.[48] وكانت أحدث هذه التنمية في يونيو 2005، عندما استطاع باحثون في مستشفى الملكة فيكتوريا في ساسكس إنجلترا استعادة نظر أربعين مريض باستخدام نفس التقنية. تمكنت المجموعة بقيادة شيراز دايا من استخدام الخلايا الجذعية التي تم الحصول عليها من المريض، قريب أو حتى جثة بنجاح. ما تزال التجارب جارية.[49]
في أبريل 2005، زرع أطباء في المملكة المتحدة خلايا قرنية جذعية من متبرع بالأعضاء إلى قرنية ديبورا كايتلن، وهي امرأة أصيبت بالعمى في إحدى عينيها عندما ألقي حامض في عينها في ملهى ليلي. القرنية، التي هي الغطاء الشفاف للعين، تعد موقعًا مناسبا جدًا للزراعة. في الواقع، كانت أول عملية زراعة أعضاء ناجحة في الإنسان هي عملية زرع القرنية. إن غياب الأوعية الدموية داخل القرنية يجعل من هذه المنطقة هدفًا سهلًا نسبيًا للزراعة. إن أغلبية عمليات زراعة القرنية التي تجرى حاليًا هي من أجل مرض تحللي في القرنية يعرف بالقرنية المخروطية.
أفادت تقارير مستشفى جامعة نيو جيرسي أن نسبة النجاح لنمو خلايا جديدة من الخلايا الجذعية المزروعة يتراوح من 25 في المئة إلى 70 في المئة.[50]
في عام 2014، أظهر الباحثون أن الخلايا الجذعية التي تم جمعها كخزعات من القرنيات البشرية المتبرع بها قد تمنع تكون الندوب دون إثارة الرفض في فئران ذوي القرنيات المتضررة.[51]
في يناير 2012، نشرت مجلة لانسيت ورقة علمية لستيفن شوارتز، في معهد جولز ستاين لأمراض العين التابع لجامعة كاليفورنيا لوس أنجلوس، تذكر حالة امرأتين أصيبتا قانونيًا بالعمى نتيجة لمرض ضمور بقعة الشبكية، وأنهما شهدتا تحسنًا جذريًا في مستوى الرؤية بعد حقن الشبكية بخلايا جذعية جنينة بشرية.[52]
في يونيو 2015، نشرت دراسات طب العيون بالخلايا الجذعية (اسكتلندا) الذي يعتبر أكبر دراسات الخلايا الجذعية البالغة في طب العيون (www.clinicaltrials.gov NCT # 01920867) النتائج الأولية على المريض مع مرض العصب البصري الذي تحسن من 20/2000 إلى 20 / 40 بعد العلاج بنخاع الخلايا الجذعية المشتقة من العظام.[53]
السكري
يفقد مرضى السكري وظيفة خلايا بيتا المنتجة للأنسولين في البنكرياس.[54] في التجارب الحديثة، كان العلماء قادرون على تحويل الخلايا الجذعية الجنينية إلى خلايا بيتا في المختبر. من الناحية النظرية إذا تمت زراعة خلايا بيتا بنجاح، سيتمكن العلماء من استبدال الخلايا العاطلة عن العمل في مرضى السكري.[55]
نقل وزراعة الأعضاء
يمكن تنمية الخلايا الجذعية الجنينية البشرية في مزرعة خلوية وتحفيزها لتكوين خلايا منتجة للإنسولين، التي من الممكن زرعها في جسم المريض.
مع ذلك، فإن النجاح السريري يعتمد بشكل كبير على تطوير العمليات التالية:[10]
- الخلايا المزروعة يجب أن تتكاثر
- الخلايا المزروعة يجب أن تفرق بطريقة خاصة بالموقع
- الخلايا المزروعة يجب أن تبقى على قيد الحياة في جسم المتلقي (تفادي رفض الزراعة)
- الخلايا المزروعة يجب أن تتداخل مع الأنسجة المستهدفة
- الخلايا المزروعة يجب أن تقوم بإعادة وظيفة الخلايا المستقبلة عن طريق التداخل مع البيئة المضيفة
جراحة تقويم العظام
تم الإبلاغ عن دراسات سريرية في علاج حالات جراحة تقويم العظام. إلى الآن، يبدو أن التركيز في دراسة رعاية العضلات يتمحور حول الخلايا الجذعية المتعلقة باللحمة المتوسطة. نشر سينتينو دليلًا على زيادة حجم الغضروف والهلالة في الأفراد الخاضعين (كلا على حدة) عن طريق صورة رنين مغناطيسي.[56][57] لم تنشر نتائج التجارب التي تشمل عددًا كبيرًا من الأفراد الخاضعين بعد. مع ذلك، صدرت دراسة سلامة أجريت على 227 مريض على مدى 3-4 سنوات تظهر سلامة كافية وحد أدنى من المضاعفات المرتبطة بالخلايا الجذعية المتعلقة باللحمة المتوسطة.[58]
ونشر واكيتاني أيضًا سلسلة قضايا صغيرة تتكون من تسعة عيوب في خمس ركب تحوي زراعة جراحية للخلايا الجذعية المتعلقة باللحمة المتوسطة مع تغطية العيوب الغضروفية المعالجة.[59]
شفاء الجروح
من الممكن أيضًا استخدام الخلايا الجذعية لتحفيز نمو الأنسجة البشرية. في البالغين، عادة ما تستبدل الأنسجة المتضررة بالندب، التي تتميز بالجلد ببنية كولاجين غير منتظمة، فقدان بصيلات الشعر وبنية غير منتظمة في الأوعية الدموية. في حال تضرر الأنسجة الجنينية، على أي حال، يستبدل النسيج المتضرر بنسيج طبيعي عن طريق الخلايا الجذعية.[60] هنالك طريقة ممكنة لتجديد النسيج عند البالغين وهي وضع خلية جذعية بالغة "بذور" داخل سرير أنسجة "تربة" في سرير الجرح والسماح للخلايا الجذعية بتحفيز التمايز في خلايا سرير النسيج. هذه الطريقة تظهر استجابة للتجديد أقرب ما تكون لشفاء الجروح الجنينية من تشكل الندوب لدى البالغين.[60] لا يزال الباحثون يتحرون جوانب مختلفة من "تربة" الأنسجة المؤدية إلى التجديد.[60]
العقم
زراعة الخلايا الجذعية الجنينية البشرية في خلايا المبيض الليفية غير الفعالة(mitotically) عند الخنزير يؤدي إلى تمايزها إلى خلايا جنسية (الخلية السلف للخلايا البيضية والنطاف)، كما يتضح من تحاليل الرموز الجينية.[61]
تم تحفيز الخلايا الجذعية الجنينية البشرية لتنتج خلايا شبيهة بخلايا النطفة، ومع ذلك لا يزال هنالك تشوه بسيط.[62] ومن الممكن أن يعالج فقد النطاف بكفاءة عالية.
في عام 2012، تم عزل خلايا بزرة البيضة الجذعية من مبايض الإنسان والفئران البالغة وبرهنت أنها قادرة على إنتاج بويضات ناضجة.[63] وهذه الخلايا لديها القدرة على علاج العقم.
الايدز ( متلازمة نقص المناعة )
تدمير جهاز المناعة من قبل فايروس نقص المناعة المكتسبة(الإيدز) مُقاد من قبل خساره CD4+ وهو بروتين سكري يكون على سطح خلايا T المناعية المساعدة في الدم والعقد الليمفاوية، الدخول الفايروسي لخلايا CD4+ يتم بواسطة التفاعل مع مستقبِلات التنشيط الكيميائي على سطح الخلايا، بالمجمل هما CcR5 و CXR41 أي أنهما هما المواقع التي يرتبط عليها الفيروس؛ وذلك لأن عملية تتابع التناسخ وتكاثر الفيروس تحتاج لجين خلوي لعملية التكثير، خلايا CD4+ تكون الهدف الأوّلي لفايروس نقص المناعة المكتسبة.[64] مؤخرا قام العلماء بعمليات استقصاء وتحقيق في عمليات بديلة لعلاج للفيروس، بناء على تصنيع جهاز مناعة مُقاوم للمرض من خلال زرع خلايا ذاتية المنشأ، جينات معدّلة (مقاومة للمرض)، والخلايا الجذعية المكوُّنة لخلايا الدم الحمراء، والخلايا المولدة(GM-HSPC) .[65]
التجارب السريرية
قالب:المزيد من المعلومات على
GRNOPC1 في 23 من كانون الثاني لعام 2009، أعطت منظمة الغذاء والدواء الأمريكية التخليص لشركة جيرون لبدء أول تجربة سريرية على الخلايا الجذعية الجنينية على البشر. هذه التجربة تهدف إلى تقييم الدواء GRNOPC1 ( وهو خلايا جذعية مشتقة من خلايا مولدة قليلة التفرع )، على المرضى الذين يعانون من إصابات خاصة في النخاع الشوكي. التجربة تم إيقافها في نوفمبر 2011 حتى يتسنى للشركة أن تركز على العلاجات في"البيئة الحالية لندرة رأس المال والظروف الاقتصادية غير المحتمة".[66] في عام 2013 اكتسبت التكنولوجيا الحيوية وشركة الطب المتجدد صفقة جيرون للخلايا الجذعية، بهدف استئناف التجارب السريرية.[67]
استخدام الخلايا الجذعية المخزنة مسبقا لقد رأى الخبراء العلميون أن استخدام الخلايا الجذعية بعد تخزينها وتجميدها لفترة يقلل من فاعليتها في العلاج وقدرتها على التمايزمقارنة بالخلايا الجذعية الحديثة ( الطازجة ) والتي تعد في طور النمو؛ لذلك يجب إعادة زراعة وتنمية الخلايا الجذعية المخزنة مسبقا لتصبح في طور النمو قبل استخدامها في العلاج السريري، حيث أثبتت الكثير من التجارب السريرية التي استخدمت الخلايا المخزنة مباشرة دون إعادة زراعتها فشلها مقارنة بتلك التجارب التي أعادت نموها وتربيتها .[68]
حيوانات أخرى
تطبيقات بيطري
توزيعات الجهد على الطب البيطري
الأبحاث حاليًا تطبق على الخيول، الكلاب والقطط، التي من الممكن أن تكون مفيدة في تطوير العلاج بالخلايا الجذعية في الطب البيطري وتستهدف نطاق واسع من الإصابات والأمراض مثل احتشاء عضلة القلب، السكتة الدماغية وتأذي الأوتار والأربطة، التهاب المفاصل، والداء العظمي الغضروفي والضمور العضلي كلاهما في الحيوانات الكبيرة، كما الإنسان.[69][70][71][72] بينما الأبحاث التي تعتمد على العلاجات المرتكزة على الخلية بشكل عام تعكس الاحتياجات الطبية الإنسانية، الدرجة العالية من التواتر وحدة بعض الإصابات في سباق الخيول وضعت الطب البيطري في طليعة هذا النهج الروائي التجديدي.[73] مزاملة الحيوانات تستطيع أن تخدم بطريقة طبية سريرية عدة نماذج ذات صلة مع الأمراض البشرية.[74][75]
تطوير نماذج العلاج التجديدية
- يعتقد أن الخلايا الجذعية تساعد على الترميم عن طريق خمسة آليات أساسية: 1) منح أثر مضاد للالتهابات. 2) تستهدف الأنسجة المتضررة وتجنيد خلايا أخرى مثل خلايا السلف البطانية، الضرورية لنمو الأنسجة. 3) دعم إعادة تشكيل النسيج المساندة على تشكيل الندبة. 4) تثبيط موت الخلايا المبرمج. 5) تستطيع الانقسام إلى أنسجة عظمية،غضروفية، وترية ورابطة.[76][77]
من أجل توفير التغذية الدموية للمناطق المتضررة، وبالتالي تحفز تجديد الأنسجة، الصفائح الدموية الغنية بالبلازما من الممكن أن تستخدم مع زراعة الخلايا الجذعية.[78][79] فعالية بعض الخلايا الجذعية من الممكن أن تتأثر في أسلوب التوصيل؛ على سبيل المثال، لتجديد العظم، الخلايا الجذعية عادة ما تقدم على سقالة بحيث تنتج المعادن الضرورية لتكوين العظم الوظيفي.[78][79][80][81]
تبين أن الخلايا الجذعية تمتلك مناعة منخفضة بسبب العدد القليل نسبيًا من جزيئات التوافق النسيجي الرئيسي المركبة المتواجدة على سطحها.إضافة إلى ذلك وجد أنها تفرز منشطات كيميائية تقوم بتغيير الاستجابة المناعية وتزيد القدرة الاحتمالية للنسيج الجديد. هذا يسمح للعلاج الخيفي بأن يطبق من دون خطورة رفض مرتفعة.[82]
مصادر الخلايا الجذعية
التطبيقات البيطرية لعلاج الخلايا الجذعية كوسيلة من وسائل تجديد الأنسجة شكلت بطريقة كبيرة عن طريق البحث الذي بدأ مع استخدام الخلايا الجذعية اللحمية البالغة من أجل علاج الحيوانات التي تعاني من إصابات أو عيوب مؤثرة على العظم، الغضروف، الأربطة و\أو الأوتار.[83][84][85] هناك فئتان من الخلايا الجذعية تستخدم في العلاجات: خلايا جذعية خيفية مشتقة من واهب جيني مختلف من نفس الأصناف[81][86] وخلايا جذعية لحمية ذاتية المنشأ، المشتقة من مريض قبل استخدامها في علاجات مختلفة.[78] فئة ثالثة، خلايا جذعية ذو جينات خارجية، أو خلايا جذعية مشتقة من اصناف مختلفة، تستخدم بشكل أولي لأهداف دراسية خاصة للعلاجات البشرية.[87]
معظم الخلايا الجذعية معدة للعلاج التجديدي التي هي منعزلة بشكل عام إما من نخاع العظم للمريض أو من النسيج الدهني.[79][81] الخلايا الجذعية اللحمية من الممكن أن تتمايز لخلايا بناءة للعظم، غضروف، أوتار وأربطة كما العضلة، عصبي وأنسجة سلف أخرى، لطالما درس الصنف الرئيسي من الخلايا الجذعية في علاج الأمراض التي تؤثر على هذه الأنسجة.[84][88] عدد الخلايا الجذعية التي تم نقلها وزراعتها للنسيج المتضررة من الممكن أن تغير فعالية العلاج. وفقًا لذلك، الخلايا الجذعية المأخوذة من شفاطات نخاع العظم، على سبيل المثال، تزرع في مختبرات متخصصة من أجل أن نموها لملايين الخلايا.[79][81] رغم أن النسيج المشتق من الدهون يتطلب عملية سابقة للاستخدام، منهجية الزراعة للخلايا الجذعية المشتقة من الدهن غير واسعة النطاق كما الخلايا المشتقة من نخاع العظم.[89][90] في حين إنه يعتقد أن الخلايا الجذعية المشتقة من نخاع العظم مفضلة لإصلاح العظم، الغضروف، الأربطة والوتر، يعتقد آخرون أن تقنيات التجميع ذات الصعوبة الأقل والبيئة المتعددة الخلايا المكروية متواجدة في كل الأحوال في أجزاء الخلايا الجذعية المشتقة من الدهن مما يجعل الأخير مصر مفضل لنقل وزراعة الخلايا ذاتية المنشأ.[78]
مصادر جديدة من الخلايا الجذعية اللحمية، حاليًا موضع للبحث، متضمنة الخلايا الجذعية الموجودة في الجلد وطبقة الجلد الداخلية التي هي محط اهتمام بسبب التخفيف الذي من الممكن أن يتم حصاده مع أقل خطورة للحيوان.[91] الخلايا الجذعية الدموية تم اكتشاف أنها تنتقل في الدورة الدموية وتملك قدرة تمايز كافية كما الخلايا الجذعية اللحمية الأخرى، مرة أخرى مع تقنية حصاد غير اجتياحية.[92]
حاليًا هناك المزيد من الاهتمام في استخدام خلايا جذعية لحمية لا جنينية. حاليًا الأبحاث في طريقها لتجربة قدرات الخلايا الجذعية للتمايز الموجودة في الحبل السري، الكيس المحي والمشيمة للحيوانات المختلفة. يعتقد أن الخلايا الجذعية لديها قدرة تمايز أكثر من نظرائها الناضجة، يتضمن قابلية الأنسجة التي شكلت بالفعل ذات مصدر أديم باطن لو أذيم باطن.[82]
الخلايا الجذعية وإصلاح النسيج الصلب
بسبب القابلية الإيجابية العامة للشفاء للخلايا الجذعية، اكتسبت الاهتمام لعلاج الجروح الجلدية. هذا الاهتمام العالي لهؤلاء ذو المقدرة الشفائية المنخفضة، مثل مرضى السكري، وهؤلاء الذين يخضعون للعلاج الكيميائي. في تجربة واحدة، الخلايا الجذعية عزلت من هلام وارتون الخاص بالحبل السري. هذه الخلايا حقنت بشكل مباشر في الجروح. في ظرف أسبوع، تمت إعادة بناء خلايا باطنية بشكل كامل للجروح، مقارنة بإعادة بناء الخلايا الباطنية الثانوية في عملية التعامل مع الجروح. هذا أيضًا يظهر القابلية للخلايا الجذعية اللحمية في إصلاح النسيج الخارجي للجلد.[93]
عيوب الحنك الرخو في الخيول بسبب الفشل الجنيني للغلق التام في خط الوسط خلال مرحلة التكوين الجنيني. هذا عادة لا نجده لغاية إلا عندما يصبح أسوأ بسبب صعوبة رؤية الحنك الرخو بشكل كامل. يعتقد أن قلة نسبة النجاح في المداخلات الجراحية لإصلاح العيوب يوعز إلى قلة القدرة على رؤية الحنك الرخو. بالمحصلة، عادة ما تنتهي هذه الحالة بالموت الرحيم للحصان. حاليًا، استخدام الخلايا الجذعية اللحمية للعلاجات التقليدية. بعدما يقفل الجراح الحنك، تحقن خلايا لحمية ذاتية المنشأ في الحنك الرخو. وجد أن الخلايا الجذعية تتداخل في عملية شفاء النسيج خاصة على طول حد النسيج القديم. كما يوجد انخفاض كبير في عدد الخلايا الالتهابية، التي يعتقد أنها تساعد في عملية الشفاء.[94]
الخلايا الجذعية وإصلاح العظام
وكانت العلاجات المستندة إلى الخلايا الجذعية ذاتية المنشأ لإصابات الأربطة، والأوتار، التهاب المفاصل، داء العظم الغضروفي، وخراجات العظام شبه الغضروفي متاحة تجاريًا لمزاولة الأطباء البيطريين لعلاج الخيول منذ عام 2003 في الولايات المتحدة، ومنذ عام 2006 في المملكة المتحدة. وأصبحت متاحة العلاجات القائمة على الخلايا الجذعية ذاتية المنشأ لإصابات الأربطة، والأوتار، التهاب المفاصل، في الكلاب للأطباء البيطريين في الولايات المتحدة منذ عام 2005. وأكثر من 3000 خيول وكلاب مملوكة لدى قطاع الخاص تم علاجها باستخدام الخلايا الجذعية الدهنية المشتقة ذاتية المنشأ. وقد ظهرت فعالية هذه العلاجات في تجارب سريرية مزدوجة التعمية للكلاب التي تعاني من التهاب المفاصل في الورك والكوع والخيول التي تعاني من ضرر في الأوتار.[95][96]
إصلاح الأوتار
الخيول التي تستخدم في السباق عرضة وبشكل خاص لإصابات الأوتار والأربطة. إن العلاجات التقليدية غير ناجحة في إعادة قدرة الحصان على العمل بشكل كامل. العلاج الطبيعي، مسترشد في ذلك العلاجات التقليدية، يؤدي إلى تكون ندبة ليفية والتي بدورها تقلل من مرونة وحركة المفاصل الكاملة. منعت العلاجات التقليدية عددًا كبيرًا من الخيول من العودة إلى النشاط الكامل، ولدى هذه العلاجات أيضًا نسبة عالية من إعادة الإصابة نظرًا لطبيعة الوتر الصلبة. إن إدخال كل من نخاع العظم والخلايا الجذعية الدهنية المشتقة، بجانب التحفيز الميكانيكي الطبيعي عزز تجديد أنسجة الوتر. روجت الحركة الطبيعية محاذاة الألياف الجديدة والتيندوسايتس مع المحاذاة الطبيعية الموجودة في الأوتار السليمة. إن العلاج بالخلايا الجذعية لم يسمح لمزيد من الخيول بالعودة إلى العمل بشكل الكامل فقط بل أيضًا قلص إلى حد كبير معدل إعادة الإصابة على مدى فترة ثلاث سنوات أو أكثر.[82]
وفي الآونة الأخيرة، تم تطبيق استخدام الخلايا الجذعية الجنينية لإصلاح الأوتار. وقد أظهرت الخلايا الجذعية الجنينية أن لديها معدل أفضل من خلايا البالغين الجذعية للبقاء على قيد الحياة في الأوتار وأن لديها أيضًا مقدرة أفضل على الهجرة للوصول إلى جميع المناطق التالفة في الوتر. وكانت أيضًا نوعية الإصلاح الشامل لدى هذه الخلايا أعلى، مع بنية وتر وتشكيل كولاجين أفضل. ولم يظهر هنالك أي ورم خلال الفترة التجريبية( ثلاثة أشهر). يجب إجراء دراسات طويلة الأجل التي يتعين الاضطلاع عليها لدراسة الفعالية والمخاطر المرتبطة باستخدام الخلايا الجذعية الجنينية على المدى الطويل.[82] تم العثور على نتائج مماثلة في الحيوانات الصغيرة.[82]
تصليح المفصل
يعد الفصال العظمي السبب الرئيسي لآلام المفاصل في كل من الحيوانات والبشر. تصاب في معظم الأحيان الخيول والكلاب بمرض التهاب المفاصل. تجديد الغضروف الطبيعي محدود جدًا ولا يوجد أي علاجات أو عقاقير شافية حاليًا، وإنما ننظر إلى تقليل الأعراض المصاحبة للتنكس. لا تزال أنواع مختلفة من الخلايا الجذعية المتعلقة باللحمة المتوسطة والمواد الأخرى المضافة قيد البحث للعثور على أفضل نوع من الخلايا وأفضل طريقة لعلاج طويل الأمد.[82]
إن خلايا اللحمة المتوسطة الدهنية المشتقة هي الأكثر استخدامًا حاليًا بسبب الحصاد غير الغزوي. وكان هناك الكثير من النجاح مؤخرًا في حقن الخلايا الجذعية المتعلقة باللحمة المتوسطة مباشرة في المفصل. هذه تقنية غير غزوية تم تطويرها مؤخرًا لتسهيل الاستخدام السريري. وأظهرت الكلاب التي تتلقى هذا العلاج مرونة أفضل في المفاصل وألم أقل.[97]
إصلاح خلل العظام
إنه لمن الضروري وجود المزيد من الدراسات التي توصف تمامًا طريقة استخدام العلاجات المستندة إلى الخلايا لعلاج كسور العظام، لدى العظام عملية شفاء طبيعية فريدة وموثقة جيدًا، وهي في العادة كافية لإصلاح الكسور والإصابات الأخرى الشائعة. إن الفواصل المنحرفة نتيجة لصدمة شديدة، أو نتيجة لأمور مثل استئصال ورم من سرطان العظام، تكون عرضة لتضميد الجراح غير اللائق إذا تركت للعملية الطبيعية وحدها. يتم تصنيف السقالات التي تتألف من مكونات طبيعية واصطناعية مع الخلايا الجذعية الوسيطة ويتم وضعها في العيب. في غضون أربعة أسابيع من وضع السقالة، تبدأ العظام التي شكلت حديثًا بالتداخل مع العظام القديمة خلال 32 أسبوع، ويتحقق الاتحاد الكامل.[98] إن مزيدًا من الدراسات لازمة لتوصيف استخدام العلاجات المستندة إلى الخلايا لعلاج كسور العظام.
تم استخدام الخلايا الجذعية لعلاج أمراض العظام التنكسية أيضًا. إن العلاج الموصى به عادة للكلاب التي تعاني من مرض ليغ كالفيه بيرثيز هو إزالة رأس عظم الفخذ بعد أن يقدم على الانحطاط. مؤخرًا، تم حقن الخلايا الجذعية الوسيطة مباشرة في رأس عظمة الفخذ، مع نجاح ليس فقط في تجديد العظام، ولكن أيضًا في الحد من الألم.[98]
الخلايا الجذعية وإصلاح العضلات
وقد استخدمت بنجاح الخلايا الجذعية لتحسين الشفاء في قلوب الكلاب بعد إصابتهم باحتشاء عضلة القلب. أزيلت الخلايا الجذعية المشتقة من الخلايا الدهنية ونخاع العظم وتم وضعها على خلية قلبية قبل حقنها في القلب. بعد أربعة أسابيع من تطبيق العلاج بالخلايا الجذعية تبين أن انقباض القلب تحسن وأن هناك انخفاض في المنطقة المتضررة.[99]
هنالك تجربة مختلفة جارية حاليًا لرقعة مصنوعة من مادة مسامية يتم زراعة الخلايا الجذعية فيها من أجل تحفيز تجديد الأنسجة في عيوب القلب. تجددت الأنسجة واندمجت الرقعة بشكل جيد في أنسجة القلب. ويعتقد أن سبب ذلك يعود، في جزء منه، إلى تحسين الأوعية الدموية والحد من الالتهابات. وعلى الرغم من أن الخلايا الجذعية المتعلقة باللحمة المتوسطة أنتجت (cardiomyocytes)، إلا أنها لا تبدو منقبضة . العلاجات الأخرى التي يسببها مصير القلب في الخلايا قبل الزراعة حققت نجاح كبير في خلق أنسجة القلب المنقبضة .[100]
الخلايا الجذعية وإصلاح الجهاز العصبي
تعد إصابات النخاع الشوكي واحدة من الصدمات الأكثر شيوعًا التي تجلب إلى المستشفيات البيطرية.[98] تحدث إصابات العمود الفقري بطريقتين بعد الصدمة: الضرر الميكانيكي الأساسي، وفي العمليات الثانوية، كما في الالتهابات وتشكيل الندب، في الأيام التالية للصدمة. هذه الخلايا المشاركة في الاستجابة للأضرار الثانوية تفرز العوامل التي تعزز تشكيل ندبة وتمنع تجديد الخلايا. يتم تحميل الخلايا الجذعية الوسيطة المحثة على الخلايا العصبية إلى سقالة يسهل اختراقها، ومن ثم يتم زرعها في موقع الإصابة. تفرز هذه الخلايا والسقالة عوامل مضادة لتلك التي تفرز من قبل خلايا تشكيل الندب وتشجع على التجديد العصبي. وبعد ثمانية أسابيع، أظهرت الكلاب المعالجة بالخلايا الجذعية تحسن هائل على تلك المعالجة باستخدام العلاجات التقليدية. كانت الكلاب المعالجة بالخلايا الجذعية قادرة على دعم وزنها من حين لآخر، وهذا لم يظهر في الكلاب المعالجة باستخدام العلاجات التقليدية.[101][102][103]
إن العلاجات موجودة أيضًا في التجارب السريرية؛ لإصلاح وتجديد الأعصاب الطرفية. إن الأعصاب الطرفية أكثر عرضة للتلف، ولكن آثار الضرر ليست منتشرة كما رأينا في إصابات النخاع الشوكي. العلاج حاليًا في التجارب السريرية لإصلاح الأعصاب المقطوعة، مع النجاح المبكر. الخلايا الجذعية المستحثة لمصير عصبي تحقن في العصب المقطوع. في غضون أربعة أسابيع، لوحظ تجديد في الخلايا الجذعية التالفة سابقًا، وتشكل حزم عصبية جديدة تمامًا.[91]
والخلايا الجذعية هي أيضًا في المراحل السريرية للعلاج في طب العيون. وقد استخدمت الخلايا الجذعية المكونة للدم لعلاج قرح القرنية من أصل مختلف من عدة خيول. وكانت هذه القرحة المقاومة للعلاجات التقليدية المتاحة، ولكن وردت بسرعة على نحو إيجابي في العلاج بالخلايا الجذعية. وكانت الخلايا الجذعية أيضًا قادرة على استعادة البصر في عين واحدة من حصان مع انفصال الشبكية، مما يسمح للحصان بالعودة إلى الأنشطة اليومية.[92]
التهاب القرنية والملتحمة الجاف (KCS)
وقد توجت نماذج ما قبل السريرية لمتلازمة Sjögrens [104][105] في اللجان الدائمة خيفي زرع حول الغدد الدمعية في الكلاب ش.م.ك التي كانت تخضع للعلاج الحالي. نرى تحسن كبير في عشرات في تصريف العين، فرط الدم الملتحمة، والتغيرات القرنية وشيرمر الاختبارات المسيل للدموع (اس تي تي) .[106]
الخلايا الجذعية في المختبر
القدرة على نمو أنسجة بالغة وظيفية إلى أجل غير مسمى من خلال التمايز يخلق فرصًا جديدة للبحث المتعلق بالأدوية. الباحثون قادرون على تنمية خلايا متمايزة مختلفة ثم اختبار عقاقير جديدة على كل نوع من الخلايا لدراسة التفاعلات الممكنة في المختبر قبل تنفيذ الدراسات داخل جسم الإنسان. هذا أمر بالغ الأهمية في تطوير عقاقير لاستخدامها في البحوث البيطرية بسبب إمكانية حدوث تفاعلات محددة لكل صنف. الأمل هو أن وجود هذه الخلايا المتاحة للاستخدام في البحوث سوف يقلل من الحاجة إلى استخدام الحيوانات في التجارب؛ بسبب الآثار المترتبة على الأنسجة البشرية في المختبر ستوفر نظرة ثاقبة لا تعرف عادة قبل مرحلة التجارب على الحيوانات.[87]
مع ظهور الخلايا الجذعية المحفزة (التوجيهية) أصبحت عملية تصنيع الأدوية وتركيبها أكثر اتساعا وأصبحت تستخدم لإنقاذ الحيوانات المعرضة لخطر الانقراض. بدلا من الحاجة إلى حصاد الأجنة أو البيض، والتي هي محدودة، يمكن للباحثين إزالة الخلايا الجذعية الوسيطة بسهولة أكبر والحد بشكل كبير من الخطر على الحيوانات بسبب تقنيات غير غزوية. وهذا يسمح للبيض المحدود أن يطرح للاستخدام لأغراض التناسل فقط.[87]
الخلايا الجذعية وحفظها
ويجري استكشاف الخلايا الجذعية لاستخدامها في جهود الحفاظ. تم حصد خلايا بزرة النطفة الجذعية من جرذ ووضعها في مجموعة فئران، حيث أنتجت حيوانات منوية ناضجة تمامًا، وقادرة على إنتاج ذرية قابلة للحياة. البحث جارٍ حاليًا للعثور على خلايا مضيفة مناسبة لإدخال خلايا بزرة النطفة الجذعية المانحة. إذا كان من الممكن أن يصبح هذا خيارًا قابلًا للتطبيق، يمكن أن تنتج الحيوانات المنوية من الأفراد ذو النوعية الوراثية العالية الذين يموتون قبل الوصول إلى مرحلة النضج الجنسي، والحفاظ على هذه الخلايا التي ستضيع لولا ذلك.[107]
الاستخدامات السريرية في المستقبل
يعد استخدام الخلايا الجذعية لعلاج أمراض الكبد في كل من البشر والحيوانات محور اهتمام كبير. لدى الكبد بعض الخصائص الطبيعية على التجدد، ولكن غالبًا ما تكون غير كافية للتعامل مع حدة بعض هذه الأمراض. وقد تم تشكيل خلايا الكبد من بعض مصادر MSC، لكنها لم تطبق سريريًا بعد.[98] وهناك جهد كبير لخلق خلايا جذعية متباينة على طول خط البنكرياس كعلاج محتمل لمرض السكري، ولكن لم يتم إنشاء هذا الخط جيدًا.[98]
الخلايا الجذعية الوسيطة هي حاليا قيد التجارب السريرية كعلاج محتمل لداء الطعم حيال الثوي ( مرض الرفض المناعي ) و رفض الطعم بعد عدة تجارب على الحيوانات المختلفة تبين فيها أن العلاج بالخلايا الجذعية الخيفية لم يرفض ولم يظهر أي اختلاف في قدرات الشفاء مقارنة مع الخلايا الجذعية ذاتية المنشأ. و يتم البحث في هذا المجال حاليا لاستخدام الخلايا الجذعية الخيفية في الطب البيطري التجديدي.[82] إن التجارب السريرية جارية لاستكشاف خصائص المناعة المنخفضة للخلايا الجذعية واستخدامها المحتمل لعلاج مشاكل المناعة المفرطة في الأشخاص الذين يعانون من الحساسية واضطرابات المناعة الذاتية.[87]
في السنوات الأخيرة، ظهرت عيادات الخلايا الجذعية في الولايات المتحدة لمعالجة المرضى باستخدام نخاع العظم الخاص بهم أو باستخدام الخلايا الجذعية الدهنية المشتقة البالغة كجزء من التجارب السريرية أو باستخدام برامج IRB المصرحة من إدارة الأغذية والعقاقير، وبالأخص للرياضيين ليتعافوا من الإصابات المتعلقة بال(osteoskeletal) (العظام، المفاصل والنسيج الضام). ويناقش (Rudderham) ظهور العلاج باستخدام الخلايا الجذعية للبالغين في مقالته التي كتبها عام 2012 "العلاج باستخدام الخلايا الجذعية للبالغين في الولايات المتحدة"(Adult Stem Cell US Therapy).[108]
تحتاج أن تدرس آثار هذه العلاجات طويلة الأمد خارج مساهمتها في الطب.[82] إن التحسينات الواسعة في مجال الطب البيطري سمحت للحيوانات المرافقة ولحيوانات المزارع بعيش حياة أطول. هذا، ومع ذلك، فقد ساهم في ارتفاع الإصابات والأمراض المزمنة في الحيوانات الأليفة.[87] العلاج بالخلايا الجذعية، وخاصة لعلاج قضايا جراحة تقويم العظام في الخيول، يسمح للحيوانات بالعودة إلى الحالة الطبيعية من النشاط في أسرع معدل مع انخفاض في معدل إعادة الإصابة.[82]
الجدال حول الخلايا الجذعية الجنينية
المقال الرئيسي: الجدل حول الخلايا الجذعية
هنالك جدل كبير حول استخدام الخلايا الجذعية الجنينية البشرية. يستهدف هذا الجدل في المقام الأول التقنيات المستخدمة لاستخلاص خلايا جذعية جنينية جديدة، والتي غالبًا ما تتطلب تدمير الكيسة الأريمية. وغالبًا ما يكون الاعتراض على استخدام الخلايا الجذعية الجنينية مبني على الاعتراضات الفلسفية أو الأخلاقية أو الدينية.[109] وهنالك أبحاث أخرى عن الخلايا الجذعية التي لا تنطوي على تدمير الأجنة البشرية، وتتضمن مثل هذه الأبحاث الخلايا الجذعية لدى البالغين، الخلايا الجذعية السلوية والخلايا الجذعية المحفزة متعددة القدرات.
حول العالم
الصين
مارست جمهورية الصين الشعبية أبحاث عن الخلايا الجذعية والعلاج باستخدام الخلايا الجذعية. وسمحت وزارة الصحة في جمهورية الصين الشعبية باستخدام العلاج بالخلايا الجذعية لظروف خارجة عن تلك المعتمدة في الدول الغربية. وكانت الصين تحت رقابة الدول الغربية لفشل محاولاتها بتلبية المعايير الدولية لتوثيق هذه التجارب والاجراءات.[110]
تعالج الشركات التي تمولها الدولة الموجودة في منطقة شنزن هاي-تيك أعراض اضطرابات عديدة باستخدام خلايا البالغين الجذعية. وتركز شركات التطوير حاليًا على علاج الاضطرابات العصبية والقلبية الوعائية. ويعد علاج المخ باستخدام خلايا البالغين الجذعية من أكثر النجاحات الراديكالية التي قامت بها الصين. تقوم هذه العلاجات بإعطاء الخلايا الجذعية مباشرة في أدمغة المرضى الذين يعانون من شلل دماغي، مرض الزهايمر، وإصابات الدماغ.
الشرق الأوسط
منذ عام 2008 حاول العديد من الأطباء والمراكز مجموعة من الأساليب المتنوعة؛ استخدمت في لبنان تقنيات تكاثرية وغير تكاثرية، في الجسم الحي وفي المختبر. وأخذ الطب التجديدي مجراه في الأردن ومصر.[111]
المكسيك
تمارس المكسيك حاليًا العلاج باستخدام الخلايا الجذعية على مستوى سريري. ويطلب تصريح وزارة الصحة الدولية(COFEPRIS). يوجد مراكز مرخصة في تيخوانا، غوادالاخارا وكانكون. و يخضع حاليًا لوس كابوس لعملية الموافقة. إن وجود هذا التصريح يسمح باستخدام الخلايا الجذعية.
كوريا الجنوبية
في عام 2005، أدعى علماء من كوريا الجنوبية أنهم استطاعوا أن ينتجوا خلايا جذعية مصممة لتتناسب مع المتلقي. وطورت كل من ال11 خلية جذعية جديدة باستخدام تكنولوجيا نقل نواة الخلية الجسدية (SCNT). واعتقدوا أن الخلايا الناتجة ستتناسب مع المادة الوراثية للمتلقي، مما يوحي أن نسبة رفض الخلية ستكون ضئيلة أو معدومة.[112]
تايلند
اعتبارًا من عام 2013، لا تزال تايلند تعتبر أن زراعة الخلايا الجذعية المتعلقة بالدم هي تجريبية فقط. بدأ كامبون سريواتاناكول تجربة سريرية في أكتوبر 2013 باستخدام 20 مريض. سيتلقى 10 منهم العلاج لمرض السكري النوع 2 باستخدام الخلايا الجذعية وال10 الآخرين سوف يتلقوا العلاج لانتفاخ الرئة باستخدام الخلايا الجذعية أيضًا. يقوم بحث كوتينانتاكول على الخلايا المكونة للدم ودورها في وظيفة الجملة المكونة للدم في التوازن والاستجابة المناعية.[113]
أوكرانيا
حاليًا، يسمح لأوكرانيا بإجراء تجارب سريرية للعلاج باستخدام الخلايا الجذعية (ترتيب الMH أوكرانيا رقم 630 "حول تنفيذ التجارب السريرية للخلايا الجذعية"، 2008) لعلاج هذه الأمراض: نخر البنكرياس، تليف الكبد، التهاب الكبد، أمراض الحروق، مرض السكري، التصلب المتعدد، نقص تروية الأطراف السفلية الحاد.مؤسسة طبية رائدة تقوم بعلاج الخلايا الجذعية المعتمدة من GMP في أوكرانيا - شبكة عيادات الخلايا الجذعية NBScience (كييف).
الدول الأخرى
بلدان أخرى حيث قام الأطباء ببحوث، وتجارب، وتلاعب، وتخزين، وعلاج الخلايا الجذعية: البرازيل، قبرص، ألمانيا، إيطاليا، فلسطين، اليابان، باكستان، الفلبين، روسيا، سويسرا، تركيا، المملكة المتحدة والهند وغيرها الكثير.
انظر أيضًا
المراجع
- Ian Murnaghan for Explore Stem Cells. Updated: 16 December 2013 Why Perform a Stem Cell Transplant? نسخة محفوظة 02 أغسطس 2017 على موقع واي باك مشين.
- Bone Marrow Transplantation and Peripheral Blood Stem Cell Transplantation In National Cancer Institute Fact Sheet web site. Bethesda, MD: National Institutes of Health, U.S. Department of Health and Human Services, 2010. Cited 24 August 2010 "نسخة مؤرشفة". Archived from the original on 13 مارس 2015. اطلع عليه بتاريخ 27 يناير 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: BOT: original-url status unknown (link) - Karanes C, Nelson GO, Chitphakdithai P, Agura E, Ballen KK, Bolan CD, Porter DL, Uberti JP, King RJ, Confer DL; Nelson; Chitphakdithai; Agura; Ballen; Bolan; Porter; Uberti; King; Confer (2008). "Twenty years of unrelated donor hematopoietic cell transplantation for adult recipients facilitated by the National Marrow Donor Program". Biology of Blood and Marrow Transplantation. 14 (9 Suppl): 8–15. doi:10.1016/j.bbmt.2008.06.006. PMID 18721775. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Malard F, Mohty M. New Insight for the Diagnosis of Gastrointestinal Acute Graft-versus-Host Disease. Mediators Inflamm. 2014;2014:701013. ببمد 24733964
- "Prochymal – First Stem Cell Drug Approved". 22 May 2012. مؤرشف من الأصل في 23 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "A Stem-Cell-Based Drug Gets Approval in Canada". 17 May 2012. مؤرشف من الأصل في 12 مايو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rosemann A. Why regenerative stem cell medicine progresses slower than expected. J Cell Biochem. 2014 Dec;115(12):2073-6. ببمد 25079695
- European Medicines Agency. "First stem-cell therapy recommended for approval in EU". مؤرشف من الأصل في 19 يونيو 2018. اطلع عليه بتاريخ 12 ديسمبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "European Ad Comm backs Glaxo's stem cell therapy Strimvelis for rare autoimmune disorder. March 2016". مؤرشف من الأصل في 6 ديسمبر 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cell Basics: What are the potential uses of human stem cells and the obstacles that must be overcome before these potential uses will be realized?. In Stem Cell Information World Wide Web site. Bethesda, MD: National Institutes of Health, U.S. Department of Health and Human Services, 2009. cited Sunday, 26 April 2009 نسخة محفوظة 12 يوليو 2017 على موقع واي باك مشين. [وصلة مكسورة]
- "Neural Stem Cells May Rescue Memory In Advanced Alzheimer's, Mouse Study Suggests". مؤرشف من الأصل في 23 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vastag B (أبريل 2001). "Stem cells step closer to the clinic: paralysis partially reversed in rats with ALS-like disease". JAMA. 285 (13): 1691–3. doi:10.1001/jama.285.13.1691. PMID 11277806. مؤرشف من الأصل في 27 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rebeiro P, Moore J. The role of autologous haemopoietic stem cell transplantation in the treatment of autoimmune disorders. Intern Med J. 2016 Jan;46(1):17-28. ببمد 26524106
- "Results Reported from Case Studies of Stem Cell Transplantation in People with Relapsing and Progressive MS". National MS Society. January 2015. مؤرشف من الأصل في 23 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Androutsellis-Theotokis A, Leker RR, Soldner F, et al. (أغسطس 2006). "Notch signalling regulates stem cell numbers in vitro and in vivo". Nature. 442 (7104): 823–6. doi:10.1038/nature04940. PMID 16799564. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Androutsellis-Theotokis A, Rueger MA, Park DM, et al. (أغسطس 2009). "Targeting neural precursors in the adult brain rescues injured dopamine neurons". Proc. Natl. Acad. Sci. U.S.A. 106 (32): 13570–5. doi:10.1073/pnas.0905125106. PMC 2714762. PMID 19628689. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Androutsellis-Theotokis A, Rueger MA, Mkhikian H, Korb E, McKay RD (2008). "Signaling pathways controlling neural stem cells slow progressive brain disease". Cold Spring Harb. Symp. Quant. Biol. 73: 403–10. doi:10.1101/sqb.2008.73.018. PMID 19022746. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ghosh, Pallab (27 May 2013 ) Stroke patients see signs of recovery in stem cell trial BBC News health, Retrieved 27 May 2013 نسخة محفوظة 30 يوليو 2016 على موقع واي باك مشين.
- Kang KS, Kim SW, Oh YH, et al. (2005). "A 37-year-old spinal cord-injured female patient, transplanted of multipotent stem cells from human UC blood, with improved sensory perception and mobility, both functionally and morphologically: a case study". Cytotherapy. 7 (4): 368–73. doi:10.1080/14653240500238160. PMID 16162459. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Team co-headed by researchers at Chosun University, جامعة سول الحكومية and the Seoul Cord Blood Bank (SCB) Umbilical cord cells 'allow paralysed woman to walk' By Roger Highfield, Science Editor. Last Updated: 1:28AM GMT 30 November 2004 نسخة محفوظة 21 يونيو 2017 على موقع واي باك مشين.
- Cummings BJ, Uchida N, Tamaki SJ, et al. (سبتمبر 2005). "Human neural stem cells differentiate and promote locomotor recovery in spinal cord-injured mice". Proc. Natl. Acad. Sci. U.S.A. 102 (39): 14069–74. doi:10.1073/pnas.0507063102. PMC 1216836. PMID 16172374. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Strauer, Bodo; Steinhoff G (September 2011). "10 years of intracoronary and intramyocardial bone marrow stem cell therapy of the heart: from the methodological origin to clinical practice". J Am Coll Cardiol. 58 (11): 1095–1104. doi:10.1016/j.jacc.2011.06.016. PMID 21884944. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Francis, DP; Mielewczik, M; Zargaran, D; Cole, GD (26 June 2013). "Autologous bone marrow-derived stem cell therapy in heart disease: Discrepancies and contradictions". International journal of cardiology. 168 (4): 3381–403. doi:10.1016/j.ijcard.2013.04.152. PMID 23830344. مؤرشف من الأصل في 20 مارس 2020. اطلع عليه بتاريخ 21 يوليو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Strauer, BE; Yousef, M; Schannwell, CM (July 2010). "The acute and long-term effects of intracoronary Stem cell Transplantation in 191 patients with chronic heARt failure: the STAR-heart study". European journal of heart failure. 12 (7): 721–9. doi:10.1093/eurjhf/hfq095. PMID 20576835. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yousef, M; Schannwell, CM; Köstering, M; Zeus, T; Brehm, M; Strauer, BE (16 June 2009). "The BALANCE Study: clinical benefit and long-term outcome after intracoronary autologous bone marrow cell transplantation in patients with acute myocardial infarction". Journal of the American College of Cardiology. 53 (24): 2262–9. doi:10.1016/j.jacc.2009.02.051. PMID 19520249. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schannwell CM, Kostering M, Zeus T, Brehm M, Erdmann G, Fleissner T, Yosef M, Kogler G, Wernet P, Strauer BE (2008). "Hmane autologe Stammzelltransplantation zur Myokardregeneration bei dilatativer Kardiomyopathie (NYHA Stadium II bis III)" (PDF). Austrian Journal of Cardiology. 15 (1): 23–30. مؤرشف من الأصل (PDF) في 23 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Orlic D.; et al. (2001). "Bone marrow cells regenerate infarcted myocardium". Nature. 410 (6829): 701–705. doi:10.1038/35070587. PMID 11287958. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة); الوسيط|firstالأول8=يفتقد|lastالأول8=في الأول8 (مساعدة); الوسيط|firstالأول9=يفتقد|lastالأول9=في الأول9 (مساعدة); الوسيط|firstالأول10=يفتقد|lastالأول10=في الأول10 (مساعدة); الوسيط|firstالأول11=يفتقد|lastالأول11=في الأول11 (مساعدة); الوسيط|firstالأول12=يفتقد|lastالأول12=في الأول12 (مساعدة) - Kocher A. A.; et al. "Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function". Nature Medicine. 7: 430–436. doi:10.1038/86498. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kuswardhani R. A.; Soejitno A. (2011). "Bone marrow-derived stem cells as an adjunctive treatment for acute myocardial infarction: a systematic review and meta-analysis". Acta medica Indonesiana. 43 (3): 168–177. PMID 21979282. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Malliaras K.; Kreke M.; Marban E. (2011). "The stuttering progress of cell therapy for heart disease". Clinical pharmacology and therapeutics. 90 (4): 532–541. doi:10.1038/clpt.2011.175. PMID 21900888. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ayala-Lugo A, et al. "Age-dependent availability and functionality of bone marrow stem cells in an experimental model of acute and chronic myocardial infarction". Cell transplantation. 20: 407–419. doi:10.3727/096368909X519283. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zhang Y, et al. "Timing of bone marrow cell therapy is more important than repeated injections after myocardial infarction". Cardiovascular pathology : the official journal of the Society for Cardiovascular Pathology. 20: 204–212. doi:10.1016/j.carpath.2010.06.007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wang X.; et al. "Donor myocardial infarction impairs the therapeutic potential of bone marrow cells by an interleukin-1-mediated inflammatory response". Science Translational Medicine. 3: 100ra90. doi:10.1126/scitranslmed.3002814. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Krishnamurthy P.; et al. (2011). "Interleukin-10 deficiency impairs bone marrow-derived endothelial progenitor cell survival and function in ischemic myocardium". Circulation Research. 109 (11): 1280–1289. doi:10.1161/CIRCRESAHA.111.248369. PMC 3235675. PMID 21959218. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة); الوسيط|firstالأول8=يفتقد|lastالأول8=في الأول8 (مساعدة); الوسيط|firstالأول9=يفتقد|lastالأول9=في الأول9 (مساعدة) - Paul A.; Srivastava S.; Chen G.; Shum-Tim D.; Prakash S. "Functional Assessment of Adipose Stem Cells for Xenotransplantation Using Myocardial Infarction Immunocompetent Models: Comparison with Bone Marrow Stem Cells". Cell biochemistry and biophysics. 67: 263–273. doi:10.1007/s12013-011-9323-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Guinea pig hearts beat with human cells : Nature News & Comment". مؤرشف من الأصل في 20 سبتمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Francis, Darrel P (Oct 2013). "Autologous bone marrow-derived stem cell therapy in heart disease: Discrepancies and contradictions". Int J Cardiol. Elsevier. 168: 3381–403. doi:10.1016/j.ijcard.2013.04.152. PMID 23830344. مؤرشف من الأصل في 15 فبراير 2016. اطلع عليه بتاريخ 06 يوليو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Berndt, Christina. "A minefield of contradictions". Suddeutsche Zeitung. مؤرشف من الأصل في 23 مارس 2019. اطلع عليه بتاريخ 06 يوليو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Haider, HKh; Ashraf, M (June 2005). "Bone marrow stem cell transplantation for cardiac repair". American Journal of Physiology. Heart and Circulatory Physiology. 288 (6): H2557-67. doi:10.1152/ajpheart.01215.2004. PMID 15897328. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ptaszek LM, Mansour M, Ruskin JN, Chien KR (2012). "Towards regenerative therapy for cardiac disease". The Lancet. 379 (9819): 933–942. doi:10.1016/s0140-6736(12)60075-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Giarratana MC, Kobari L, Lapillonne H, et al. (January 2005). "Ex vivo generation of fully mature human red blood cells from hematopoietic stem cells". Nat. Biotechnol. 23 (1): 69–74. doi:10.1038/nbt1047. PMID 15619619. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Archer, Graeme. "Technology". The Daily Telegraph. London. مؤرشف من الأصل في 30 مايو 2008. اطلع عليه بتاريخ 24 مايو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Anglin, Ian. "Scientists Grow Teeth Using Stem Cells". SingularityHUB. مؤرشف من الأصل في 23 مارس 2019. اطلع عليه بتاريخ 31 يوليو 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yen AH, Sharpe PT (يناير 2008). "Stem cells and tooth tissue engineering". Cell Tissue Res. 331 (1): 359–72. doi:10.1007/s00441-007-0467-6. PMID 17938970. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Stem cell-based biological tooth repair and regeneration". مؤرشف من الأصل في 14 يناير 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wu, Ping; Wu, Xiaoshan; Jiang, Ting-Xin; Elsey, Ruth M.; Temple, Bradley L.; Divers, Stephen J.; Glenn, Travis C.; Yuan, Kuo; Chen, Min-Huey; Widelitz, Randall B.; Chuon, Cheng-Ming (2013). "Specialized stem cell niche enables repetitive renewal of alligator teeth" (PDF). Proceedings of the National Academy of Sciences of the United States of America. 110 (22): E2009–E2018. doi:10.1073/pnas.1213202110. PMC 3670376. PMID 23671090. مؤرشف من الأصل (PDF) في 4 نوفمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Gene therapy is first deafness 'cure' – health – 14 February 2005 – New Scientist". مؤرشف من الأصل في 14 سبتمبر 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fetal tissue restores lost sight MedicalNewsToday. Article Date: 28 October 2004 – 10:00 PDT نسخة محفوظة 10 يونيو 2007 على موقع واي باك مشين.
- "BBC NEWS". مؤرشف من الأصل في 22 فبراير 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - The University Hospital of New Jersey, 2002 نسخة محفوظة 13 ديسمبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- "Human limbal biopsy–derived stromal stem cells prevent corneal scarring". Science Translational Medicine. 12 December 2014. مؤرشف من الأصل في 11 يونيو 2018. اطلع عليه بتاريخ 02 أغسطس 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Embryonic stem cells improve sight of legally blind women". CNN.com. 23 January 2012. مؤرشف من الأصل في 14 أبريل 2020. اطلع عليه بتاريخ 12 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Weiss JN, Levy S, Malkin A. Stem Cell Ophthalmology Treatment Study (SCOTS) for retinal and optic nerve diseases: a preliminary report. Neural Regen Res [serial online] 2015 [cited 2015 Sep 21];10:982-8. Available from: http://www.nrronline.org/text.asp?2015/10/6/982/158365 نسخة محفوظة 2018-06-03 على موقع واي باك مشين.
- Saki N, Jalalifar MA, Soleimani M, Hajizamani S, Rahim F (2013). "Adverse Effect of High Glucose Concentration on Stem Cell Therap". Int J Hematol Oncol Stem Cell Res. 7 (3): 34–40. PMC 3913149. PMID 24505533. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goldstein, Ron (2007). Embryonic stem cell research is necessary to find a diabetes cure. Greenhaven Press. صفحة 44. الوسيط
|CitationClass=تم تجاهله (مساعدة);|access-date=بحاجة لـ|url=(مساعدة) - Centeno CJ, Busse D, Kisiday J, Keohan C, Freeman M, Karli D (ديسمبر 2008). "Regeneration of meniscus cartilage in a knee treated with percutaneously implanted autologous mesenchymal stem cells". Med. Hypotheses. 71 (6): 900–8. doi:10.1016/j.mehy.2008.06.042. PMID 18786777. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Centeno CJ, Busse D, Kisiday J, Keohan C, Freeman M, Karli D (2008). "Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells". Pain Physician. 11 (3): 343–53. PMID 18523506. مؤرشف من الأصل في 5 يونيو 2012. اطلع عليه بتاريخ أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Centeno CJ, Schultz JR, Cheever M, Robinson B, Freeman M, Marasco W (مارس 2010). "Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique". Curr Stem Cell Res Ther. 5 (1): 81–93. doi:10.2174/157488810790442796. PMID 19951252. مؤرشف من الأصل في 20 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wakitani S, Nawata M, Tensho K, Okabe T, Machida H, Ohgushi H (2007). "Repair of articular cartilage defects in the patello-femoral joint with autologous bone marrow mesenchymal cell transplantation: three case reports involving nine defects in five knees". J Tissue Eng Regen Med. 1 (1): 74–9. doi:10.1002/term.8. PMID 18038395. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Gurtner GC, Callaghan MJ, Longaker MT (2007). "Progress and potential for regenerative medicine". Annu. Rev. Med. 58 (1): 299–312. doi:10.1146/annurev.med.58.082405.095329. PMID 17076602. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Richards M, Fong CY, Bongso A (ديسمبر 2008). "Comparative evaluation of different in vitro systems that stimulate germ cell differentiation in human embryonic stem cells". Fertil. Steril. 93 (3): 986–94. doi:10.1016/j.fertnstert.2008.10.030. PMID 19064262. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ledford H (7 July 2009). "Sperm-like cells made from human embryonic stem cells". Nature News. doi:10.1038/news.2009.646. مؤرشف من الأصل في 09 مايو 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - White, YAR; Woods DC; Takai Y; Ishihara O; Seki H; Tilly JL. (2012). "Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women". Nature Medicine. 18 (3): 413–421. doi:10.1038/nm.2669. PMC 3296965. PMID 22366948. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Allers, Kristinia; Hütter, Gero; Hofmann, Jörg; Loddenkemper, Chrtoph; Rieger, Kathrin; Thiel, Eckhard; Schneider, Thomas (14 July 2014). "Evidence for the cure of HIV infection by CCR5Δ32/Δ32 stem cell transplantation". Blood. 117 (10): 2791–2799. doi:10.1182/blood-2010-09-309591. PMID 21148083. الوسيط
|CitationClass=تم تجاهله (مساعدة) - DiGiusto, David; Stan, Rodica; Krishnan, Amrita; Li, Haitang; Rossi, John; Zaia, John (22 November 2013). "Development of Hematopoietic Stem Cell Based Gene Therapy for HIV-1 Infection: Considerations for Proof of Concept Studies and Translation to Standard Medical Practice". Viruses. 2013 (5): 2898–2919. doi:10.3390/v5112898. الوسيط
|CitationClass=تم تجاهله (مساعدة) - O'Connell, Claire (27 January 2012). "Stem cells – where are we now?". The Irish Times. مؤرشف من الأصل في 22 مارس 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "BioTime acquires stem cell assets from Geron, raises $10 million". San Francisco Business Times. 7 January 2013. مؤرشف من الأصل في 20 يونيو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Francois M et al., Cytotherapy.2012;14:147–152
- Chen J, Li Y, Wang L, et al. (April 2001). "Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats". Stroke. 32 (4): 1005–11. doi:10.1161/01.STR.32.4.1005. PMID 11283404. مؤرشف من الأصل في 20 مارس 2020. اطلع عليه بتاريخ أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Assmus B, Schächinger V, Teupe C, et al. (December 2002). "Transplantation of Progenitor Cells and Regeneration Enhancement in Acute Myocardial Infarction (TOPCARE-AMI)". Circulation. 106 (24): 3009–17. doi:10.1161/01.CIR.0000043246.74879.CD. PMID 12473544. مؤرشف من الأصل في 27 أبريل 2020. اطلع عليه بتاريخ أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Murphy JM, Fink DJ, Hunziker EB, Barry FP (December 2003). "Stem cell therapy in a caprine model of osteoarthritis". Arthritis Rheum. 48 (12): 3464–74. doi:10.1002/art.11365. PMID 14673997. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sampaolesi M, Blot S, D'Antona G, et al. (November 2006). "Mesoangioblast stem cells ameliorate muscle function in dystrophic dogs". Nature. 444 (7119): 574–9. doi:10.1038/nature05282. PMID 17108972. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Taylor SE, Smith RK, Clegg PD (مارس 2007). "Mesenchymal stem cell therapy in equine musculoskeletal disease: scientific fact or clinical fiction?". Equine Vet. J. 39 (2): 172–80. doi:10.2746/042516407X180868. PMID 17378447. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Tecirlioglu RT, Trounson AO (2007). "Embryonic stem cells in companion animals (horses, dogs and cats): present status and future prospects". Reprod. Fertil. Dev. 19 (6): 740–7. doi:10.1071/RD07039. PMID 17714628. مؤرشف من الأصل في 20 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Koch TG, Betts DH (نوفمبر 2007). "Stem cell therapy for joint problems using the horse as a clinically relevant animal model". Expert Opin Biol Ther. 7 (11): 1621–6. doi:10.1517/14712598.7.11.1621. PMID 17961087. مؤرشف من الأصل في 2 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richardson LE, Dudhia J, Clegg PD, Smith R (September 2007). "Stem cells in veterinary medicine—attempts at regenerating equine tendon after injury". Trends Biotechnol. 25 (9): 409–16. doi:10.1016/j.tibtech.2007.07.009. PMID 17692415. مؤرشف من الأصل في 23 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Csaki C, Matis U, Mobasheri A, Ye H, Shakibaei M (December 2007). "Chondrogenesis, osteogenesis and adipogenesis of canine mesenchymal stem cells: a biochemical, morphological and ultrastructural study". Histochem. Cell Biol. 128 (6): 507–20. doi:10.1007/s00418-007-0337-z. PMID 17922135. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kane, Ed (May 2008). Stem-cell therapy shows promise for soft-tissue injury, disease. DVM Newsmagazine. 6E-10E.
- Yamada Y, Ueda M, Naiki T, Takahashi M, Hata K, Nagasaka T (2004). "Autogenous injectable bone for regeneration with mesenchymal stem cells and platelet-rich plasma: tissue-engineered bone regeneration". Tissue Eng. 10 (5–6): 955–64. doi:10.1089/1076327041348284. PMID 15265313. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Singec I, Jandial R, Crain A, Nikkhah G, Snyder EY (2007). "The leading edge of stem cell therapeutics". Annu. Rev. Med. 58 (1): 313–28. doi:10.1146/annurev.med.58.070605.115252. PMID 17100553. مؤرشف من الأصل في 20 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Zachos TA, Smith TJ (September 2008). Use of adult stem cells in clinical orthopedics. DVM Newsmagazine. 36–39.
- Walter Brehm (2012). "Stem cell-based tissue engineering in veterinary orthopaedics". Cell Tissue Research. 347 (3): 677–688. doi:10.1007/s00441-011-1316-1. PMID 22287044. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة) - Young RG, Butler DL, Weber W, Caplan AI, Gordon SL, Fink DJ (July 1998). "Use of mesenchymal stem cells in a collagen matrix for Achilles tendon repair". J. Orthop. Res. 16 (4): 406–13. doi:10.1002/jor.1100160403. PMID 9747780. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Awad HA, Butler DL, Boivin GP, et al. (June 1999). "Autologous mesenchymal stem cell-mediated repair of tendon". Tissue Eng. 5 (3): 267–77. doi:10.1089/ten.1999.5.267. PMID 10434073. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bruder SP, Kraus KH, Goldberg VM, Kadiyala S (July 1998). "The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects". J Bone Joint Surg Am. 80 (7): 985–96. PMID 9698003. مؤرشف من الأصل في 20 مارس 2020. اطلع عليه بتاريخ أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Kraus KH, Kirker-Head C (أبريل 2006). "Mesenchymal stem cells and bone regeneration". Vet Surg. 35 (3): 232–42. doi:10.1111/j.1532-950X.2006.00142.x. PMID 16635002. مؤرشف من الأصل في 20 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Daniela Gattegno-Ho (2012). "Stem cells and veterinary medicine: Tools to understand diseases and enable tissue regeneration and drug discovery". The Veterinary Journal. 191 (1): 19–27. doi:10.1016/j.tvj.2011.08.007. PMID 21958722. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة) - Nathan S, Das De S, Thambyah A, Fen C, Goh J, Lee EH (أغسطس 2003). "Cell-based therapy in the repair of osteochondral defects: a novel use for adipose tissue". Tissue Eng. 9 (4): 733–44. doi:10.1089/107632703768247412. PMID 13678450. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fraser JK, Wulur I, Alfonso Z, Hedrick MH (أبريل 2006). "Fat tissue: an underappreciated source of stem cells for biotechnology". Trends Biotechnol. 24 (4): 150–4. doi:10.1016/j.tibtech.2006.01.010. PMID 16488036. مؤرشف من الأصل في 23 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Nakagami H, Morishita R, Maeda K, Kikuchi Y, Ogihara T, Kaneda Y (أبريل 2006). "Adipose tissue-derived stromal cells as a novel option for regenerative cell therapy". J. Atheroscler. Thromb. 13 (2): 77–81. doi:10.5551/jat.13.77. PMID 16733294. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) [وصلة مكسورة] - Bong Wook Park (2012). "Peripheral nerve regeneration using autologous porcine skin-derived mesenchymal stem cells". Journal of Tissue Engineering and Regenerative Medicine. 6 (2): 113–124. doi:10.1002/term.404. PMID 21337707. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة) - Gabriella Marfe (2012). "Blood derived stem cells: An ameliorative therapy in veterinary ophthalmology". Journal of Cellular Physiology. 227 (3): 1250–1256. doi:10.1002/jcp.22953. PMID 21792938. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة); الوسيط|firstالأول8=يفتقد|lastالأول8=في الأول8 (مساعدة) - Omid Azari (2011). "Effects of transplanted mesenchymal stem cells isolated from Wharton's jelly of caprine umbilical cord on cutaneous wound healing; histopathological evaluation". Veterinary Research Communications. 35 (4): 211–222. doi:10.1007/s11259-011-9464-z. PMID 21340694. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة) - Carstanjen B, Desbois C, Hekmati M, Behr L (2006). "Successful engraftment of cultured autologous mesenchymal stem cells in a surgically repaired soft palate defect in an adult horse". The Canadian Journal of Veterinary Research. 70 (2): 143–147. PMC 1410720. PMID 16639947. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Black LL, Gaynor J, Adams C, et al. (2008). "Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs". Vet. Ther. 9 (3): 192–200. PMID 19003780. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nixon AJ, Dahlgren LA, Haupt JL, Yeager AE, Ward DL (يوليو 2008). "Effect of adipose-derived nucleated cell fractions on tendon repair in horses with collagenase-induced tendinitis". Am. J. Vet. Res. 69 (7): 928–37. doi:10.2460/ajvr.69.7.928. PMID 18593247. مؤرشف من الأصل في 14 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Annalisa Guercio (2012). "Production of canine mesenchymal stem cells from adipose tissue and their application in dogs with chronic osteoarthritis of the humeroradial joints". Cell Biology International. 36 (2): 189–194. doi:10.1042/CBI20110304. PMID 21936851. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة); الوسيط|firstالأول8=يفتقد|lastالأول8=في الأول8 (مساعدة) - I Ribitsch (2010). "Basic Science and Clinical Application of Stem Cells in Veterinary Medicine". Advanced Biochemical Engineering and Biotechnology. 123: 219–263. doi:10.1007/10_2010_66. ISBN 978-3-642-16050-9. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة) - Ung Kim (2011). "Homing of adipose-derived stem cells to radiofrequency catheter ablated canine atrium and differentiation into cardiomyocyte-like cells". International Journal of Cardiology. 146 (3): 371–378. doi:10.1016/j.ijcard.2009.07.016. PMID 19683815. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة) - Yen Chang (2007). "Tissue regeneration observed in a basic fibroblast growth factor–loaded porous acellular bovine pericardium populated with mesenchymal stem cells". Surgery for Acquired Cardiovascular Disease. 134: 65–73. doi:10.1016/j.jtcvs.2007.02.019. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة); الوسيط|firstالأول8=يفتقد|lastالأول8=في الأول8 (مساعدة) - Sung Su Park; et al. (2012). "Functional recovery after spinal cord injury in dogs treated with a combination of Matrigel and neural-induced adipose-derived mesenchymal Stem cells". Cytotherapy. 14 (5): 584–597. doi:10.319/14653249.2012.658913 تأكد من صحة قيمة
|doi=(مساعدة). PMID 22348702. الوسيط|CitationClass=تم تجاهله (مساعدة) - Hak-Hyun Ryu (2009). "Functional recovery and neural differentiation after transplantation of allogenic adipose-derived stem cells in a canine model of acute spinal cord injury". Journal of Veterinary Science. 10 (4): 273–284. doi:10.4142/jvs.2009.10.4.273. PMC 2807262. PMID 19934591. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|firstالأول2=يفتقد|lastالأول2=في الأول2 (مساعدة); الوسيط|firstالأول3=يفتقد|lastالأول3=في الأول3 (مساعدة); الوسيط|firstالأول4=يفتقد|lastالأول4=في الأول4 (مساعدة); الوسيط|firstالأول5=يفتقد|lastالأول5=في الأول5 (مساعدة); الوسيط|firstالأول6=يفتقد|lastالأول6=في الأول6 (مساعدة); الوسيط|firstالأول7=يفتقد|lastالأول7=في الأول7 (مساعدة); الوسيط|firstالأول8=يفتقد|lastالأول8=في الأول8 (مساعدة); الوسيط|firstالأول9=يفتقد|lastالأول9=في الأول9 (مساعدة) - Hidetaka Nishida; et al. (2012). Veterinary Surgery. 00: 1–6. doi:10.111/j.1532-950X.2011.00959.x تأكد من صحة قيمة
|doi=(مساعدة). الوسيط|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة) - Xu, J., Wang, D., Liu, D., Fan, Z., Zhang, H., Liu, O., et al. (2012). Allogeneic mesenchymal stem cell treatment alleviates experimental and clinical Sjogren syndrome. Blood, 120(15), 3142–3151.
- Beyazyıldız, E., Pınarlı, F. A., Beyazyıldız, Ö., Hekimoğlu, E. R., Acar, U., Demir, M. N., et al. (2014). Efficacy of Topical Mesenchymal Stem Cell Therapy in the Treatment of Experimental Dry Eye Syndrome Model. Stem Cells International, 2014(3), 250230–9
- Villatoro, A. J., Fernández, V., Claros, S., Rico-Llanos, G. A., Becerra, J., & Andrades, J. A. (2015). Use of adipose-derived mesenchymal stem cells in keratoconjunctivitis sicca in a canine model. BioMed Research International, 2015(3), 527926–10. http://doi.org/10.1155/2015/527926 نسخة محفوظة 2020-07-04 على موقع واي باك مشين.
- I. Dobrinski and A.J. Travis (2007). "Germ cell transplantation for the propagation of companion animals, non-domestic and endangered species". Reproduction, Fertility, and Development. 19: 732–739. doi:10.1071/RD07036. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Health, Wellness, Nutrition and Anti-Aging Integrative Medicine Experts & Information – Superior Raw Super Food Supplements – Online Wellness Community". مؤرشف من الأصل في 23 فبراير 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) -
Mlsna, Lucas J. (2010). "Stem Cell Based Treatments and Novel Considerations for Conscience Clause Legislation". Indiana Health Law Review. United States: Indiana University Robert H. McKinney School of Law. 8 (2): 471–496. مؤرشف من الأصل في 11 سبتمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) رقم دولي معياري للدوريات:1549–3199. رقم الضبط في مكتبة الكونغرس:2004212209. مركز المكتبة الرقمية على الإنترنت:ممرإ 54703225. - Dobkin BH, Curt A, Guest J; Curt; Guest (مارس 2006). "Cellular transplants in China: observational study from the largest human experiment in chronic spinal cord injury". Neurorehabil Neural Repair. 20 (1): 5–13. doi:10.1177/1545968305284675. PMC 4169140. PMID 16467274. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Clyto Scientific Conferences | Webinars | Clyto Conferences نسخة محفوظة 18 فبراير 2018 على موقع واي باك مشين.
- "Stem cells tailored to patients". BBC News. 20 May 2005. مؤرشف من الأصل في 10 أبريل 2019. اطلع عليه بتاريخ 24 مايو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chotinantakul K, Leeanansaksiri W (June 2012). "Hematopoietic stem cell development, niches, and signaling pathways". Bone Marrow Research. 10 (6): 12–16. doi:10.1155/2012/270425. PMC 3413998. PMID 22900188. الوسيط
|CitationClass=تم تجاهله (مساعدة)
وصلات خارجية
- Fiona Murray PhD, Debora Spar PhD "Bit Player Or Powerhouse? China And Stem-Cell Research", "New England Journal of Medicine" 21 September 2006. (Accessed 30 July 2007)
- Clive Cookson "Generous Staffing And Permissive Laws Aid Asia's Largest Stem Cell Effort", "Scientific American" 27 June 2005. (Accessed 30 July 2007)
- Stem cell research & therapy: types of stem cells and their current uses
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
