خماسي كربونيل الحديد
خماسي كربونيل الحديد هو معقد كربونيل له الصيغة Fe(CO)5، وهو أبسط أحد ثلاثة أشكال لكربونيلات الحديد. يكون في الشروط العادية على شكل سائل أصفر له رائحة واخزة.
| خماسي كربونيل الحديد | |
|---|---|
5.png.webp) خماسي كربونيل الحديد |
 خماسي كربونيل الحديد |
| الاسم النظامي (IUPAC) | |
خماسي كربونيل الحديد | |
| المعرفات | |
| رقم CAS | 13463-40-6 |
| بوب كيم (PubChem) | 26040 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | Fe(CO)5 |
| الكتلة المولية | 195.90 غ/مول |
| المظهر | سائل أصفر اللون |
| الكثافة | 1.45 غ/سم3 |
| نقطة الانصهار | - 20 °س |
| نقطة الغليان | 103 °س |
| الذوبانية في الماء | غير منحل |
| المخاطر | |
| ترميز المخاطر |  T+ T+
 F F |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخصائص
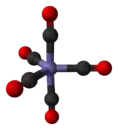
- يعد خماسي كربونيل الحديد من الكربونيلات الفلزية، وهي معقدات تساندية تكون ربيطاتها من الكربونيل، حيث تحيط خمس مجموعات منها ذرة الحديد المركزية بشكل متناظر. للمعقد Fe(CO)5 بنية على شكل هرم ثلاثي مضاعف trigonal bipyramidal يكون فيها ثلاث من الروابط Fe-CO على شكل استوائي، في حين أن الرابطتين الأخرتين تكونان على شكل محوري.
- يحقق معقد خماسي كربونيل الحديد قاعدة 18-إلكترون، حيث يكون للحديد ثمان إلكترونات تكافؤية أما مجموعات الكربونيل الخمسة فتشارك كل واحدة منها بزوج إلكتروني.
- إن التفكك الضوئي لمركب خماسي كربونيل الحديد يعطي تساعي كربونيل ثنائي الحديد Fe2(CO)9، وهو مركب صلب ذو لون أصفر برتقالي، في حين أن تسخين خماسي كربونيل الحديد يعطي اثنا عشري كربونيل ثلاثي الحديد Fe3(CO)12
التحضير
وجد توصيف لتحضير خماسي كربونيل الحديد لأول مرة في منشور علمي عام 1891 من قبل موند Mond و لانغر Langer والذين وصفا ناتج معالجة مسحوق ناعم من الحديد خالي من الأكسيد مع غاز أحادي أكسيد الكربون عند درجة حرارة الغرفة بأنه "سائل أصفر شاحب اللون ولزج".[3] أما صناعياً يحضر خماسي كربونيل الحديد من تفاعل المواد المكونة بين درجتي حرارة 150 و 200 °س تحت ضغط يبلغ 100 بار.
Fe + 5 CO → Fe(CO)5
التفاعلات
تفاعلات استبدال CO

يمكن اشتقاق العديد من المركبات نتيجة تفاعل استبدال الربيطات CO من مركب خماسي كربونيل الحديد. فعلى العموم إن استبدال قاعدة لويس مثلاً L يعطي المشتقات Fe(CO)5-xLx. تتضمن قواعد لويس مركبات الإيزوسيانيد والفسفينات الثالثية والأرسينات والألكينات، والتي عادة ما يحدث فيها عملية استبدال لربيطة CO أو اثنتين، إلا أن بعض الربيطات المستقبلة مثل ثلاثي فلوريد الفسفور PF3 تستطيع أن تقوم بعليات استبدال أربع أو خمس مجموعات كربونيل. تحرّض هذه التفاعلات غالباً إما باستخدام حفاز مادي أو ضوئي.[4] فعلى سبيل المثال لتحضير مركب مضاعف(ثلاثي فينيل فسفين) الحديد Fe(CO)3(P(C6H5)3)2 تبدأ العملية باستخدام تحفيز ضوئي، ثم بإضافة NaOH وNaBH4 لتنشيط العملية.[5]
الأكسدة والاختزال
إن معالجة خماسي كربونيل الحديد بالهالوجينات يعطي هاليد كربونيل الحديد الثنائي Fe(CO)4X2، والتي تحرر غاز CO لدى التسخين لتعطي هاليد الحديد الثنائي مثل كلوريد الحديد الثنائي.
إن اختزال خماسي كربونيل الحديد بالصوديوم يعطي رباعي كربونيل حديدات ثنائي الصوديوم Disodium tetracarbonylferrate الذي له الصيغة Na2Fe(CO)4 ويعرف باسم كاشف كولمان Collman's reagent. يتميز هذا المركب أنه مناظر إلكترونياً رباعي كربونيل النيكل Ni(CO)4 لكنه أكثر شغفاً بالنواة منه.[6]
ضم الأوليفينات
إن خماسي كربونيل الحديد قادر على ضم لأوليفينات الحاوية على رابطتين مضاعفتين (ديينات)، حيث تحلان مكانا ربيطتي CO. تقوم العديد من الدينات بهذا التفاعل، مثل نوربورناديين و3،1-بوتاديين. من الأمثلة الشهيرة على نواتج تفاعل الضم هذا هو مركب ثلاثي كربونيل حلقي بوتاديين الحديد C4H4)Fe(CO)3) الناتج عن ضم حلقي البوتاديين غير المستقر.[7] من نواتج الضم المهمة أيضاً حلقي الهكساديين، حيث يحصل على الديين 4،1 من اختزال بيرتش، والتي تتماكب إلى الديين 3،1 عند التعقيد.[8]
الاستخدامات
- يستعمل خماسي كربونيل الحديد في إنتاج حديد الكربونيل Carbonyl iron وهو نوع من الحديد يستخدم في تحضير النواة المغناطيسية Magnetic core للوشائع عالية التوتر المستخدمة في أجهزة الراديو والتلفزيون.
- وجد أن خماسي كربونيل الحديد من المواد قوية الحجب لسرعة اللهب flame speed inhibitor وذلك للألهبة الحاوية على الأكسجين.[9]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/26040 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Iron(0) carbonyl — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/26040
- Mond, L.; Langer, C. (1891). "On iron carbonyls". J. Chem. Soc., Trans. 59: 1090–1093. doi:10.1039/CT8915901090. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Therien, M. J; Trogler, W. C.; Silva, R.; Darensbourg, M. Y. (1990). "Bis(phosphine) derivatives of iron pentacarbonyl and tetracarbonyl(tri-tert-butylphosphine)iron(0)". Inorg. Synth. 28: 173–9. doi:10.1002/9780470132593.ch45. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Keiter, R. L.; Keiter, E. A.; Boecker, C. A.; Miller, D. R. and Hecker, K. H. (1997). "Tricarbonylbis(phosphine)iron(0) complexes". Inorg. Synth. 31: 210–214. doi:10.1002/9780470132623.ch31. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Finke, R. G.; Sorrell, T. N.."Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-Oxoheptanoate and Methyl 7-oxooctonoate". Org. Synth.; Coll. Vol. 6: 807.
- Pettit, R.; Henery, J.."Cyclobutadieneiron Tricarbonyl". Org. Synth.; Coll. Vol. 6: 310.
- Birch, A. J.; Chamberlain, K. B.."Tricarbonyl[(2,3,4,5-eta)-2,4-Cyclohexadien-1-one]ison and Tricarbonyl[(1,2,3,4,5-eta)-2-Methoxy-2,4-Cyclohexadien-1-yl]Iron(1+) Hexafluorophosphate(1-) from Anisole". Org. Synth.; Coll. Vol. 6: 996.
-
Lask, G.; Wagner, H. Gg. (1962). "Influence of additives on the velocity of laminar flames". Eighth International Symposium on Combustion: 432–438. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء