الوقاية من الملاريا
الوقاية من الملاريا (prophylaxis في اليونانية pro = مع، phylaxis = دفاع) هو العلاج الوقائي للملاريا. وهناك عدة لقاحات للملاريا قيد التطوير.
الإستراتيجات
- إدارة المخاطر
- منع اللدغ - الملابس التي تغطي الجلد قدر الإمكان، طارد الحشرات، الناموسيات المعالجة بمبيدات الحشرات و الرش المثالي داخل المباني
- الوقاية الكيميائية
- التشخيص السريع والعلاج
التحسينات الحديثة في إستراتيجيات الوقاية من الملاريا أدت إلى زياده تعزيز فعاليتها في مكافحة المناطق شديدة الإصابة بطفيل الملاريا. التدابير الإضافية للمنع الوقائي للدغات تشمل طارد للبعوض والحشرات يمكن وضعه مباشرة على الجلد. هذا النوع من طارد البعوض بدأ تدريجياً بإستبدال الرش المنزلي، والتي تحمل مستويات عالية من السمية وفقاً لمنظمة الصحة العالمية. إضافة إلى الرعاية الوقائية هناك عقوبات على عمليات نقل الدم. بمجرد دخول طفيلي الملاريا مرحلة الكريات الحمراء، فإنه يمكن أن يؤثر سلباً على خلايا الدم، مما يجعل من المستحيل التحكم بالطفيلي من خلال الدم المصاب.
الكلوروكين (بالإنجليزية:Chloroquine ): يمكن إستخدامه في حالة أن الطفيلي لا يزال حساساً. ومع ذلك نظراً لمقاومة الدواء فإن واحد من الثلاث أدوية: المفلوكين ( بالإنجليزية:mefloquine(Lariam)، دوكسيسيكلين (بالإنجليزية: doxycycline) (المتاح بشكل عام)، وبروغوانيل هيدروكلوريد (بالإنجليزية: proguanil hydrochloride ) ((Malarone غالباً ما يستخدم. دوكسيسيكلين ومزيج الاتوفيكين (بالإنجليزية:atovaquone) وبروغوانيل هم الأكثر تحملاً مع مفلوكين (بالإنجليزية:mefloquine) مرتبطة مع معدلات مرتفعة من الأعراض العصبية والنفسية.
أدوية
عند اختيار العامل، من المهم أن يوزن بين مخاطر العدوى و مخاطر الأدوية و أعراضها الجانبية.
وقاية تدميرية
المنهاج التجريبي يتضمن منع الطفيليات من الارتباط بخلايا الدم الحمراء وذلك عن طريق سد تأشير الكالسيوم بين الطفيلي و خلية العائل. كلاً من البروتينات الشبه مرتبطة بالخلايا الحمراء ومماثلات البروتينات المرتبطة بالخلايا الشبكية تستخدم في عضيات متخصصة في متصورة منجلية وهي "روبتري" و "مايكرونيمز" للارتباط بخلية العائل. تدمير عملية الارتباط يمكنه من إيقاف المخلوق الطفيلي. [1][2]
كان يتم استخدام الأجسام المضادة وحيدة النسيلة لقطع تأشير الكالسيوم بين PfRH1 (بروتين خلايا شبيكة) و EBL، و بروتين EBA175 و خلية العائل. هذا القطع أوقف عملية الارتباط كلياً.
وقاية قمعية
الكلوروكين، البروغوانيل، مفلوكين، الدوكسيسيكلين هي أدوية الوقاية القمعية. وهذا يعني أنها لا تكون فعالة إلا في قتل طفيلي الملاريا مرة واحدة وقد دخلت مرحلة الدم من دورة حياتها، وبالتالي ليس لها أي تأثير حتى الانتهاء من مرحلة الكبد. هذا هو السبب في أن هذه الوسائل الوقائية يجب أن تستمر إلى أن تأخذ مدة أربعة أسابيع بعد مغادرة منطقة الخطر.
وقاية سببية
يستهدف الوقاية السببية ليس فقط مراحل الدم من الملاريا، ولكن مرحلة الكبد الأولية كذلك. وهذا يعني أنه يمكن للمستخدم التوقف عن تناول الدواء بعد سبعة أيام من مغادرة منطقة الخطر. مالارون وبريماكين هي الوقاية السببية الوحيدة في الاستخدام الحالي.
أنظمة الوقاية
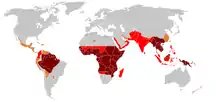
يوصى بأنظمة محددة من قبل منظمة الصحة العالمية، المملكة المتحدة HPA وCDC للوقاية من العدوى P. فالسيباروم. تتفق مشورة هبا ومنظمة الصحة العالمية بشكل عام مع بعضها البعض (على الرغم من وجود بعض الاختلافات). وكثيرا ما يتعارض توجيه مركز السيطرة على الأمراض مع توجيهات هبا ومنظمة الصحة العالمية.
هذه الأنظمة تنص على ما يلي:
- الدوكسيسيكلين 100 ملغ مرة واحدة يومياً (تبدأ يوم واحد قبل السفر، وتستمر لمدة أربعة أسابيع بعد العودة);
- ميفلوكين 250 ملغ مرة واحدة أسبوعياً (بدأت عامين ونصف أسابيع قبل السفر، وتستمر لمدة أربعة أسابيع بعد العودة);
- اتوفاكون/البروغوانيل (مالارون) قرص واحد يومياً (تبدأ يوم واحد قبل السفر، وتستمرلمدة أسبوع بعد العودة). ويمكن أيضاً أن تستخدم للعلاج في بعض الحالات.
في المجالات التي لا يزال الكلوروكين فعال فيها:
- الكلوروكين 300 ملغ مرة واحدة أسبوعياً، البروغوانيل 200 ملغ مرة واحدة يومياً (تبدأ قبل أسبوع من السفر، و تستمر لمدة أربعة أسابيع بعد العودة);
- هيدروكسي 400 ملغ مرة واحدة أسبوعياً (تبدأ أسبوع إلى أسبوعين قبل السفر وتستمر لمدة أربعة أسابيع بعد العودة)
النظام المناسب يعتمد على الشخص الذي يأخذ الدواء بالإضافة إلى البلد أو المنطقة التي سافر لها. هذه المعلومات متوفرة من وكالة حماية الصحة في المملكة المتحدة، أو منظمة الصحة العالمية، أو مراكز مكافحة الأمراض واتقائها. الجرعة أيضاً تعتمد على ماهو متوفر ( مثال: في الولايات المتحدة الأمريكية، تحتوي أقراص الميفلوكين على قاعدة 228 ملغ، ولكن قاعدة 250 ملغ في المملكة المتحدة). هذه البيانات متغيرة بإستمرار لذا لا توجد نصيحة عامة ممكنة.
الجرعات المعطاة مناسبة للبالغين والأطفال الذين تتراوح أعمارهم بين 12 وما فوق.
الأنظمة الكيميائية الآخرى التي تم استخدامها في بعض الأحيان:
- الدابسون 100 ملغ و بيريميثامين 12.5 ملغ مرة واحدة أسبوعياً (متاح في قرص مركب يسمى مالوبريم أو دلتابريم): هذا المزيج لا ينصح به بصورة روتينية بسبب خطر ندرة المحببات;
- بريماكين 30 ملغ مرة واحدة يومياً (تبدأ يوم واحد قبل السفر، وتستمر لمدة سبعة أيام بعد العودة): هذا النظام لا ينصح بصورة روتينية بسبب الحاجة إلى اختبار G-6-PD قبل بدء بريماكين (انظر المادة على primaquine لمزيد من المعلومات).
- كبريتات الكينين 300 إلى 325 ملغ مرة واحدة يومياً: هذا نظام فعال ولكن لا يستخدم بشكل روتيني بسبب الآثار الجانبية من الكينين.
الوقاية ضد بلاسموديوم فيفاكس (بالإنجليزية: Plasmodium vivax) يتطلب تدخلاً مختلفاً نظراً للمرحلة الكبدية الطويلة لهذا الطفيلي.[4] هذه مرحلة متخصصة عالية.
التطعيم
في نوفمبر / تشرين الثاني 2012، أفادت النتائج المستخلصة من تجارب المرحلة الثالثة للقاح التجريبي للملاريا المعروف باسم رتس S, أنها توفر حماية متواضعة ضد الملاريا السريرية والحادة عند الرضع الصغار. وكانت فعالية حوالي 30٪ في الرضع من 6 إلى 12 أسبوعاً من العمر وحوالي 50٪ في الرضع 5-17 شهرا من العمر في السنة الأولى من المحاكمة.[5]
وقد تم تصميم لقاح رتس S، باستخدام مولد الضد السطحي لالتهاب الكبد ب التي تحتوي على حواتم من البروتين الخارجي من بلاسموديوم فالسيباروم الملاريا دورة حياة معقدات القمة(sporozite) ، الذي يتم إنتاجه في خلايا الخميرة. كما أنه يحتوي على مادة كيميائية مساعدة(chemical adjuvant) لتعزيز استجابة الجهاز المناعي. ويتم تطوير اللقاح من قبل باث(PATH) و غلاكسو سميث كلين (GSK)، التي أنفقت حوالي 300 مليون دولار على المشروع، بالإضافة إلى حوالي 200 مليون دولار أكثر من مؤسسة بيل وميليندا غيتس.
عوامل الخطر
معظم البالغين من المناطق المستوطنة لديهم درجة من العدوى على المدى الطويل، والتي تميل إلى التكرار، وأيضا تمتلك الحصانة الجزئية (المقاومة). تخفف المقاومة بمرور الوقت، وقد يصبح هؤلاء البالغون عرضة للملاريا الحادة إذا أمضوا قدراً كبيراً من الوقت في المناطق غير المستوطنة. ويوصى بشدة باتخاذ الاحتياطات الكاملة إذا عادوا إلى منطقة مستوطنة.
التاريخ
الملاريا ( بـ الانجليزية : Malaria ) هي واحدة من أقدم مسببات الأمراض المعروفة، وبدأت لها تأثير كبير على بقاء الإنسان منذ حوالي 10,000 سنة مع ولادة الزراعة. وقد ثبت تطور حدة الطفيلي باستخدام رسم الخرائط الجيني للعينات من هذه الفترة، مما يؤكد ظهور الجينات مما يقلل من خطر الإصابة بالعدوى بالملاريا. يمكن العثور على إشارات إلى هذا المرض في المخطوطات من مصر القديمة والهند والصين، مما يدل على توزيعها الجغرافي الواسع. ويعتقد أن المعالجة الأولى التي تم تحديدها هي كينين، واحدة من أربعة قلويدات من لحاء شجرة كينا. في الأصل كان يستخدم من قبل قبائل الإكوادور وبيرو لعلاج الحمى. وقد تم الاعتراف بدورها في علاج الملاريا وسجل لأول مرة من قبل راهب أوغسطين من ليما، بيرو في 1633. بعد سبع سنوات وصل الدواء إلى أوروبا، وكان يستخدم على نطاق واسع باسم "النباح اليسوعي" ( بـ الانجليزية : the Jesuit's bark ). من هذه النقطة فصاعداً، زاد استخدام الكينين ب ( الانجليزية : Quinine ) المصلحة العامة بالملاريا، على الرغم من أن المجمع لم يكن معزولاً وعرف كعنصر نشط حتى عام 1820. وبحلول منتصف 1880 الهولندية نمت مزارع واسعة من أشجار سينكونا ( cinchona ) وتم احتكار السوق العالمية.
ظلت الكينين Quinine العلاج الوحيد المتاح للملاريا حتى أوائل 1920s. خلال الحرب العالمية الأولى وضع العلماء الألمان أول مركب مضاد للملاريا الاصطناعية -أتابرين ( ب الانجليزية : Atabrin )، وأعقب ذلك ريسوشين ( Resochin ) وسونتوشين (Sontochin) المستمدة من مركبات 4-أمينوكوينولين. 4-aminoquinoline ، القوات الأمريكية، على القبض على تونس خلال الحرب العالمية الثانية، اكتسبت، ثم غيرت المخدرات لإنتاج كلوروكين.
وقد حفز تطوير أدوية جديدة لمكافحة الملاريا منظمة الصحة العالمية في عام 1955 على محاولة برنامج عالمي للقضاء على الملاريا. وكان هذا ناجحاً في الكثير من الدول منها، البرازيل والولايات المتحدة ومصر ولكن في نهاية المطاف فشلت في مكان آخر. ولا تزال الجهود المبذولة لمكافحة الملاريا مستمرة، مع تطور الطفيليات المقاومة للأدوية التي تواجه مشاكل متزايدة الصعوبة.
وتنشر مراكز مكافحة الأمراض واتقائها توصيات تتعلق بالسفر لتقديم المشورة بشأن خطر الإصابة بالملاريا في بلدان مختلفة.[6]
بعض العوامل في تقرير ما إذا كان ينبغي استخدام العلاج الكيميائي كالوقاية من الملاريا قبل التعرض تتضمن خط مسار الرحلة، وطول الرحلة، وتكلفة العلاج، وردود الفعل السلبية السابقة لمكافحة الملاريا، والحساسية للدواء، والتاريخ الطبي الحالي.[6]
انظر أيضاً
- Malaria prevention
- Mosquito control
مراجع
- نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين.
- Gao, X.; Gunalan, K.; Yap, S. S. L.; Preiser, P. R. (2013). "Triggers of key calcium signals during erythrocyte invasion by Plasmodium falciparum". Nature Communications. 4. doi:10.1038/ncomms3862. PMC 3868333. PMID 24280897. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Malaria". مراكز مكافحة الأمراض واتقائها. April 15, 2010. مؤرشف من الأصل في 3 ديسمبر 2013. اطلع عليه بتاريخ 02 مايو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schwartz E, Parise M, Kozarsky P, Cetron M (October 2003). "Delayed onset of malaria--implications for chemoprophylaxis in travelers". N. Engl. J. Med. 349 (16): 1510–6. doi:10.1056/NEJMoa021592. PMID 14561793. مؤرشف من الأصل في 13 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - RTS,S Clinical Trials Partnership; Agnandji, S. T.; Lell, B.; Fernandes, J. F.; Abossolo, B. P.; Methogo, B. G.; Kabwende, A. L.; Adegnika, A. A.; Mordmüller, B.; Issifou, S.; Kremsner; Sacarlal, J.; Aide, P.; Lanaspa, M.; Aponte, J. J.; Machevo, S.; Acacio, S.; Bulo, H.; Sigauque, B.; MacEte, E.; Alonso; Abdulla, S.; Salim, N.; Minja, R.; Mpina, M.; Ahmed, S.; Ali, A. M.; Mtoro, A. T.; Hamad, A. S.; Mutani, P. (December 2012). "A Phase 3 Trial of RTS,S/AS01 Malaria Vaccine in African Infants". New England Journal of Medicine. 367 (24): 2284–2295. doi:10.1056/NEJMoa1208394. PMID 23136909. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kathrine R. Tan; Sonja Mali; Paul M. Arguin (2010). "Malaria Risk Information and Prophylaxis, by Country". Travelers' Health - Yellow Book. مراكز مكافحة الأمراض واتقائها. مؤرشف من الأصل في 24 يوليو 2010. اطلع عليه بتاريخ 20 ديسمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب