الغدة النخامية الخلفية
تتكون الغدة النخامية الخلفية [1]( بالإنجليزية : posterior pituitary gland ) ، و التي تسمى أيضا النخامى العصبية neurohypophysis ، بصورة رئيسية من خلايا تسمى الخلايا النخامية pituicytes . و لكن الخلايا النخامية هذه لا تفرز أية هرمونات لأنها تعمل ببساطة كبنيات إسنادية للأعداد الكبيرة من نهايات الألياف العصبية ونهايات الأعصاب الانتهائية من السبل العصبية التي تتأصل في النوى فوق البصرية supraoptic nucleus و جنيب البطين paraventricular nucleus of the hypothalamus (PVN) .[2] و تمر هذه السبل إلى النخامى العصبية خلال سويقة النخامى.[3] و تكون النهايات [4] العصبية بشكل عقد بصلية تحوي العديد من الحبيبات الإفرازية التي تقع على سطوح الشعيرات الدموية و تفرز عليها هرموني الغدة النخامية الخلفية وهما :
- الهرمون المضاد لإدرار البول ( فازوبرسين ) ؛ و الذي يسمى أيضا الفازوبرسين فازوبرسين .
- الأوكسيتوسين ( الأوسيتوسين ) أوكسايتوسين .
| الغدة النخامية الخلفية | |
|---|---|
| الاسم اللاتيني Pars nervosa glandulae pituitariae, pars nervosa hypophyseos, lobus posterior hypophyseos | |
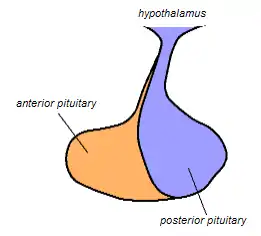 الغدة النخامية الخلفية باللون الأزرق. | |
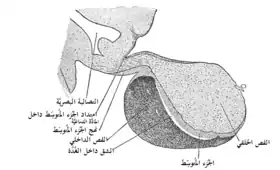 الغدة النخامية من قرد بالغ . (الغدة النخاميةالخلفية في أسفل اليمين). الغدة النخامية من قرد بالغ . (الغدة النخاميةالخلفية في أسفل اليمين). | |
| تفاصيل | |
| جزء من | غدة نخامية ، وتحت المهاد |
| معرفات | |
| غرايز | ص |
| ترمينولوجيا أناتوميكا | 11.1.00.006 |
| FMA | 74636 |
| UBERON ID | 0002198 |
| ن.ف.م.ط. | A06.407.747.734 |
| ن.ف.م.ط. | D010904 |
كما أنه توجد رابطة قوية بين الغدة النخامية و علاقتها بالوطاء . و إذا ما قطعت سويقة النخامى فوق الغدة النخامية و لكن مع ترك كل تحت المهاد ( الوطاء ) سليما، سيستمر إفراز هرمونات الغدة النخامية الخلفية بصورة سوية تقريبا بعد فترة قصيرة تدوم لبضعة أيام فقط، ولكنها تفرز عندئذ من النهايات المقطوعة للألياف داخل الوطاء و ليس من النهايات العصبية في الغدة النخامية الخلفية . و السبب في ذلك يعود إلى أن الهرمونات تصنع مبدئيا في أجساد خلايا النوى فوق البصرية وجنيب البطين، وتنقل بعد ذلك باتحادها مع بروتينات ( حاملة ) تسمى نوروفيزينات neurophysins تنزل إلى النهايات العصبية في الغدة النخامية الخلفية، وتحتاج لعدة أيام لكي تصل إلى الغدة . و يتكون الهرمون المضاد لإدرار البول مبدئيا في النوى فوق البصرية ؛ بينما يتكون الأوسيتوسين ( الأوكسيتوسين ) مبدئيا في النوى جنيب البطين . ولكن كل من هاتين النواتين تتمكن من تكوين هرمون النواة الثانية بكمية تبلغ سدس كمية هرمونها الخاص بها . و عندما تنقل الدفعات العصبية نزولا على طول الألياف من النواة فوق البصرية أو النواة جنيب البطين فإن الهرمون يحرر فورا من الحبيبات الإفرازية في النهايات العصبية بالآلية الإفرازية الاعتيادية الإخراج خلوي إخراج خلوي و يمتص إلى الشعيرات الدموية المجاورة . و يفرز النوروفيزين مع الهرمون سوية، ولكن بسبب ارتباطهما ببعضهما برخاوة ؛ فإن الهرمون ينفصل رأسا . و لا تعرف أية وظيفة للنوروفيزين بعد تركه للنهايات العصبية .
الطبيعة الكيميائية لكل من الهرمون المضاد لإدرار البول ولهرمون الأوكسيتوسين
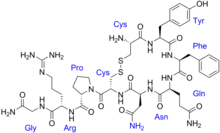
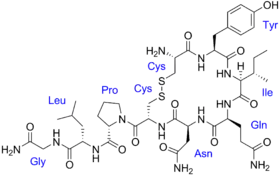
الأوكسيتوسين و الهرمون المضاد لإدرار البول ( الفازوبرسين ) كلاهما عديد ببتيد يحوي تسعة أحماض أمينية ؛ و تسلسل الأحماض الأمينية[3] هو كالآتي :
- الفازوبرسين:[5] سيستئين - تيروزين - فينيل ألانين - جليسين - أسباراجين - سيستئين - برولين - أرجنين - جليسين NH2 .
- الأوكسيتوسين : سيستئين - تيروزين - إيزولوسين - جليسين - أسباراجين - سيستئين - برولين - لوسين - جليسين NH2 .
و يلاحظ بأن هذين الهرمونين متشابهان تقريبا ماعدا وجود الفينيل ألانين والأرجنين في الفازوبرسين عوضا عن الإيزولوسين واللوسين في جزئي الأوكسيتوسين . و يعلل تشابه الجزيئين التشابه الجزئي في وظائفها .
الوظائف الفسيولوجية للهرمون المضاد للإبالة
تتمكن كميات دقيقة جدا من الهرمون المضاد لإدرار البول ADH - بكمية تصل إلى 2 نانوجرام - عند إعطائها إلى الشخص من توليد تضاد الإبالة، أي تقليل إفراغ الماء من الكليتين.[6]
و باختصار ؛ فعند غياب الهرمون المضاد لإدرار البول ADH تكون القنوات والنبيبات الجامعة غير نفوذة للماء أبدا تقريبا، مما يمنع أي إعادة امتصاص ملحوظة للماء، فيسمح بذلك بفقدان كمية كبيرة من الماء إلى البول مسببا تخفيفه الشديد . و من الناحية الأخرى، تزداد نفوذية القنوات والنبيبات الكلوية الجامعة للماء كثيرا - عند وجود الهرمون المضاد لإدرار البول - و تسمح بإعادة امتصاص معظم الماء عندما يمر السائل النبيبي خلالها، فيحافظ بذلك على الماء في الجسم . و لا تعرف لحد الآن الآلية الدقيقة التي يعمل بها الهرمون المضاد لإدرار البول على القنوات ليزيد من نفوذيتها إلا لدرجة محدودة . إذ تكون الأغشية الجوفية للخلايا النبيبية الكلوية - بدون الهرمون المضاد لإدرار - كتيمة تقريبا للماء . و لكن من ناحية ثانية، يوجد مباشرة داخل الغشاء الخلوي أعداد كبيرة من الحويصلات الخاصة التي لها مسام نفوذة للماء بصورة عالية . و عندما يعمل الهرمون المضاد لإدرار البول على الخلية فإنه يتحد أولا مع مستقبلات الهرمون في الغشاء التي تسبب تكوين cAMP . و يسبب هذا بدوره فسفرة العناصر الموجودة في الحويصلات الخاصة، مما يؤدي فيما بعد إلى إقحام الحويصلات في الغشاء الخلوي ، و توفير العديد من الباحات العالية النفوذية للماء.[7] و يحدث كل ذلك في خلال 5 - 10 دقائق . و في غياب الهرمون المضاد لإدرار البول ؛ تنعكس كل هذه العملية في خلال 5 - 10 دقائق أخرى . و هكذا نرى أن هذه العملية توفر وقتيا العديد من المسام الجديدة التي تسمح بانتشار الماء بحرية بين السائل النبيبي الكلوي والسائل حول النبيبي الكلوي . و من ثم يمتص الماء من القنوات والنبيبات الكلوية الجامعة بالتناضح .
تنظيم إنتاج الهرمون المضاد للإبالة ( التنظيم التناضحي )
عند إعطاء محلول كهرل مركز إلى الشريان الذي يجهز الوطاء ، تنقل عصبونات الهرمون المضاد لإدرار البول في النوى فوق البصرية وجنيب البطين رأسا دفعات إلى الغدة النخامية الخلفية لتحرر كميات كبيرة من الهرمون المضاد لإدرار البول إلى دم الدوران، وعلى العكس من ذلك فعند إعطاء محلول مخفف إلى هذا الشريان فإنه يولد توقفا تاما للدفعات، وفي الواقع توقفا تاما لإفراز الهرمون المضاد لإدرار البول و يدمر الهرمون المضاد لإدرار البول الذي سبق وجوده في الأنسجة بمعدل النصف تقريبا كل 10 - 20 دقيقة . و لهذا فإن تركيز الهرمون المضاد لإدرار البول في سوائل الجسم يمكن أن يتغير من كمية صغيرة إلى كمية كبيرة أو بالعكس خلال بضع دقائق فقط .[8]
و الطريقة الدقيقة التي يحكم بها التركيز التناضحي للسوائل خارج الخلايا إفراز الهرمون المضاد لإدرار البول لا تزال غير واضحة . و مع ذلك ؛ توجد في محل ما في الوطاء أو بالقرب منه مستقبلات عصبونات محورة تسمى مستقبلات التناضح Osmoreceptor ، فعندما يصبح السائل خارج الخلايا عالي التركيز، يسحب السائل بالتناضح إلى خارج خلايا مستقبلات التناضح فيصغر حجمها وتبدأ إشارات مناسبة في الوطاء لتولد إفرازا إضافيا للهرمون المضاد لإدرار البول . و على العكس من ذلك، عندما يصبح السائل خارج الخلايا مخففا جدا يتحرك الماء بالتناضح بالاتجاه المعاكس للخلية، فبقلل ذلك من الإشارة لإفراز الهرمون المضاد لإدرار البول.[9] و بالرغم من أن بعض الباحثين يضعون مستقبلات التناضح هذه في الوطاء نفسه - و ربما حتى في نفس النوى فوق البصرية - إلا أنه يعتقد آخرون أنها تقع في العضو الوعائي Vascular organ of lamina terminalis ، و هو بنية كثيرة الأوعية الدموية تقع في الجدار الأمامي البطني للبطين الثالث . و بصرف النظر عن الآلية ؛ فإن سوائل الجسم المركزة تنبه فعلا النوى فوق البصرية، بينما تقوم السوائل المخففة بتثبيطها . و لهذا يوجد نظام تحكمي تلقيمي راجع للتحكم بالضغط التناضحي الكلي لسوائل الجسم، ويعمل بالطريقة التالية :
عندما تصبح سوائل الجسم عالية التركيز، تستثار النوى فوق البصرية، وتنقل دفعات إلى الغدة النخامية الخلفية، ويفرز الهرمون المضاد لإدرار البول . و يمر هذا بطريق الدم إلى الكليتين حيث أنه يزيد من نفوذية القنوات الكلوية الجامعة للماء . و كنتيجة لذلك يعاد امتصاص معظم الماء من السائل النبيبي الكلوي بينما يستمر فقدان الكهرل إلى البول . و يخفف ذلك من السائل خارج الخلايا و يعيده بصورة مناسبة إلى تركيبه التناضحي السوي.[8]
التأثير المضيق للأوعية والرافع للضغط للهرمون المضاد للإبالة وزيادة إفراز الهرمون المضاد للإبالة الذي يسببه حجم الدم الواطئ
بالإضافة لتأثير التراكيز الدقيقة للهرمون المضاد لإدرار البول ADH في زيادة احتفاظ الكلية بالماء ، فإن لتراكيزه العالية التأثير الشديد جدا في تضييق الشرينات في كل أنحاء الجسم ، و بالتالي رفع ضغط الدم الشرياني . و لهذا السبب اكتسب الهرمون المضاد للإبالة اسما آخر وهو الفازوبرسين أي الهرمون المضيق للأوعية . و أحد المنبهات التي تولد إفرازا شديدا جدا للفازوبرسين هو نقص حجم الدم . و يحصل ذلك بشدة بصورة خاصة عندما ينقص حجم الدم .و يحصل ذلك بشدة بصورة خاصة عندما ينقص حجم الدم 15-25% بزيادة سرعة إفرازه أحيانا إلى 50 ضعف إفرازه السوي . و سبب ذلك هو ما يلي :
يمتلك الأذينان، وخاصة الأذين الأيمن ، مستقبلات تمدد فتستثار عند فرط امتلائهما . و عندما تستثار هذه المستقبلات فإنها ترسل إشارات إلى الدماغ تثبط إفراز الهرمون المضاد لإدرار البول . و على العكس من ذلك عندما لا تكون هذه المستقبلات مستثارة نتيجة عدم امتلاء الأذينين يحدث العكس ؛ فيزيد إفراز الهرمون المضاد لإدرار البول بصورة كبيرة . و بالإضافة لذلك فإلى جانب مستقبلات الأذينين التمددية، فإن نقص تمدد مستقبلات الضغط في المناطق السباتية و الأبهرية والرئوية يشارك أيضا في زيادة إفراز الهرمون المضاد لإدرار البول .
تأثير هرمون الأوكسيتوسين على الرحم وعلى الولادة
المادة الأوكسيتوسينية هي تلك التي تسبب تقلص الرحم الحامل . و هرمون الأوكسيتوسين - كما يدل اسمه - ينبه بشدة الرحم الحامل وخاصة عند نهاية الحمل . و لهذا يعتقد العديد من أطباء الولادة بأن هذا الهرمون مسؤول عن تسبيب الولادة لدرجة جزئية على الأقل .
و تؤيد ذلك الحقائق التالية :
- تطول مدة الوضع في الحيوانات المزالة منها الغدة النخامية ، مما يدل على إمكانية تأثير الأوكسيتوسين أثناء الوضع .
- تزداد كمية الأوكسيتوسين في البلازما أثناء الولادة ، و خصوصا أثناء مراحلها الأخيرة .
- يؤدي تنبيه عنق الرحم في حيوان حامل إلى حدوث إشارات عصبية تمر إلى الوطاء و تسبب زيادة في إفراز الأوكسيتوسين .
تأثير الأوكسيتوسين على قذف اللبن
يقوم الأوكسيتوسين بدور خاص هام في عملية الرضاعة رضاعة ؛ و هو دور مفهوم بصورة جيدة أكثر من دوره في وضع الوليد . ففي الرضاعة يسبب هذا الهرمون عصر اللبن من الأسناخ إلى القنوات بحيث يتمكن الرضيع من رضعه . و تعمل هذه الآلية بالطريقة التالية :
تولد منبهات على حلمة الثدي إشارات أخيرا إلى الأعصاب الحسية إلى الدماغ . و تصل الإشارات أخيرا إلى عصبونات الأوكسيتوسين في النوى جنيب البطين وفوق البصرية في الوطاء ، لتسبب تحرير الأوكسيتوسين بواسطة الغدة النخامية الخلفية . و يحمل الأوكسيتوسين بواسطة الدم إلى الثديين حيث يسبب تقلص الخلايا العضلية الظهارية myoepithelial cells التي تكون تعريشة تقع حول أسناخ غدة الثدي .و يبدأ جريان اللبن في أقل من دقيقة بعد بداية الرضاعة. و لذلك تسمى هذه الآلية ( نزول اللبن ) milk letdown أو ( قذف اللبن ) milk ejection .
الخلاصة
الغدة النخامية الخلفية هي نقطة إطلاق الهرمون المضاد لإدرار البول وهرمون الأوكسيتوسين (الهرمون المعجِّل للولادة). ويسيطر التنبيه العصبي من الوطاء على إطلاق هذه الهرمونات في الدم، فعندما يتم التنبيه للغدة النخامية الخلفية من قبل الوطاء، تصدر النخامى العصبية الهرمون المضاد لإدرار البول بزيادة في الضغط الأسموزي للسائل البراني في الجسم، فيعمل الهرمون على الخلايا في النبيبات النهائية والجامعة الكلوية، مما يجعل منها أكثر نفاذية للماء وهكذا ينخفض حجم البول . كما تصدر النخامى العصبية الأوكسيتوسين (الهرمون المعجِّل للولادة) تحت تنبيه من الوطاء . و يُحدث الأوكسيتوسين (الهرمون المعجِّل للولادة) إنقباضات قوية لرحم المأة الحامل مسبباً تدفق اللبن من الثديين . و يسبب تنبيه حلمات الثديين من قبل الرضيع إطلاق هذا الهرمون . كما تدعى هذه الهرمونات أيضا هرمونات الغدة النخامية الخلفية .
صور إضافية
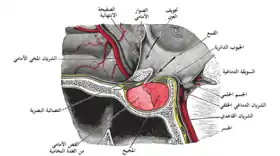 The posterior pituitary comprises the posterior lobe of the pituitary gland.
The posterior pituitary comprises the posterior lobe of the pituitary gland.
انظر أيضا
- الغدة النخامية و علاقتها بالوطاء
- أنماط الخلايا في الغدة النخامية الأمامية
- طبيعة الهرمون
- مستقبلات الهرمون
- الوظائف الفسيولوجية لهرمون النمو
- تنظيم إفراز هرمون النمو
- الهرمونات المؤثرة على الآلية الجينية للخلية
- كيمياء الهرمونات
- قياس سرعة إفراز الهرمون
- قياس تركيز الهرمونات في الدم
- قياس سرعة التصفية الاستقلابية للهرمونات
- آليات عمل الهرمون
- تخزين و إفراز الهرمونات
مراجع
- ref name="NHM-Neuroendocrine systems"
- Hatton, GI (September 1988). "Pituicytes, glia and control of terminal secretion" (PDF). The Journal of Experimental Biology. 139: 67–79. PMID 3062122. مؤرشف من الأصل (PDF) في 30 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - صور نسيجية:14004loa منVaughan, Deborah (2002). A Learning System in Histology: CD-ROM and Guide. دار نشر جامعة أكسفورد. ISBN 978-0195151732. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Median eminence في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- Caldwell HK, Young WS III (2006). "Oxytocin and Vasopressin: Genetics and Behavioral Implications" (PDF). In Lajtha A, Lim R (المحرر). Handbook of Neurochemistry and Molecular Neurobiology: Neuroactive Proteins and Peptides (الطبعة 3rd). Berlin: Springer. صفحات 573–607. ISBN 0-387-30348-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nielsen S, Chou CL, Marples D, Christensen EI, Kishore BK, Knepper MA (1995). "Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channels to plasma membrane". Proc. Natl. Acad. Sci. U.S.A. 92 (4): 1013–7. doi:10.1073/pnas.92.4.1013. PMC 42627. PMID 7532304. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lim MM, Young LJ (2004). "Vasopressin-dependent neural circuits underlying pair bond formation in the monogamous prairie vole". Neuroscience. 125 (1): 35–45. doi:10.1016/j.neuroscience.2003.12.008. PMID 15051143. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Matsukawa T, Miyamoto T (Mar 2011). "Angiotensin II-stimulated secretion of arginine vasopressin is inhibited by atrial natriuretic peptide in humans". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 300 (3): R624-9. doi:10.1152/ajpregu.00324.2010. PMID 21123762. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wang XM, Dayanithi G, Lemos JR, Nordmann JJ, Treistman SN (Nov 1991). "Calcium currents and peptide release from neurohypophysial terminals are inhibited by ethanol". The Journal of Pharmacology and Experimental Therapeutics. 259 (2): 705–11. PMID 1941619. الوسيط
|CitationClass=تم تجاهله (مساعدة)
وصلات خارجية
- بوابة علم وظائف الأعضاء
- بوابة علوم عصبية
- بوابة علم الأحياء
- بوابة الكيمياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة تشريح
- بوابة الكيمياء الحيوية
- بوابة طب
