أكتين
الأكتين هو بروتين ، الوزن الجزيئي له ما يقارب 42 كيلو دالتون، وهذا البروتين موجود في جميع الخلايا حقيقية النواة (والاستثناء الوحيد المعروف عند الحيوانات المنوية للديدان الخيطية) حيث أنه قد يكون موجودا في تركيزات أكثر من 100 ميكرو مولار.[1][2][3] وهو بروتين هيكلي ويشكل جزءا من الهيكل الخلوي وأحد خمسة بروتينات غالبية في حقيقيات النوى ؛ يوجد في الخلايا العضلية حيث يكون من كل 10 جزيئات بروتين واحد من الأكتين، أما في الخلايا الأخرى فهو يوجد بنسبة 1 إلى 5% فقط.
| أكتين | |
|---|---|
 | |
| معرف | |
| رمز | |
| قاعدة بيانات عوائل البروتينات | PF00022 |
| إنتربرو | IPR004000 |
| بروسايت | PDOC00340 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 2btf |
يوجد من جزيئات الأكتين نوعان: نوع كروي G-Aktin ونوع متشابك فتيلي F-Aktin. من خصائص الأكتين الفتيلي انه يتغير شكليا بحيث يستطيل ويقصر. وهو يعتير من ضمن الفتيلات الميكرونية الموجودة في داخل الخلية. وهي تعمل أيضا على تماسك الشكل الخارجي للخلايا وتكوين أطراف للخلية، وتفرعات بين الخلايا، وتعمل على حركة اتجاهية للخلايا. في الكائنات متعددة الخلايا يُشكل الأكتين الأجزاء المركزية لانقباض العضلات. اختلالات في الأكتين ناشئة عن الجينات الوراثية يمكن أن تتسبب في مرض عضلي أو أمراض أخرى.
فالأكتين هي عائلة من البروتينات الكروية متعددة الوظائف التي تشكل خيوط دقيقة. يوجد في جميع الخلايا حقيقية النواة (الاستثناء الوحيد المعروف هو الحيوانات المنوية الخيطية) ، حيث قد يكون موجودًا بتركيز يزيد عن 100 ميكرومتر ؛ تبلغ كتلتها حوالي 42 كيلو دالتون ، بقطر 4 إلى 7 نانومتر. بروتين الأكتين هو الوحدة الفرعية المكونة من نوعين من الخيوط في الخلايا: الميكروفيلم ، أحد المكونات الرئيسية الثلاثة للهيكل الخلوي ، والخيوط الرقيقة ، وهي جزء من الجهاز المقلص في الخلايا العضلية. يمكن أن تكون موجودة إما كمونومر حر يسمى G-actin (كروي) أو كجزء من microfilament خطية من البوليمر يسمى F-actin (خيطي) ، وكلاهما ضروري لمهام الخلوية الهامة مثل قابلية الحركة والانكماش للخلايا أثناء انقسام الخلية. يشارك الأكتين في العديد من العمليات الخلوية المهمة ، بما في ذلك تقلص العضلات ، حركية الخلية ، انقسام الخلايا والحركة الخلوية ، حركة الحويصلة والعضية ، إشارات الخلية ، وإنشاء وصيانة تقاطعات الخلايا وشكلها. يتم التوسط في العديد من هذه العمليات من خلال تفاعلات واسعة وحميمة من الأكتين مع الأغشية الخلوية. في الفقاريات ، تم تحديد ثلاث مجموعات رئيسية من أشكال الأكتين ، ألفا ، بيتا ، وغاما. الأكتين ألفا ، الموجود في أنسجة العضلات ، هي مكون رئيسي للجهاز الانقباضي. تتعايش أكتينات بيتا وغاما في معظم أنواع الخلايا كمكونات في الهيكل الخلوي ، وكوسطاء لحركية الخلية الداخلية. ويعتقد أن مجموعة متنوعة من الهياكل التي شكلتها أكتين تمكنها من تحقيق مثل هذه المجموعة الكبيرة من الوظائف يتم تنظيمها من خلال ربط التروبوميوسين على طول الخيوط. توفر قدرة الخلية على تشكيل حبيبات مجهرية ديناميكية السقالات التي تسمح لها بإعادة تشكيل نفسها بسرعة استجابة لبيئتها أو إلى الإشارات الداخلية للكائن الحي ، على سبيل المثال ، لزيادة امتصاص غشاء الخلية أو زيادة الالتصاق بالخلايا من أجل تكوين أنسجة الخلية. يمكن تثبيت الإنزيمات أو العضيات الأخرى مثل الأهداب على هذه السقالات من أجل التحكم في تشوه غشاء الخلية الخارجي ، والذي يسمح بالبطانة الداخلية والخلايا الخلوية. يمكن أن ينتج حركة إما بمفرده أو بمساعدة محركات جزيئية. لذلك يساهم الأكتين في عمليات مثل النقل داخل الحويصلات من الحويصلات والعضيات وكذلك تقلص العضلات والهجرة الخلوية. لذلك يلعب دورًا مهمًا في تكوين الأجنة وتضميد الجراح وغزو الخلايا السرطانية. يمكن تتبع الأصل التطوري للأكتين إلى الخلايا بدائية النواة ، التي تحتوي على بروتينات مكافئة. متماثلات الأكتين من بدائيات النوى والبلمرة القديمة تتحول إلى خيوط حلزونية أو خطية مختلفة تتكون من خيوط أو عدة خيوط. ومع ذلك ، يتم الاحتفاظ بجهات الاتصال الداخلية ومواقع ربط النوكليوتيدات في بدائيات النوى وفي الأركيا. أخيرًا ، يلعب الأكتين دورًا مهمًا في التحكم في التعبير الجيني. يحدث عدد كبير من الأمراض والأمراض بسبب طفرات في أليلات الجينات التي تنظم إنتاج الأكتين أو البروتينات المرتبطة به. إنتاج الأكتين هو أيضا مفتاح لعملية العدوى من قبل بعض الكائنات الحية الدقيقة المسببة للأمراض. الطفرات في الجينات المختلفة التي تنظم إنتاج الأكتين عند البشر يمكن أن تسبب أمراضًا عضلية ، وتغيرات في حجم القلب ووظيفته وكذلك الصمم. يرتبط تكوين الهيكل الخلوي أيضًا بالتسبب في البكتيريا والفيروسات داخل الخلايا ، خاصةً في العمليات المتعلقة بالتهرب من إجراءات الجهاز المناعي. بروتين كروي بوزن جزيئي حوالي 40،000 يشكل العضلات. تسمى المادة المفردة G actin ، والمبلمرة في شكل خيوط هي F actin ، والمادة التي يرتبط بها التروبونين والتروبوميوسين بهيكلها الحلزوني المزدوج هي المكون الرئيسي لألياف العضلات الرقيقة (الشعيرة الأولى). يحدث تقلص العضلات عن طريق التفاعل بين الألياف السميكة (خيوط) التي شكلتها الميوسين .
الإكتشاف والتحقيق المبكر
تمت ملاحظة الأكتين لأول مرة تجريبيًا في عام 1887 بواسطة WD Halliburton ، الذي استخرج بروتينًا من العضلات قام بتخثر مستحضرات الميوسين التي أطلق عليها اسم "تخمير الميوسين". [4]ومع ذلك، لم يتمكن هاليبيرتون من تحسين النتائج التي توصل إليها، ويعزى اكتشاف الأكتين بدلاً من ذلك إلى برونو فيرينك ستراوب، عالم الكيمياء الحيوية الشاب الذي يعمل في مختبر ألبرت زينت جيورجي في معهد الكيمياء الطبية بجامعة سيغيد. ،المجر .
متابعة لاكتشاف Ilona Banga & Szent-Györgyi في عام 1941 أن التخثر يحدث فقط في بعض عمليات استخراج الميسوسين ويتم عكسه عند إضافة ATP ، [5]حدد ستروب الأكتين وتنقيته من مستحضرات الميوسين التي تخثرت بالفعل. بناءً على طريقة استخلاص بانجا الأصلية، طور تقنية جديدة لاستخراج بروتين العضلات التي سمحت له بعزل كميات كبيرة من الأكتين النقي نسبيًا، والتي نُشرت عام 1942. طريقة ستروب هي نفسها المستخدمة في المعامل اليوم. نظرًا لأن بروتين ستراوب كان ضروريًا لتنشيط تخثر الميوسين، فقد أطلق عليه اسمالأكتين . إدراكًا من Szent- Györgyi أنمستحضرات الميوسين المتخثر من Banga تحتوي على الأكتين أيضًا، فقد أطلق على خليط البروتينات أكتموسين .
أدت الأعمال العدائية في الحرب العالمية الثانية إلى أن Szent-Gyorgyi لم يكن قادرًا على نشر أعمال مختبره في المجلات العلمية الغربية . لذلك أصبح الأكتين معروفًا جيدًا في الغرب فقط في عام 1945 ، عندما نُشرت ورقتهم كملحق لـ Acta Physiologica Scandinavica . واصلت ستروب للعمل على الأكتين، وفي عام 1950 ذكرت أن الأكتين تحتوي ملزمة ATP ، وأنه خلال البلمرة من البروتين إلى خيوط دقيقة، والنوكليوتيدات وتحلل إلىADP وغير العضوية الفوسفات(التي تظل مرتبطة بالميكروفيلمنت). اقترح ستراوب أن تحول الأكتين المرتبط بـ ATP إلى الأكتين المرتبط بـ ADP يلعب دورًا في تقلص العضلات. في الواقع، هذا صحيح فقط في العضلات الملساء، ولم يتم دعمه من خلال التجارب حتى عام 2001.
في تسلسل الأحماض الأمينية تم الانتهاء من الأكتين التي كتبها M. ايلزينجا وزملاء العمل في عام 1973. والتركيب البلوري تم حلها من G-الأكتين في عام 1990 من قبل Kabsch والزملاء. في العام نفسه، اقترح هولمز وزملاؤه نموذجًا لـ F-actin بعد تجارب باستخدام التبلور المشترك مع بروتينات مختلفة. تم استخدام إجراء التبلور المشترك مع بروتينات مختلفة بشكل متكرر خلال السنوات التالية، حتى عام 2001 تمت بلورة البروتين المعزول مع ADP. ومع ذلك، لا يوجد حتى الآن هيكل عالي الدقة للأشعة السينية لـ F-actin. كان تبلور F-actin ممكنًا بسبب استخدام رودامينمتقارن يعيق البلمرة عن طريق منع الحمض الأميني cys-374 . توفت كريستين أوريول-تدوين في نفس العام الذي تبلور فيه الأكتين لأول مرة، لكنها كانت الباحثة التي تبلورت الأكتين لأول مرة في عام 1977 في غياب البروتينات الملزمة للأكتين (ABPs). ومع ذلك، كانت البلورات الناتجة صغيرة جدًا بالنسبة للتقنية المتاحة في ذلك الوقت.
على الرغم من عدم وجود نموذج عالي الدقة للشكل الخيطي للأكتين حاليًا، فقد تمكن فريق صوايا في عام 2008 من إنتاج نموذج أكثر دقة لهيكله استنادًا إلى بلورات متعددة من ثنائيات الأكتين التي ترتبط في أماكن مختلفة. تم تنقيح هذا النموذج لاحقًا بواسطة صوايا ولورنز.نهج أخرى مثل استخدام المجهر البرد الإلكترون والإشعاع السنكروترون سمحت مؤخرا زيادة دقة وفهم أفضل لطبيعة التفاعلات والتغيرات متعلق بتكوين المتورطين في تشكيل الأكتين خيوط.
بناء
الأكتين في الأمينية تسلسل الحمض هو واحد من أكثر جداالحفاظ عليها من البروتينات لأنها قد تغير يذكر على مدى تطور، واختلاف بنسبة لا تزيد على 20٪ في الأنواعمختلفة مثل الطحالب والبشر . [6]ولذلك يعتبر أن لديهاهيكل أمثل .[7] وله سمتان مميزتان: إنه إنزيم يحلل ببطءATP ، "عملة الطاقة العالمية" للعمليات البيولوجية. ومع ذلك، فإن ATP مطلوب من أجل الحفاظ على سلامتها الهيكلية. يتكون هيكلها الفعال من هيكل فريد تقريباعملية الطي . بالإضافة إلى ذلك، فهو قادر على إجراء تفاعلات أكثر من أي بروتين آخر، مما يسمح له بأداء مجموعة متنوعة من الوظائف أكثر من البروتينات الأخرى في كل مستوى من مستويات الحياة الخلوية تقريبًا. [8] الميوسين هو مثال على بروتين يرتبط بالأكتين. مثال آخر هو الشرير، الذي يمكنه نسج الأكتين إلى حزم أو قطع الخيوط اعتمادًا على تركيز كاتيونات الكالسيوم في الوسط المحيط. [9]
الأكتين هو أحد البروتينات الأكثر وفرة في حقيقيات النوى، حيث يوجد في جميع أنحاء السيتوبلازم. [9] في الواقع، تشكل الألياف العضلية 20٪ من البروتين الخلوي الكلي بالوزن وما بين 1٪ و 5٪ في الخلايا الأخرى. ومع ذلك، لا يوجد نوع واحد فقط من الأكتين ؛ و الجينات التي تم تعريفها رمز لالأكتين بمثابة عائلة الجينات (عائلة في النباتات تحتوي على أكثر من 60 عناصر، بما في ذلك الجينات والجينات الكاذبة وفي البشر أكثر من 30 عناصر). [10]هذا يعني أن المعلومات الجينية لكل فرد تحتوي على تعليمات تولد متغيرات أكتين (تسمى الأشكال الإسوية) التي تمتلك وظائف مختلفة قليلاً. وهذا بدوره يعني أن الكائنات حقيقية النواة تعبر عن جينات مختلفة تؤدي إلى: α-actin ، الموجود في الهياكل الانقباضية ؛ β-actin ، الموجود عند الحافة المتوسعة للخلايا التي تستخدم إسقاط هياكلها الخلوية كوسيلة للتنقل ؛ وبيتا-أكتين الموجود في خيوط ألياف الإجهاد . [11] بالإضافة إلى أوجه التشابه الموجودة بين الأشكال الإسوية للكائن، هناك أيضًا حماية تطورية في التركيب والوظيفة حتى بين الكائنات الحية الموجودة في مجالات حقيقية النواة المختلفة . في البكتيريا، يكون متماثل الأكتين MreBتم التعرف عليه،[8] وهو بروتين قادر على البلمرة إلى خيوط دقيقة ؛ وفي العتائق يكون المتماثل Ta0583 أكثر تشابهًا مع الأكتينات حقيقية النواة. [12]
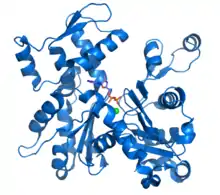
يحتوي الأكتين الخلوي على شكلين: كريات أحادية تسمى G-actin وخيوط بوليمرية تسمى F-actin (أي كخيوط مكونة من العديد من مونومرات G-actin). يمكن أيضًا وصف F-actin بأنه خيوط دقيقة. يجب أن تدور خصلتان متوازيتان من نوع F-actin بمقدار 166 درجة لتستقر بشكل صحيح فوق بعضها البعض. يؤدي هذا إلى إنشاء الهيكل الحلزوني المزدوج للألياف الدقيقة الموجودة في الهيكل الخلوي. يبلغ قطر الألياف الدقيقة حوالي 7 نانومترمع تكرار اللولب كل 37 نانومتر. يرتبط كل جزيء من الأكتين بجزيء من ثلاثي فوسفات الأدينوسين (ATP) أو ثنائي فوسفات الأدينوسين (ADP) المرتبط بـ Mg 2+الكاتيون. أكثر أشكال الأكتين شيوعًا، مقارنة بجميع التركيبات الممكنة، هي ATP-G-Actin و ADP-F-actin. [13]
G- أكتين
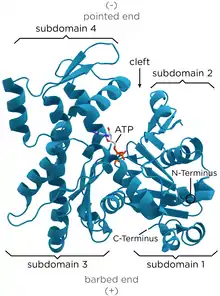
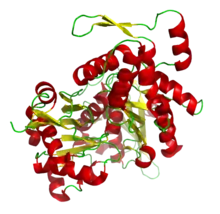
تشير صور المجهر الإلكتروني الماسح إلى أن G-actin له بنية كروية ؛ ومع ذلك، يوضح علم البلورات بالأشعة السينية أن كل من هذه الكريات تتكون من فصين يفصل بينهما شق. تمثل هذه البنية "طية ATPase" ، وهي مركزالتحفيز الأنزيمي الذي يربط ATP و Mg 2+ ويتحلل السابق بـ ADP بالإضافة إلى الفوسفات . هذه الطية عبارة عن حافز هيكلي محفوظ يوجد أيضًا في البروتينات الأخرى التي تتفاعل مع نيوكليوتيدات ثلاثي الفوسفات مثل هيكسوكيناز (إنزيم يستخدم في استقلاب الطاقة ) أو فيبروتينات Hsp70 (عائلة بروتينية تلعب دورًا مهمًا في طي البروتين). G-actin إلا عندما يحتوي إما على ADP أو ATP في شقه ولكن الشكل المرتبط بـ ATP يسود في الخلايا عندما يكون الأكتين موجودًا في حالته الحرة.[13]
و البلورات بالأشعة السينية نموذج من الأكتين التي تم إنتاجها من قبل Kabsch من الأنسجة العضلية المخططة من الأرانب هو الأكثر شيوعا في الدراسات البنيوية كما كان أول من تنقيته . وG-الأكتين تبلورت من خلال Kabsch حوالي 67 × 40 × 37 Å في الحجم، لديها الكتلة الجزيئية من 41785 دا ويقدر نقطة تساوي الكهربائية من 4.8. [14]في صافي تهمة في درجة الحموضة = 7 هو -7
- الهيكل الأساسي
حدد Elzinga وزملاؤه لأول مرة تسلسل الببتيد الكامل لهذا النوع من الأكتين في عام 1973 ، مع عمل لاحق لنفس المؤلف أضاف مزيدًا من التفاصيل إلى النموذج. يحتوي على 374 بقايا من الأحماض الأمينية . في N-محطة هي غاية الحمضية ويبدأ مع acetyled اسبارتاتي في مجموعة الأمينية. في حين أن C-محطة هي القلوية وشكلت من قبلالفنيل الأنين يسبقه السيستين، والتي لديها درجة من الأهمية الوظيفية. كلا الطرفين على مقربة من النطاق الفرعي I. شذوذ N τ -methylhistidineيقع في الموقع 73. [15]
- الهيكل الثالث - المجالات
ويتكون الهيكل العالي من قبل اثنين من المجالات المعروفة باسم الكبيرة والصغيرة، التي تكون مفصولة شق تتمحور حول موقع السندات مع ATP - ADP + P ط . يوجد أسفل هذا شق أعمق يسمى "الأخدود". في الولاية الأصلية، على الرغم من أسمائهم، كلاهما لهما عمق مماثل. [14]
الاصطلاح العادي في الطوبولوجي تعني الدراسات أن البروتين يظهر بأكبر مجال على الجانب الأيسر وأصغر مجال على الجانب الأيمن. في هذا الموضع، ينقسم النطاق الأصغر بدوره إلى قسمين: المجال الفرعي الأول (الموضع السفلي، المخلفات 1–32 ، 70-144 ، 338-374) والمجال الفرعي الثاني (الموضع العلوي، المخلفات 33-69). ينقسم النطاق الأكبر أيضًا إلى قسمين: المجال الفرعي III (السفلي، المخلفات 145-180 و 270-337) والمجال الفرعي IV (الأعلى، المخلفات 181-269). يشار إلى المناطق المكشوفة للنطاقين الفرعيين الأول والثالث بالنهايات "الشائكة" ، بينما تسمى المناطق المكشوفة للنطاقين الثاني والرابع بالنهايات "المدببة". تشير هذه التسمية إلى حقيقة أنه، نظرًا للكتلة الصغيرة للنطاق الفرعي الأكتين الثاني هو قطبي ؛ ستتم مناقشة أهمية هذا أدناه في المناقشة حول ديناميكيات التجميع.يدعي بعض المؤلفين المجالات الفرعية Ia و Ib و IIa و IIb ،
- هياكل مهمة أخرى
وأبرز هيكل ثانوي هو ورقة بيتا من خمس سلاسل تتكون من β-تعرج ووحدة β-α-β في اتجاه عقارب الساعة. إنه موجود في كلا المجالين مما يشير إلى أن البروتين نشأ من تكرار الجينات.
- يقع موقع ربط نوكليوتيد الأدينوزين بين بنيتين على شكل دبوس شعر بيتا تتعلقان بالمجالات I و III. البقايا المتورطة هي Asp11-Lys18 و Asp154-His161 على التوالي.
- يقع موقع الارتباط الكاتيوني ثنائي التكافؤ أسفل موقع نوكليوتيد الأدينوزين. غالبًا ما يتم تكوينه في الجسم الحي بواسطة Mg 2+ أو Ca 2+ بينما يتم تكوينه في المختبر من خلال هيكل مخلب يتكون من Lys18واثنين من الأكسجين من النوكليوتيدات α-and- فوسفات . يتم تنسيق هذا الكالسيوم مع ستة جزيئات ماء يتم الاحتفاظ بها بواسطة الأحماض الأمينية Asp11 و Asp154 و Gln137. تشكل معقدًا مع النيوكليوتيد الذي يقيد حركات ما يسمى بالمنطقة "المفصلية" ، الواقعة بين البقايا 137 و 144. هذا يحافظ على الشكل الأصلي للبروتين حتى يفسد انسحابه مونومر أكتين. هذه المنطقة مهمة أيضًا لأنها تحدد ما إذا كان شق البروتين في التشكل "المفتوح" أو "المغلق". [16]
- من المحتمل جدًا وجود ثلاثة مراكز أخرى على الأقل ذات تقارب أقل (وسيط) وأخرى ذات تقارب منخفض للكاتيونات ثنائية التكافؤ. لقد تم اقتراح أن هذه المراكز قد تلعب دورًا في بلمرة الأكتين من خلال العمل أثناء مرحلة التنشيط.
- هناك بنية في فرعي 2 الذي يسمى "D-حلقة" لأنه يربط مع الدناز I ، وهي تقع بين His40 و Gly48 المخلفات. لها مظهر عنصر غير منظم في غالبية البلورات، لكنها تبدو مثل ورقة β عندما تكون معقدة مع DNase I. وقد تم اقتراح أن الحدث الرئيسي في البلمرة هو على الأرجح انتشار تغيير توافقي من مركز الرابطة مع النيوكليوتيدات إلى هذا المجال، والذي يتغير من حلقة إلى لولب. ومع ذلك، تم دحض هذه الفرضية من قبل دراسات أخرى. [16]
F- أكتين
وصف الكلاسيكية من F-الأكتين الدول التي لديها بنية

الخيطية التي يمكن أن تعتبر واحدة الذين تقطعت بهم السبل أيسري التدوير الحلزون مع دوران 166 درجة حول محور حلزوني وترجمة المحورية 27.5 Å ، أو واحد الذين تقطعت بهم السبل ميمن الحلزون مع صليب على تباعد 350-380 Å ، مع كل أكتين محاطة بأربعة أخرى. [18]تناظر بوليمر الأكتين عند 2.17 وحدة فرعية في كل دورة من اللولب غير متوافق مع تكوين البلورات، وهو أمر ممكن فقط مع تناظر 2 أو 3 أو 4 أو 6 وحدات فرعية في كل دورة. لذلك، يجب بناء نماذج تشرح هذه الحالات الشاذة باستخدام بيانات من المجهر الإلكتروني، المجهر الإلكتروني بالتبريد، تبلور الثنائيات في أوضاع مختلفة وانحراف الأشعة السينية . [19] وتجدر الإشارة إلى أنه ليس من الصحيح الحديث عن "بنية" لجزيء ديناميكي مثل خيوط الأكتين. في الواقع، نتحدث عن حالات هيكلية متميزة، حيث يظل قياس الترجمة المحورية ثابتًا عند 27.5 Å بينما تُظهر بيانات دوران الوحدة الفرعية تباينًا كبيرًا، مع عمليات نزوح تصل إلى 10 ٪ من موقعها الأمثل الذي يُرى بشكل شائع. يبدو أن بعض البروتينات، مثل cofilin ، تزيد من زاوية الانعطاف، ولكن مرة أخرى يمكن تفسير ذلك على أنه إنشاء حالات هيكلية مختلفة. يمكن أن تكون هذه مهمة في عملية البلمرة. [20]
هناك اتفاق أقل فيما يتعلق بقياسات نصف قطر الدوران وسماكة الفتيل: بينما حددت النماذج الأولى طولًا 25 ، تشير بيانات حيود الأشعة السينية الحالية، المدعومة بالمجهر الإلكتروني بالتبريد، إلى طول 23.7 Å. أظهرت هذه الدراسات نقاط الاتصال الدقيقة بين المونومرات. بعضها يتكون من وحدات من نفس السلسلة، بين النهاية "الشائكة" على مونومر واحد والنهاية "المدببة" للجزء التالي. في حين أن المونومرات في السلاسل المجاورة تقوم بالاتصال الجانبي من خلال الإسقاطات من النطاق الفرعي IV ، مع أن أهم الإسقاطات هي تلك التي تكونت بواسطة الطرف C والوصلة الكارهة للماء المكونة من ثلاثة أجسام تتضمن بقايا 39-42 ، 201-203 ، و 286. هذا يشير النموذج إلى أن الخيط يتكون من المونومرات في تشكيل "صفيحة" ، حيث تدور النطاقات الفرعية حول نفسها،MreB . [21]
يعتبر بوليمر F-actin ذو قطبية هيكلية نظرًا لحقيقة أن جميع الوحدات الفرعية للخيوط الدقيقة تشير إلى نفس النهاية. يؤدي هذا إلى ظهور اصطلاح تسمية: النهاية التي تمتلك وحدة فرعية أكتين تعرض موقع ارتباط ATP الخاص بها تسمى "(-) النهاية" ، بينما يسمى الطرف المقابل حيث يتم توجيه الشق إلى مونومر مجاور مختلف بـ " (+) النهاية ". المصطلحات "مدببة" و "شائكة" تشير إلى طرفي الألياف الدقيقة مشتقة من مظهرها تحت المجهر الإلكتروني النافذ عند فحص العينات باتباع تقنية تحضير تسمى "زخرفة".. يشكل هذا الميوسين روابط قطبية مع مونومرات الأكتين، مما يؤدي إلى تكوين يشبه الأسهم مع قاذفات الريش على طول عمودها، حيث يكون العمود هو الأكتين والقفزات هي الميوسين. باتباع هذا المنطق، فإن نهاية الخيوط الدقيقة التي لا تحتوي على أي ميوسين بارز تسمى نقطة السهم (- النهاية) وتسمى النهاية الأخرى بالنهاية الشائكة (+ النهاية).[22] يتكون الجزء S1 من مناطق الرأس والرقبة للميوسين الثاني . في ظل الظروف الفسيولوجية، يتم تحويل G-actin ( شكل المونومر ) إلى F-actin ( شكل البوليمر ) بواسطة ATP ، حيث يكون دور ATP ضروريًا.
تحتوي خيوط F-actin الحلزونية الموجودة في العضلات أيضًا على جزيء تروبوميوسين، وهو بروتين بطول 40نانومترًا ملفوفًا حول حلزون F-actin. خلال مرحلة الراحة، يغطي التروبوميوسين المواقع النشطة للأكتين بحيث لا يحدث تفاعل الأكتين والميوسين وينتج تقلصًا عضليًا. هناك جزيئات بروتينية أخرى منضمة إلى موضوع التروبوميوزين، وهذه هي troponins التي لديها ثلاثة البوليمرات: التروبونين I ، التروبونين T ، و تروبونين C . [23]
قابلة للطي
يمكن أن يكتسب الأكتين تلقائيًا جزءًا كبيرًا من هيكله
الثالث . [25] ومع ذلك، فإن الطريقة التي يكتسب بها شكله الوظيفي الكامل من شكله الأصلي المركب حديثًا خاصة وفريدة تقريبًا في كيمياء البروتين. قد يكون سبب هذا المسار الخاص هو الحاجة إلى تجنب وجود مونومرات الأكتين المطوية بشكل غير صحيح، والتي يمكن أن تكون سامة لأنها يمكن أن تعمل كمنهي بلمرة غير فعال. ومع ذلك، فهي أساسية لتحقيق استقرار الهيكل الخلوي، بالإضافة إلى أنها عملية أساسية لتنسيق دورة الخلية . [26]
مطلوب CCT للتأكد من أن الطي يتم بشكل صحيح. CCT هي مجموعة تشبيرونين من المجموعة الثانية، وهي مركب بروتين كبير يساعد في طي البروتينات الأخرى. يتكون CCT من حلقة مزدوجة من ثماني وحدات فرعية مختلفة (غير متجانسة - ثماني النواة) ويختلف عن مرافقي المجموعة الأولى مثل GroEL ، الموجود في Eubacteria وفي عضيات حقيقية النواة، لأنه لا يتطلب مساعدًا مساعدًاليكون بمثابة غطاء. فوق التجويف الحفاز المركزي . ترتبط الركائز بـ CCT من خلال مجالات محددة. كان يُعتقد في البداية أنه يرتبط فقط بالأكتين والتوبيولين، على الرغم من أن دراسات الترسيب المناعي الحديثة أظهرت أنه يتفاعل مع عدد كبير من عديد الببتيدات، والتي ربما تعمل مثلركائز . إنه يعمل من خلال التغييرات التوافقية المعتمدة على ATP والتي تتطلب أحيانًا عدة جولات من التحرير والحفز من أجل إكمال التفاعل. [27]
من أجل إكمال طيها بنجاح، يحتاج كل من الأكتينوالتوبيولين إلى التفاعل مع بروتين آخر يسمى بريفولدين، وهو مركب غير متجانس هكساميريكي (يتكون من ستة وحدات فرعية متميزة) ، في تفاعل محدد جدًا لدرجة أن الجزيئات قد تطورت معًا [ بحاجة لمصدر ] . مجمعات الأكتين مع البروفولدين بينما لا تزال قيد التكوين، عندما يكون طولها حوالي 145 حمضًا أمينيًا، وتحديداً تلك الموجودة في N-terminal.[28]
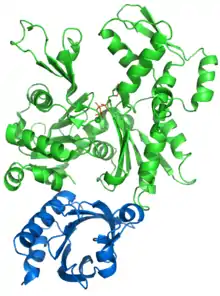
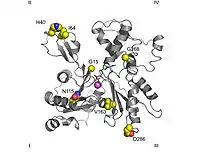
تُستخدم وحدات تمييز فرعية مختلفة للأكتين أو التوبولين على الرغم من وجود بعض التداخل. في الأكتين، تكون الوحدات الفرعية التي ترتبط بالبريفولدين هي على الأرجح PFD3 و PFD4 ، والتي ترتبط في مكانين، أحدهما بين المخلفات 60-79 والآخر بين المخلفات 170-198. يتم التعرف على الأكتين وتحميله وتسليمه إلى مرافق عصاري خلوي (CCT) في شكل مفتوح من خلال النهاية الداخلية لـ "مخالب" بريفولدين (انظر الصورة والملاحظة). الاتصال عند توصيل الأكتين قصير جدًا بحيث لم يتم تشكيل مجمع العالي، وتحرير الفور prefoldin.
نموذج الشريط للمجال γ القمي لـ chaperoninCCT ثم يتسبب CCT في الطي المتسلسل للأكتين عن طريق تكوين روابط مع وحداته الفرعية بدلاً من مجرد وضعه في تجويفه.[29] هذا هو السبب في أنها تمتلك مناطق تمييز محددة في مجالها القمي β. تتكون المرحلة الأولى من الطي من التعرف على المخلفات من 245 إلى 249. بعد ذلك، تحدد المحددات الأخرى الاتصال. يرتبط كل من الأكتين والتوبيولين بـ CCT في مطابقة مفتوحة في غياب ATP. في حالة الأكتين، يتم ربط وحدتين فرعيتين أثناء كل تغيير توافقي، بينما يحدث ربط التوبولين بأربع وحدات فرعية. يحتوي الأكتين على تسلسلات ربط محددة، والتي تتفاعل مع الوحدات الفرعية δ و β-CCT أو مع δ-CCT و ε-CCT. بعد ربط AMP-PNP بـ CCT ، تتحرك الركائز داخل تجويف المرافق. يبدو أيضًا أنه في حالة الأكتين، فإنمطلوب بروتين CAP كعامل مساعد محتمل في حالات الطي النهائية للأكتين.
لا تزال الطريقة الدقيقة التي يتم بها تنظيم هذه العملية غير مفهومة تمامًا، ولكن من المعروف أن البروتين PhLP3 (بروتين مشابه للفوسدوسين ) يثبط نشاطه من خلال تكوين مركب ثلاثي. [27]
آلية التحفيز ATPase
الأكتين هو أتباز، مما يعني أنه هو الإنزيم الذيhydrolyzes ATP. تتميز هذه المجموعة من الإنزيمات بمعدلات تفاعلها البطيئة. من المعروف أن ATPase "نشط" ، أي أن سرعته تزداد بنحو 40.000 مرة عندما يشكل الأكتين جزءًا من خيوط. تبلغ القيمة المرجعية لمعدل التحلل المائي هذا في ظل الظروف المثالية حوالي 0.3ثانية -1 . بعد ذلك، يظل P i مرتبطًا بالأكتين بجوار ADP لفترة طويلة، حتى يتم تحريره بشكل تعاوني من داخل الشعيرة. [30]
لا تزال التفاصيل الجزيئية الدقيقة لآلية التحفيز غير مفهومة تمامًا. على الرغم من وجود الكثير من الجدل حول هذه المسألة، يبدو من المؤكد أن التشكل "المغلق" مطلوب للتحلل المائي لـ ATP ، ويُعتقد أن البقايا المتضمنة في العملية تتحرك إلى المسافة المناسبة. و حمض الجلوتاميك Glu137 هي واحدة من بقايا الرئيسية، والذي يقع في نطاق فرعي 1. وتتمثل مهمتها في ربط جزيء الماء الذي ينتج هجوم أليف النواة على γ-الفوسفات ATP وفي السندات، في حين أن النيوكليوتيد مرتبط بشدة بالمجالات الفرعية 3 و 4. يرجع بطء العملية التحفيزية إلى المسافة الكبيرة والموضع المنحرف لجزيء الماء بالنسبة إلى المادة المتفاعلة. من المحتمل جدًا أن يؤدي التغيير التوافقي الناتج عن دوران المجالات بين شكلي G و F في أكتين إلى تحريك Glu137 أقرب مما يسمح بالتحلل المائي. يشير هذا النموذج إلى أن البلمرة ووظيفة ATPase سيتم فصلهما على الفور. و "فتح" إلى "مغلقة" اتسمت تحول بين G و F الأشكال وآثارها على الحركة النسبية للعديد من مخلفات مفتاح وتشكيل الأسلاك المياه في الديناميات الجزيئية و QM / MM المحاكاة. [31]
علم الوراثة
كان الأكتين واحدًا من أكثر البروتينات التي تم الحفاظ
.[32]عليها بشكل كبير خلال التطور لأنه يتفاعل مع عدد كبير من البروتينات الأخرى. يحتوي على 80.2 ٪ من الحفظ المتسلسل على مستوى الجينات بين Homo sapiens و Saccharomyces cerevisiae (نوع من الخميرة) ، و 95 ٪ الحفاظ على الهيكل الأساسي لمنتج البروتين.
على الرغم من أن معظم الخمائر تحتوي على جين أكتين واحد فقط، فإن حقيقيات النوى الأعلى، بشكل عام، تعبر عن العديد من الأشكال الإسوية من الأكتين المشفرة بواسطة عائلة من الجينات ذات الصلة. تحتوي الثديياتعلى ما لا يقل عن ستة أشكال إسوية أكتين مشفرة بواسطة جينات منفصلة، [33]والتي تنقسم إلى ثلاث فئات (ألفا ،وبيتا ، وجاما) وفقًا لنقاطها الكهربية . بشكل عام ، توجد الأكتينات ألفا في العضلات (α-skeletal ، α-aortic soft ، α-cardiac) ، في حين أن الأشكال الإسوية بيتا وجاما بارزة في الخلايا غير العضلية (β-cytoplasmic ، γ1-cytoplasmic ، γ2- معوي أملس) . على الرغم من تسلسل الأحماض الأمينية وفي المختبرتتشابه خصائص الأشكال الإسوية إلى حد كبير ، ولا يمكن لهذه الأشكال الإسوية أن تحل تمامًا محل بعضها البعض في الجسم الحي .
يحتوي جين الأكتين النموذجي على حوالي 100 نيوكليوتيد 5 'UTR ، ومنطقة مترجمة 1200 نيوكليوتيد ، و 200 نيوكليوتيد 3' UTR . يتم مقاطعة غالبية جينات الأكتين عن طريق الإنترونات ، مع ما يصل إلى ستة إنترونات في أي من 19 موقعًا متميزًا. يجعل الحفظ العالي للعائلة الأكتين النموذج المفضل للدراسات التي تقارن بين نماذج الإنترونات المبكرة والإنترونات المتأخرة لتطور الإنترون.
كل غير كروية بدائيات النوى ويبدو أن تمتلك جينات مثلMreB ، التي ترميز المتماثلات الأكتين. هذه الجينات مطلوبة للحفاظ على شكل الخلية. يقوم الجين المشتق من البلازميد بارم بتشفير بروتين شبيه بالأكتين يكون شكلَهُ المبلمر غير مستقر ديناميكيًا ، ويبدو أنه يقسم DNAالبلازميد إلى خلايا ابنته أثناء انقسام الخلية بواسطة آلية مماثلة لتلك المستخدمة بواسطة الأنابيب الدقيقة في الانقسام حقيقية النواة .[34] تم العثور على الأكتين في كل من الشبكيات الإندوبلازمية الملساء والخشنة.
ديناميات التجميع
التنوي والبلمرة
عوامل النواة ضرورية لتحفيز بلمرة الأكتين. أحد هذه

العوامل هو مركب Arp2 / 3 ، الذي يحاكي ثنائيات G-actin من أجل تحفيز التنوي (أو تكوين الثلث الأول) لـ G-actin الأحادي. و Arp2 / 3 معقدة تربط لالأكتين خيوط في 70 درجة لتشكيل فروع جديدة الأكتين خارج القائمة الأكتين خيوط. التنوي Arp2 / 3 بوساطة ضروري للهجرة الخلوية الموجهة.[35] أيضًا ، تربط خيوط الأكتين نفسها بـ ATP ، ويؤدي التحلل المائي لـ ATP إلى زعزعة استقرار البوليمر.
نمو شعيرات الأكتين يمكن ينظمها ثيموسين و profilin . يرتبط الثيموسين بـ G-actin لعزل عملية البلمرة ، بينما يرتبط البروفيلين بـ G-actin لتبادل ADP لـ ATP ، مما يعزز الإضافة الأحادية إلى الشائكة ، بالإضافة إلى نهاية خيوط F-actin.
F-actin قوي وديناميكي. على عكس البوليمرات الأخرى ، مثل الحمض النووي ، الذي ترتبط عناصره المكونة معروابط تساهمية ، يتم تجميع مونومرات خيوط الأكتين بواسطة روابط أضعف. تحل الروابط الجانبية مع المونومرات المجاورة هذه الحالة الشاذة ، والتي من الناحية النظرية يجب أن تضعف الهيكل حيث يمكن كسرها عن طريق التحريض الحراري. بالإضافة إلى ذلك ، تمنح الروابط الضعيفة ميزة أن الأطراف الخيطية يمكنها بسهولة تحرير أو دمج المونومرات. وهذا يعني أنه يمكن إعادة تشكيل الخيوط بسرعة ويمكن أن تغير البنية الخلوية استجابةً لمحفز بيئي. التي ، جنبا إلى جنب مع الكيمياء الحيوية الآلية التي يتم بواسطتها تُعرف باسم "ديناميكية التجميع".
- دراسات في المختبر
يتم إجراء الدراسات التي تركز على تراكم وفقدان الوحدات الفرعية بواسطة الألياف الدقيقة في المختبر (أي في المختبر وليس على الأنظمة الخلوية) حيث تؤدي بلمرة الأكتين الناتج إلى نفس الأكتين F كما ينتج في الجسم الحي . و في الجسم الحي يتم التحكم العملية عن طريق العديد من البروتينات من أجل جعلها تستجيب لمطالب الخلوية، وهذا يجعل من الصعب مراقبة الأوضاع الأساسية.
يحدث الإنتاج في المختبر بطريقة متسلسلة:
أولاً ، هناك "مرحلة التنشيط" ، عندما يحدث الترابط وتبادل الكاتيونات ثنائية التكافؤ في أماكن محددة على G-actin ، المرتبط بـ ATP. ينتج عن ذلك تغيير في التوافق ، يُسمى أحيانًا مونومر G * -actin أو F-actin لأنه يشبه إلى حد بعيد الوحدات الموجودة على الفتيل. هذا يجهزها لـ "طور التنوي" ، حيث يؤدي الأكتين G إلى ظهور شظايا صغيرة غير مستقرة من F-actin تكون قادرة على البلمرة. يتم تشكيل الثنائيات والقواطع غير المستقرة في البداية. تبدأ "مرحلة الاستطالة" عندما يكون هناك عدد كبير بما فيه الكفاية من هذه البوليمرات القصيرة. في هذه المرحلة ، تتشكل الخيوط وتنمو بسرعة من خلال الإضافة القابلة للانعكاس لمونومرات جديدة في كلا الطرفين.أخيرًا ، يتم تحقيق توازن ثابت حيث يتم تبادل مونومرات G-actin عند طرفي الميكروفيلم دون أي تغيير في طوله الإجمالي. في هذه المرحلة الأخيرة ، يُعرَّف "التركيز الحرج C c " على أنه النسبة بين ثابت التجميع وثابت التفكك لـ G-actin ، حيث لا ينتج عن الديناميكية الخاصة بإضافة وإزالة الثنائيات والقواطع أي تغيير في طول الميكروفيلمنت. تحت في المختبر الظروف C ج هو 0.1 ميكرومتر،[36] وهو ما يعني أنه في حدوث ارتفاع قيم البلمرة وفي انخفاض قيم يحدث التحلل.
- دور التحلل المائي ATP
كما هو موضح أعلاه ، على الرغم من أن الأكتين يحلل ATP ، فإن كل شيء يشير إلى حقيقة أن ATP ليس مطلوبًا لتجميع الأكتين ، بالنظر إلى أنه من ناحية ، يحدث التحلل المائي بشكل أساسي داخل الشعيرة ، ومن ناحية أخرى يمكن لـ ADP أيضًا تحريض البلمرة. هذا يطرح السؤال عن فهم أي عملية غير مواتية للديناميكا الحرارية تتطلب مثل هذا الإنفاق الهائل للطاقة. تتكون دورة الأكتين ، التي تجمع بين التحلل المائي لـ ATP إلى بلمرة الأكتين ، من الإضافة التفضيلية لمونومرات G-actin-ATP إلى نهاية الشعيرة الشائكة ، والتفكيك المتزامن لمونومرات F-actin-ADP عند الطرف المدبب حيث يكون ADP لاحقًا تحولت إلى ATP ، وبالتالي إغلاق الدورة. يُعرف هذا الجانب من تكوين خيوط الأكتين "بالمطاحن".
يتحلل ATP بالماء بسرعة نسبيًا بعد إضافة مونومر G-actin إلى الفتيل. هناك نوعان من الفرضيات حول كيفية حدوث ذلك ؛ على مؤشر ستوكاستيك ، مما يوحي بأن التحلل عشوائيا يحدث بطريقة ما في بعض الطريق تتأثر جزيئات المجاورة؛ والمتجهية ، مما يشير إلى أن التحلل المائي يحدث فقط بجوار الجزيئات الأخرى التي تم تحلل ATP فيها بالفعل. في كلتا الحالتين ، لا يتم تحرير P iالناتج ؛ يبقى لبعض الوقت مرتبطًا بشكل غير تساهمي بـ ADP في أكتين. بهذه الطريقة توجد ثلاثة أنواع من الأكتين في الشعيرة: ATP- Actin و ADP + P i -Actin و ADP-Actin. تعتمد كمية كل نوع من هذه الأنواع الموجودة في خيوط على طوله وحالته: مع بدء الاستطالة ، يحتوي الخيط على كمية متساوية تقريبًا من مونومرات الأكتين المرتبطة بـ ATP و ADP + P i وكمية صغيرة من ADP-Actin عند (-) النهاية. عندما يتم الوصول إلى الحالة الثابتة ، ينعكس الموقف ، مع وجود ADP على طول غالبية الفتيل والمنطقة الأقرب للنهاية (+) التي تحتوي على ADP + P i ومع وجود ATP فقط عند الطرف.
إذا قارنا الخيوط التي تحتوي فقط على ADP-Actin مع تلك التي تتضمن ATP ، في السابق تكون الثوابت الحرجة متشابهة في كلا الطرفين ، بينما C c للنيوكليوتيدات الأخرى مختلفة: عند الطرف (+) Cc + = 0.1 μM ، بينما في الطرف (-) Cc - = 0.8 ميكرومتر ، مما يؤدي إلى المواقف التالية:
- بالنسبة لتركيزات G-actin-ATP أقل من Cc + لا يحدث استطالة في الفتيل.
- بالنسبة لتركيزات G-actin-ATP أقل من Cc - لكن الاستطالة أكبر من Cc + يحدث عند النهاية (+).
- بالنسبة لتركيزات G-actin-ATP الأكبر من Cc - ينمو الخيط الدقيق عند كلا الطرفين.
لذلك من الممكن استنتاج أن الطاقة الناتجة عن التحلل المائي تُستخدم لإنشاء "حالة ثابتة" حقيقية ، أي تدفق ، بدلاً من توازن بسيط ، ديناميكي ، قطبي ، ومتصل بالخيوط. هذا يبرر إنفاق الطاقة لأنه يعزز الوظائف البيولوجية الأساسية. بالإضافة إلى ذلك ، يتم الكشف عن تكوين أنواع المونومر المختلفة بواسطة بروتينات ربط الأكتين ، والتي تتحكم أيضًا في هذه الديناميكية ، كما سيتم وصفه في القسم التالي.
تم العثور على تشكيل الميكروفيلم عن طريق جهاز المشي ليكون غير نمطي في الستريوسيليا . في هذه الحالة ، يكون التحكم في حجم الهيكل قميًا تمامًا ويتم التحكم فيه بطريقة ما عن طريق التعبير الجيني ، أي من خلال الكمية الإجمالية لمونومر البروتين المركب في أي لحظة معينة.
البروتينات المرتبطة
لا يتكون الهيكل الخلوي للأكتين في الجسم الحي
حصريًا من الأكتين ، فالبروتينات الأخرى مطلوبة لتكوينه واستمراريته ووظيفته. تسمى هذه البروتينات بروتيناتربط الأكتين (ABP) وهي تشارك في بلمرة الأكتين ، وإزالة البلمرة ، والاستقرار ، والتنظيم في حزم أو شبكات ، والتجزئة ، والتدمير. تنوع هذه البروتينات يُعتقد أن الأكتين هو البروتين الذي يشارك في أكبر عدد من تفاعلات البروتين والبروتين . على سبيل المثال ، توجد عناصر عزل G-actin التي تعيق دمجها في الميكروفيلامين. هناك أيضًا بروتينات تحفز البلمرة أو تعطي تعقيدًا لشبكات التركيب.
- Thymosin β-4 هو بروتين 5 كيلو دالتون يمكن أن يرتبط بـ G-actin-ATP في 1: 1 متكافئ . مما يعني أن وحدة واحدة من ثيموسين β-4 ترتبط بوحدة واحدة من G-actin. يتمثل دوره في إعاقة دمج المونومرات في البوليمر المتنامي.
- Profilin ، هو بروتين عصاري خلوي بوزن جزيئي 15 كيلو دالتون ، والذي يرتبط أيضًا بـ G-actin-ATP أو -ADP بقياس متكافئ 1: 1 ، ولكن له وظيفة مختلفة لأنه يسهل استبدال نيوكليوتيدات ADP بواسطة ATP . كما أنه متورط في وظائف خلوية أخرى ، مثل ربط تكرارالبرولين في البروتينات الأخرى أو الدهون التي تعمل بمثابة رسل ثانوي . تقوم البروتينات الأخرى التي ترتبط بالأكتين بتنظيم طول الألياف الدقيقة عن طريق قطعها ، مما يؤدي إلى ظهور نهايات نشطة جديدة للبلمرة. على سبيل المثال ، إذا تم قطع خيوط دقيقة ذات نهايتين مرتين ، فسيكون هناك ثلاثة خيوط دقيقة جديدة بستة أطراف. هذا الوضع الجديد يفضل ديناميكيات التجميع والتفكيك. ولعل أبرز هذه البروتينات هي gelsolin و cofilin . هذه البروتينات أولا تحقيق خفض ملزمة لمونومر الأكتين تقع في البوليمر أنها ثم تغيير مونومر الأكتين في التشكل في حين تبقى منضمة إلى نهاية (+) التي تم إنشاؤها حديثا. هذا له تأثير في إعاقة إضافة أو تبادل وحدات فرعية جديدة من G-actin. يتم تشجيع إزالة البلمرة حيث أن النهايات (-) غير مرتبطة بأي جزيء آخر.
تغطي البروتينات الأخرى التي ترتبط مع الأكتين أطراف F-actin من أجل تثبيتها ، لكنها غير قادرة على كسرها. أمثلة على هذا النوع من البروتين هي CapZ ، والتي تربط النهايات (+) اعتمادًا على مستويات الخلية من Ca 2+ / calodulin . تعتمد هذه المستويات على الإشارات الداخلية والخارجية للخلية وتشارك في تنظيم وظائفها البيولوجية). مثال آخر هو تروبومودولين (الذي يرتبط بالنهاية (-)). Tropomodulin في الأساس يعمل على استقرار F-الأكتين موجودة في اللييفات العضلية تقدم في العضلات ساركومير ، وهي الهياكل التي تتميز استقرارها كبير.
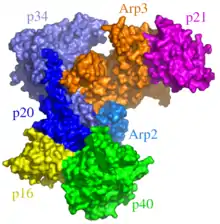
تم العثور على مجمع Arp2 / 3 على نطاق واسع في جميعالكائنات حقيقية النواة . وتتكون من سبع وحدات فرعية ، بعضها يمتلك طوبولوجيا ترتبط بوضوح بوظيفتها البيولوجية: اثنتان من الوحدات الفرعية ، ARP2 و ARP3 ، لها بنية مشابهة لمونومرات الأكتين. يسمح هذا التناظر لكلا الوحدتين بالعمل كعوامل تنوي في بلمرة G-actin و F-actin. هذا المركب مطلوب أيضًا في عمليات أكثر تعقيدًا مثل إنشاء الهياكل التغصنية وأيضًا في التفاغر (إعادة توصيل بنيتين متفرعتين تم ربطهما سابقًا ، مثل الأوعية الدموية). [39]
مثبطات كيميائية
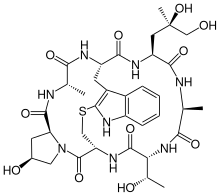
وهناك عدد من السموم التي تتداخل مع ديناميات الأكتين، وإما عن طريق منعه من البلمرة[40] ( latrunculin و مثبط حركة الخلايا D ) أو عن طريق تثبيت ذلك ( phalloidin ):
- Latrunculin هو مادة سامة تنتج عن الإسفنج . يرتبط بـ G-actin ويمنعه من الارتباط بالألياف الدقيقة.
- Cytocalasin D ، هو قلويد تنتجه الفطريات ، والذي يرتبط بنهاية (+) من F-actin مما يمنع إضافة مونومرات جديدة.[41] تم العثور على Cytocalasin D لتعطيل ديناميكيات الأكتين ، وتنشيط البروتين p53 في الحيوانات. [42]
- Phalloidin ، هو سم تم عزله من فطر قبعة الموت Amanita phalloides . إنه يرتبط بالواجهة بين مونومرات الأكتين المجاورة في بوليمر F-actin ، مما يمنع إزالة البلمرة. [43]
الوظائف والموقع
تشكل خيوط الأكتين ("F-actin" أو الخيوط الدقيقة ) عناصر أساسية في الهيكل الخلوي حقيقية النواة ، قادرة على الخضوع لديناميكيات البلمرة وإزالة البلمرة بسرعة كبيرة. تشكل خيوط الأكتين في معظم الخلايا شبكات واسعة النطاق والتي تعد ضرورية للعديد من الوظائف الرئيسية في الخلايا:[44]
- توفر أنواع مختلفة من شبكات الأكتين (المصنوعة من خيوط الأكتين) الدعم الميكانيكي للخلايا ، وتوفر طرقًا للتهريب عبر السيتوبلازم للمساعدة في نقل الإشارة.
- يتيح التجميع والتفكيك السريع لشبكة الأكتين للخلايا إمكانية الترحيل (ترحيل الخلية ).
- في خلايا العضلات الميتازوان ، تكون الدعامة التي تولد عليها بروتينات الميوسين القوة لدعم تقلص العضلات.
- في الخلايا غير العضلية ، يجب أن يكون مسار نقل البضائع الميوسينات (الميوسينات غير التقليدية) مثل الميوسين الخامس والسادس. تستخدم الميوسينات غير التقليدية التحلل المائي ATP لنقل البضائع ، مثلالحويصلات والعضيات ، بطريقة موجهة أسرع بكثير من الانتشار. يسير Myosin V باتجاه النهاية الشائكة لخيوط الأكتين ، بينما يسير الميوسين السادس باتجاه النهاية المدببة. يتم ترتيب معظم خيوط الأكتين مع الطرف الشائك باتجاه الغشاء الخلوي والنهاية المدببة باتجاه الداخل الخلوي. يسمح هذا الترتيب للميوسين V بأن يكون محركًا فعالاً لتصدير الشحنات ، وأن يكون الميوسين السادس محركًا فعالاً للاستيراد.
تم العثور على بروتين الأكتين في كل من السيتوبلازم والنواة خلية . يتم تنظيم موقعه عن طريق مسارات تحويل إشارة غشاء الخلية التي تدمج المحفزات التي تتلقاها الخلية لتحفيز إعادة هيكلة شبكات الأكتين استجابةً لذلك. في Dictyostelium ، تم العثور على phospholipase D للتدخل في مسارات فوسفات الإينوزيتول. خيوط الأكتين مستقرة بشكل خاص ووفرة في ألياف العضلات . داخل قسيم عضلي(الوحدة المورفولوجية والفسيولوجية الأساسية لألياف العضلات) الأكتين موجود في كل من العصابات I و A ؛ الميوسين موجود أيضًا في الأخير.[45]
الهيكل الخلوي
تشارك الألياف الدقيقة في حركة جميع الخلايا المتنقلة ،
بما في ذلك الأنواع غير العضلية [46][47] والأدوية التي تعطل تنظيم F-actin (مثل السيتوكالاسين ) تؤثر على نشاط هذه الخلايا. يشكل الأكتين 2٪ من إجمالي كمية البروتينات في خلايا الكبد ، و 10٪ في الخلايا الليفية ، و 15٪ فيالأميبات ، وما يصل إلى 50-80٪ في الصفائح الدموية المنشطة .[48] هناك عدد من الأنواع المختلفة من الأكتين ذات الهياكل والوظائف المختلفة قليلاً. هذا يعني أن الأكتين موجود حصريًا في ألياف العضلات، بينما توجد الأنواع β و في خلايا أخرى. بالإضافة إلى ذلك ، نظرًا لأن الأنواع الأخيرة لديها معدل دوران مرتفع ، فإن الغالبية منها توجد خارج الهياكل الدائمة. هذا يعني أن الميكروفيلامين الموجود في الخلايا غير الخلايا العضلية موجود في ثلاثة أشكال: [49]
- شبكات الميكروفيلمنت - عادة ما تحتوي الخلايا الحيوانية على قشرة خلوية تحت غشاء الخلية تحتوي على عدد كبير من الخيوط الدقيقة ، مما يحول دون وجود العضيات . هذه الشبكة متصلة بالعديد من خلايا المستقبل التي تنقل الإشارات إلى خارج الخلية.
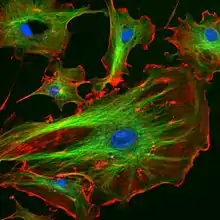
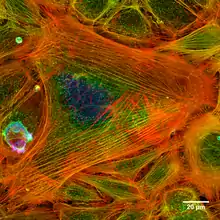 كومة مدمجة من الصور (كنفوكل) تظهر خيوط الأكتين داخل الخلية. تم ترميز الصورة بالألوان في المحور z لتظهر في صورة ثنائية الأبعاد بارتفاعات يمكن العثور عليها داخل الخلايا.
كومة مدمجة من الصور (كنفوكل) تظهر خيوط الأكتين داخل الخلية. تم ترميز الصورة بالألوان في المحور z لتظهر في صورة ثنائية الأبعاد بارتفاعات يمكن العثور عليها داخل الخلايا.
كومة مدمجة من الصور (كنفوكل) تظهر خيوط الأكتين داخل الخلية. تم ترميز الصورة بالألوان في المحور z لتظهر في صورة ثنائية الأبعاد بارتفاعات يمكن العثور عليها داخل الخلايا.
- حزم الميكروفيلمنت - توجد هذه الألياف الدقيقة الطويلة للغاية في شبكات ، وبالاقتران مع بروتينات مقلصة مثل الميوسين غير العضلي ، فهي تشارك في حركة المواد على مستوى الخلايا.
- حلقات الأكتين الدورية - تم العثور مؤخرًا على بنية دورية مبنية من حلقات أكتين متباعدة بشكل متساوٍ على وجه التحديد في المحاور (وليس التشعبات ).[50] في هذا الهيكل، وحلقات الأكتين، جنبا إلى جنب مع إسبكترن tetramers التي تصل المجاورة الأكتين الخواتم، وتشكيل متماسك الهيكل الخلوي التي تدعم غشاء محور عصبي. قد تنظم دورية الهيكل أيضًا قنوات أيونات الصوديوم في المحاور.
الخميرة
الهيكل الخلوي الأكتين هو المفتاح لعمليات الإلتقام ،السيتوبلازمي ، وتحديد قطبية الخلايا والتشكل فيالخمائر . بالإضافة إلى الاعتماد على الأكتين ، تشتمل هذه العمليات على 20 أو 30 بروتينًا مرتبطًا ، والتي تتمتع جميعها بدرجة عالية من الحفظ التطوري ، إلى جانب العديد من جزيئات الإشارة. تسمح هذه العناصر معًا بتجميع مُعدَّل مكانيًا وزمنيًا يحدد استجابة الخلية لكل من المحفزات الداخلية والخارجية. [51]
تحتوي الخميرة على ثلاثة عناصر رئيسية مرتبطة بالأكتين: البقع والكابلات والحلقات التي ، على الرغم من عدم وجودها لفترة طويلة ، تخضع لتوازن ديناميكي بسبب البلمرة المستمرة وإزالة البلمرة. لديهم عدد من البروتينات الملحقة بما في ذلك ADF / cofilin ، الذي يبلغ وزنه الجزيئي 16 كيلو دالتون ويتم ترميزه بواسطة جين واحد يسمى COF1 ؛ Aip1 ، عامل مساعد cofilin يعزز تفكيك الخيوط الدقيقة ؛ Srv2 / CAP ، منظم عملية متعلق ببروتينات محلقة أدينيلات ؛ بروفيلين بوزن جزيئي يقارب 14 كيلو دالتون يرتبط / يرتبط بمونومرات الأكتين ؛ و twinfilin ، وهو بروتين 40 كيلو دالتون يشارك في تنظيم البقع. [51]
النباتات
كشفت دراسات الجينوم النباتي عن وجود متغيرات البروتين داخل عائلة جينات الأكتين. داخل Arabidopsis thaliana ، وهو ثنائي الفلقة يستخدم ككائن نموذجي ، هناك عشرة أنواع من الأكتين ، وتسعة أنواع من α-tubulins ، وستة-tubulins ، وستة بروفيلن ، وعشرات من الميوسينات. يتم تفسير هذا التنوع من خلال الضرورة التطورية لامتلاك متغيرات تختلف قليلاً في تعبيرها الزمني والمكاني. تم التعبير عن غالبية هذه البروتينات بشكل مشترك في الأنسجة التي تم تحليلها. يتم توزيع شبكات الأكتين في جميع أنحاء سيتوبلازم الخلايا التي تمت زراعتها في المختبر. يوجد تركيز للشبكة حول النواة متصل بالقشرة الخلوية عبر مكبرات الصوت ، وهذه الشبكة ديناميكية للغاية ، مع بلمرة مستمرة وإزالة البلمرة. [52]
على الرغم من أن غالبية الخلايا النباتية لها جدار خلوييحدد شكلها ويعيق حركتها ، يمكن أن تولد أليافها الدقيقة قوة كافية لتحقيق عدد من الأنشطة الخلوية ، مثل التيارات السيتوبلازمية الناتجة عن الألياف الدقيقة والميوسين. يشارك الأكتين أيضًا في حركة العضيات والتكوين الخلوي ، والذي يتضمن انقسام الخلية بالإضافة إلى استطالة وتمايز الخلية.
من أبرز البروتينات المرتبطة بهيكل خلوي الأكتين في النباتات: فيلين ، الذي ينتمي إلى نفس عائلة جيلسولين/ سيفرين ، وهو قادر على قطع الألياف الدقيقة وربط مونومرات الأكتين في وجود كاتيونات الكالسيوم ؛ فيمبرين، القادر على التعرف على مونومرات الأكتين وتوحيدها والذي يشارك في تكوين الشبكات (من خلال عملية تنظيم مختلفة عن تلك الخاصة بالحيوانات والخمائر) ؛ [53]الفورمينات ، القادرة على العمل كعامل نواة لبلمرة أكتين F ؛الميوسين ، محرك جزيئي نموذجي خاص بحقيقيات النوى والذي يوجد في Arabidopsis thalianaيتم ترميزه بواسطة 17 جينًا في فئتين متميزتين ؛ CHUP1 ، الذي يمكنه ربط الأكتين ومتورط في التوزيع المكاني للبلاستيدات الخضراء في الخلية ؛ KAM1 / MUR3 التي تحدد مورفولوجيا جهاز جولجي وكذلك تكوينالزيلوغلوكان في جدار الخلية ؛ NtWLIM1 ، مما يسهل ظهور هياكل خلايا الأكتين ؛ و ERD10 ، الذي يشارك في ارتباط العضيات داخل الأغشية والخيوط الدقيقة والذي يبدو أنه يلعب دورًا يشارك في تفاعل الكائن الحي مع الإجهاد .
الأكتين النووي
تمت ملاحظة الأكتين النووي ووصفه لأول مرة في عام 1977 من قبل كلارك وميريام. [54] يصف المؤلفون بروتينًا موجودًا في الجزء النووي ، تم الحصول عليه من البويضاتXenopus laevis ، والذي يُظهر نفس ميزات الأكتين العضلي الهيكلي. منذ ذلك الوقت ، كان هناك العديد من التقارير العلمية حول بنية ووظائف الأكتين في النواة (للمراجعة ، انظر: Hofmann 2009. ) مستوى الأكتين الخاضع للرقابة في النواة ، وتفاعله مع بروتينات ربط الأكتين (ABP) ويسمح وجود الأشكال الإسوية المختلفة للأكتين بلعب دور مهم في العديد من العمليات النووية المهمة.
نقل الأكتين عبر الغشاء النووي
لا يحتوي تسلسل الأكتين على إشارة توطين نووية. يسمح الحجم الصغير للأكتين (حوالي 43 كيلو دالتون) بدخول النواة عن طريق الانتشار السلبي. [55] لكن الأكتين ينتقل بين السيتوبلازم والنواة بسرعة كبيرة ، مما يشير إلى وجود نقل نشط. يتم تسهيل استيراد الأكتين إلى النواة (ربما في مجمع مع cofilin) عن طريق استيراد البروتين 9.
يبدو أن انخفاض مستوى الأكتين في النواة مهم للغاية ، لأن الأكتين يحتوي على إشارتين للتصدير النووي (NES) في تسلسله. تتم إزالة الأكتين المجهري بسرعة من النواة إلى السيتوبلازم. يتم تصدير الأكتين بطريقتين على الأقل ، من خلال التصدير 1 (EXP1) والتصدير في 6 (Exp6). [56]
تسمح تعديلات محددة ، مثل SUMOylation ، بالاحتفاظ بالأكتين النووي. تم إثبات أن الطفرة التي تمنع ارتباط SUMOylation تؤدي إلى تصدير سريع لبيتا أكتين من النواة.
بناءً على النتائج التجريبية ، يمكن اقتراح آلية عامة لنقل الأكتين النووي: [57]
- في السيتوبلازم cofilin ربط مونومرات ADP-actin. يتم استيراد هذا المجمع بنشاط إلى النواة.
- يعزز التركيز العالي لـ ATP في النواة (مقارنة بالسيتوبلازم) ADP إلى تبادل ATP في مجمع الأكتين-كوفيلين. هذا يضعف قوة ارتباط هذين البروتينين.
- يتفكك مجمع Cofilin-actin أخيرًا بعد الفسفرة cofilin بواسطة LIM كيناز النووي.
- الأكتين هو SUMOylated وفي هذا الشكل يتم الاحتفاظ به داخل النواة.
- يمكن أن يشكل الأكتين معقدات مع البروفيلين ويترك النواة عبر التصدير 6.
تنظيم الأكتين النووي
يوجد الأكتين النووي بشكل أساسي كمونومر ، ولكن يمكنه أيضًا تكوين أوليغومرات ديناميكية وبوليمرات قصيرة. [58]يختلف تنظيم الأكتين النووي باختلاف أنواع الخلايا. على سبيل المثال ، في البويضات Xenopus(مع مستوى أكتين نووي أعلى مقارنة بالخلايا الجسدية) يشكل الأكتين خيوطًا ، والتي تعمل على استقرار بنية النواة. يمكن ملاحظة هذه الخيوط تحت المجهر بفضل تلطيخ phalloidin المترافق بالفلوروفور. [54]
ومع ذلك ، في نوى الخلايا الجسدية ، لا يمكن ملاحظة خيوط الأكتين باستخدام هذه التقنية. كشف اختبار تثبيط DNase I ، وهو الاختبار الوحيد حتى الآن الذي يسمح بتحديد كمية الأكتين المبلمر مباشرة في العينات البيولوجية ، أن الأكتين النووي الداخلي يحدث بالفعل بشكل أحادي. [58]
مستوى الأكتين الذي يتم التحكم فيه بدقة في نواة الخلية ، أقل مما هو عليه في السيتوبلازم ، يمنع تكوين الشعيرات. يتم تقليل البلمرة أيضًا من خلال الوصول المحدود إلى مونومرات الأكتين ، والتي ترتبط في مجمعات مع ABPs ، بشكل أساسي cofilin.
الأشكال الإسوية للأكتين في نواة الخلية
يتم إيلاء القليل من الاهتمام للأشكال الإسوية للأكتين ؛ ومع ذلك ، فقد ثبت وجود أشكال مختلفة من الأكتين في نواة الخلية. على الرغم من التشابه العالي في التسلسل ، فإن الأشكال الإسوية للأكتين لها خصائص كيميائية حيوية مختلفة مثل البلمرة وإزالة البلمرة الحركية. كما أنها تُظهر توطين ووظائف مختلفة.
قد يتغير مستوى الأشكال الإسوية للأكتين ، في كل من السيتوبلازم والنواة ، على سبيل المثال استجابة لتحفيز نمو الخلية أو توقف الانتشار ونشاط النسخ.
عادة ما تركز المخاوف البحثية حول الأكتين النووي على الشكل الإسوي بيتا[59]. ومع ذلك ، فإن استخدام الأجسام المضادة الموجهة ضد الأشكال الإسوية المختلفة للأكتين يسمح بتحديد ليس فقط بيتا السيتوبلازمي في نواة الخلية ، ولكن أيضًا:
- جاما أكتين في نواة خلية سرطان الجلد البشري
- أكتين عضلات الهيكل العظمي ألفا في نوى الخلايا العضلية للفأر
- أكتين جاما السيتوبلازمي وأيضًا أكتين العضلات الملساء ألفا في نواة الأرومة الليفية للفأر الجنيني
قد يكون لوجود أشكال مختلفة من الأكتين تأثير كبير على وظيفتها في العمليات النووية ، خاصةً لأنه يمكن التحكم في مستوى الأشكال الإسوية الفردية بشكل مستقل.
وظائف الأكتين النووية
.ترتبط وظائف الأكتين في النواة بقدرتها على البلمرة والتفاعل مع مجموعة متنوعة من ABPs ومع العناصر الهيكلية للنواة. يشارك الأكتين النووي في:
- بنية النواة - يعتبر تفاعل الأكتين مع alpha II-Spectrin والبروتينات الأخرى أمرًا مهمًا للحفاظ على الشكل المناسب للنواة.
- النسخ - يشارك أكتين في إعادة تنظيم الكروماتين ، بدء النسخ والتفاعل مع مجمع النسخ. يشارك الأكتين في تنظيم بنية الكروماتين ، يتفاعل مع بوليميريز الحمض النووي الريبي الأول ، الثاني والثالث. في نسخ Pol I ، يعمل الأكتين والميوسين ( MYO1C ، الذي يربط الحمض النووي) كمحرك جزيئي. بالنسبة لنسخ Pol II ، فإن β-actin ضروري لتشكيل معقد preinitiation. يحتوي Pol III على β-actin كوحدة فرعية. يمكن أن يكون الأكتين أيضًا أحد مكونات مجمعات إعادة تشكيل الكروماتين بالإضافة إلى جزيئات ما قبل mRNP (أي ، RNA السلائف المجمعة في البروتينات) ، ويشارك في التصدير النووي لـ RNAs والبروتينات.
- تنظيم نشاط الجينات - الأكتين يرتبط بالمناطق التنظيمية لأنواع مختلفة من الجينات. قدرة الأكتين على تنظيم نشاط الجينات في طريقة إعادة البرمجة الجزيئية ، والتي تسمح للخلايا المتمايزة بالعودة إلى حالتها الجنينية.
- إزاحة جزء الكروموسوم المنشط من منطقة الغشاء إلى كروماتين حقيقي حيث يبدأ النسخ. تتطلب هذه الحركة تفاعل الأكتين والميوسين.
- تكامل الأجزاء الخلوية المختلفة . الأكتين هو جزيء يدمج مسارات تحويل الإشارات السيتوبلازمية والنووية. مثال على ذلك هو تنشيط النسخ استجابة لتحفيز المصل للخلايا في المختبر .
- الاستجابة المناعية - يتبلمر الأكتين النووي عند تحفيزمستقبل الخلايا التائية وهو ضروري للتعبير الخلوي وإنتاج الأجسام المضادة في الجسم الحي .
نظرًا لقدرته على الخضوع لتغييرات توافقية والتفاعل مع العديد من البروتينات ، يعمل الأكتين كمنظم لتكوين ونشاط مجمعات البروتين مثل مجمع النسخ.
انكماش العضلات
هيكل قسيم عضلي ، الوحدة المورفولوجية والوظيفية الأساسية للعضلات الهيكلية التي تحتوي على الأكتين
الخطوط العريضة لانقباض العضلات
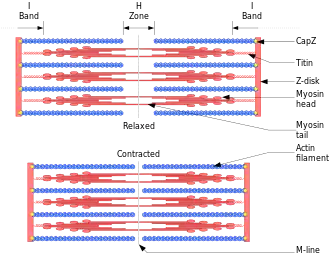
في خلايا العضلات، أكتوميوزين اللييفات العضلية تشكل الكثير من المواد هيولي. [60]تتكون هذه اللييفات العضلية منخيوط رفيعة من الأكتين (يبلغ قطرها عادة حوالي 7 نانومتر) ، وخيوط سميكة من بروتين الميوسين الحركي(عادة يبلغ قطره حوالي 15 نانومتر). [60]تستخدم اللييفات العضلية هذه الطاقة المشتقة من ATP لإنشاء حركات الخلايا ، مثل تقلص العضلات . باستخدام التحلل المائي لـ ATP للحصول على الطاقة ، تخضع رؤوس الميوسين لدورة تلتصق خلالها بالخيوط الرفيعة ، وتؤدي إلى شد ، وبعد ذلك ، اعتمادًا على الحمل ، تقوم بضربة كهربائية تتسبب في انزلاق الشعيرات الرقيقة إلى الماضي ، وتقصيرها عضلة.
في حزم مقلص، والبروتين تجميع الأكتين ألفا actininيفصل كل خيوط رقيقة من قبل ≈35 نانومتر. هذه الزيادة في المسافة تسمح للخيوط السميكة أن تتلاءم وتتفاعل ، مما يتيح التشوه أو الانكماش. في حالة التشوه ، يرتبط أحد طرفي الميوسين بغشاء البلازما ، بينما "يسير" الطرف الآخر باتجاه الطرف الزائد لخيوط الأكتين. يؤدي هذا إلى سحب الغشاء إلى شكل مختلف بالنسبة لقشرة الخلية. في حالة الانكماش ، يرتبط جزيء الميوسين عادةً بشيطين منفصلين و "يسير" كلا الطرفين في نفس الوقت باتجاه الطرف الزائد للخيوط ، مما يؤدي إلى تحريك خيوط الأكتين بالقرب من بعضها البعض. ينتج عن هذا تقصير أو تقلص حزمة الأكتين (ولكن ليس الفتيل). هذه الآلية مسؤولة عن تقلص العضلاتوالتحرك الخلوي ، وتقسيم خلية واحدة إلى خليتين.
دور أكتين في تقلص العضلات
تحتوي خيوط F-actin الحلزونية الموجودة في العضلات أيضًا على جزيء تروبوميوسين ، وهو بروتين يبلغ 40نانومترًا ملفوفًا حول حلزون F-actin. خلال مرحلة الراحة ، يغطي التروبوميوسين المواقع النشطة للأكتين بحيث لا يحدث تفاعل الأكتين والميوسين وينتج تقلصًا عضليًا (يؤدي التفاعل إلى حركة بين البروتينين الذي ينتج عنه تقلص ، لأنه يتكرر عدة مرات) . هناك جزيئات بروتينية أخرى منضمة إلى موضوع التروبوميوزين، وتشمل هذه troponins التي لديها ثلاثة البوليمرات: التروبونين I ، التروبونين T ، و تروبونين C . تعتمد الوظيفة التنظيمية لـ Tropomyosin على تفاعلها مع التروبونين في وجود أيونات Ca 2+ . [61]
يشارك كل من الأكتين والميوسين في تقلص العضلات واسترخاءها ويشكلان 90٪ من بروتين العضلات. [62] تبدأ العملية الكلية بإشارة خارجية ، عادة من خلال جهد فعليحفز العضلات ، والتي تحتوي على خلايا متخصصة تكون داخلها غنية بخيوط الأكتين والميوسين. تتكون دورة الانقباض والاسترخاء من الخطوات التالية:
- إزالة استقطاب غمد الليف العضلي وانتقال جهد الفعل من خلال الأنابيب التائية .
- فتح في شبكية الهيولى العضلية الصورة كا 2+القنوات.
- زيادة في عصاري خلوي كا 2+ تركيزات والتفاعل بين هذه الكاتيونات مع التروبونين مما تسبب في تغيير متعلق بتكوين في تقريرها هيكل . وهذا بدوره يغير بنية التروبوميوسين ، الذي يغطي الموقع النشط للأكتين ، مما يسمح بتكوين روابط متقاطعة للميوسين - أكتين (الأخير موجود كخيوط رفيعة).
- حركة رؤوس الميوسين فوق الخيوط الرقيقة ، يمكن أن تشمل ATP أو تكون مستقلة عن ATP. تتسبب الآلية السابقة ، التي يتوسط فيها نشاط ATPaseفي رؤوس الميوسين ، في حركة خيوط الأكتين نحو القرص Z-disc .
- Ca 2+ الالتقاط بواسطة الشبكة الساركوبلازمية ، مما يتسبب في تغيير توافقي جديد في التروبوميوسين الذي يثبط تفاعل الأكتين والميوسين. .[62]
عمليات بيولوجية أخرى
ترتبط الصورة التقليدية لوظيفة الأكتين بصيانة الهيكل
الخلوي ، وبالتالي تنظيم وحركة العضيات ، فضلاً عن تحديد شكل الخلية. ومع ذلك ، فإن الأكتين له دور أوسع في فسيولوجيا الخلايا حقيقية النواة ، بالإضافة إلى وظائف مماثلة في بدائيات النوى .
- الحركية الخلوية . يتضمن انقسام الخلايا في الخلايا الحيوانية والخمائر عادةً فصل الخلية الأم إلى خليتين ابنتيتين من خلال انقباض المحيط المركزي. تتضمن هذه العملية حلقة مقيدة تتكون من الأكتين والميوسين والأكتينين ألفا .[63] في الخميرة الانشطاريةSchizosaccharomyces pombe ، يتشكل الأكتين بنشاط في الحلقة الضيقة بمشاركة Arp3 ، و forminCdc12 ، و profilin ، و WASp ، جنبًا إلى جنب مع الألياف الدقيقة مسبقة التشكيل. بمجرد إنشاء الحلقة ، يتم الحفاظ على الهيكل من خلال التجميع والتفكيك المستمر بمساعدة Arp2 / 3المعقدة والفورمينات ، هو المفتاح لإحدى العمليات المركزية للحركة الخلوية. مجموع الحلقة المقلصة ، وجهاز المغزل ، والأنابيب الدقيقة ، والمواد المحيطية الكثيفة تسمى "الجسم الفليميني" أو "الجسم الوسيط".
- موت الخلايا المبرمج .[64] أثناء موت الخلية المبرمج ، تحلل عائلة البروتياز ICE / ced-3 (أحد بروتياز محول إنترلوكين -1 β) الأكتين إلى جزأين في الجسم الحي ؛إحدى الشظايا 15 كيلو دالتون والأخرى 31 كيلو دالتون.يمثل هذا إحدى الآليات التي تشارك في تدمير قابلية الخلية للحياة التي تشكل أساس موت الخلايا المبرمج. وقد ثبت أيضًا أن كالب البروتياز متورط في هذا النوع من تدمير الخلايا. تمامًا كما ثبت أن استخدام مثبطات الكالباين يقلل من تحلل بروتين الأكتين وتدهورالحمض النووي (عنصر آخر من العناصر المميزة للاستماتة). من ناحية أخرى ، فإن التوتريتسبب التسبب في موت الخلايا المبرمج في إعادة تنظيم الهيكل الخلوي للأكتين (والذي يتضمن أيضًا بلمرة ه) ، مما يؤدي إلى ظهور هياكل تسمى ألياف الإجهاد ؛ يتم تنشيط هذا عن طريق مسار كيناز MAP . [65]
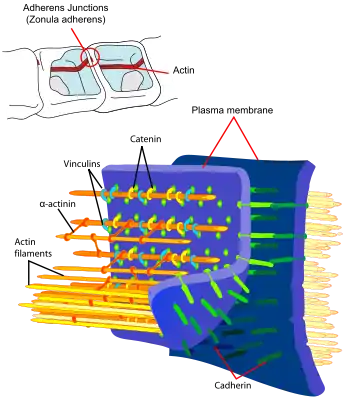
- التصاق الخلايا والتنمية . الالتصاق بين الخلايا هو سمةمن سمات الكائنات متعددة الخلايا التي تمكن الأنسجة التخصص وبالتالي يزيد من تعقيد الخلية. يتضمن التصاق الظهارة الخلوية الهيكل الخلوي الأكتيني في كل من الخلايا المرتبطة بالإضافة إلى الكاديرينات التي تعمل كعناصر خارج الخلية مع الاتصال بين الاثنين بوساطة الكاتينين . [66] للتدخل في ديناميكيات الأكتين تداعيات على تطور الكائن الحي ، في الواقع يعتبر الأكتين عنصرًا حاسمًا بحيث تتوفر أنظمة الجينات الزائدة عن الحاجة . على سبيل المثال ، إذا كانت α-actinin أودبق تمت إزالة عامل الجينات فيDictyostelium الأفراد لا تظهر الشاذ النمط الظاهري ربما يرجع ذلك إلى حقيقة أن كل من البروتينات يمكن أن تؤدي وظيفة أخرى. ومع ذلك ، فإن تطور الطفرات المزدوجة التي تفتقر إلى كلا النوعين من الجينات يتأثر. [67]
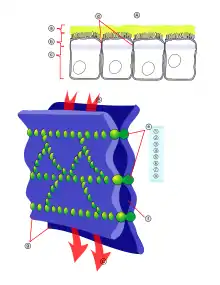 رسم تخطيطي لنطاق مغلق أو تقاطع ضيق ، وهو هيكل يربط بين ظهارة خليتين. الأكتين هو أحد عناصر التثبيت الموضحة باللون الأخضر.
رسم تخطيطي لنطاق مغلق أو تقاطع ضيق ، وهو هيكل يربط بين ظهارة خليتين. الأكتين هو أحد عناصر التثبيت الموضحة باللون الأخضر. - تعديل التعبير الجيني تؤثر حالة بلمرة أكتين على نمطالتعبير الجيني . في عام 1997 ، تم اكتشاف أن إزالة البلمرة التي تتم بوساطة السيتوكالاسين D في خلايا شوان تسبب نمطًا معينًا من التعبير عن الجينات المشاركة في عملية تكوّن النخاع في هذا النوع منالخلايا العصبية . ثبت أن F-actin يعدلالترنسكريبتوم في بعض مراحل حياة الكائنات وحيدة الخلية ، مثل فطر المبيضات البيض . بالإضافة إلى ذلك ، تلعب البروتينات المشابهة للأكتين دورًا تنظيميًا أثناء تكوين الحيوانات المنوية في الفئران وفي الخميرة ، يُعتقد أن البروتينات الشبيهة بالأكتين تلعب دورًا في تنظيم التعبير الجيني . في الواقع ، الأكتين قادر على العمل كبادئ للنسخ عندما يتفاعل مع نوع من الميوسين النووي الذي يتفاعل مع بوليميرات الحمض النووي الريبي والإنزيمات الأخرى المشاركة في عملية النسخ. [68]
- ديناميات ستريوسيليا . تقوم بعض الخلايا بتطوير نواتج حشوية دقيقة على سطحها لها وظيفة حسية ميكانيكية. على سبيل المثال ، هذا النوع من العضية موجود في عضو كورتي الموجود في الأذن . السمة الرئيسية لهذه الهياكل هي أنه يمكن تعديل طولها. تشتمل البنية الجزيئية للأشكال الفراغية على قلب أكتينباراكريستالين في توازن ديناميكي مع المونومرات الموجودة في العصارة الخلوية المجاورة. يوجد الميوسين من النوع السادس والسابع أ في جميع أنحاء هذا القلب ، بينما يوجد الميوسين XVa في أطرافه بكميات تتناسب مع طول الستريوسيليا.
- شرالية جوهرية . لقد تورطت شبكات الأكتوميوسين في توليد شرولية داخلية في الخلايا الفردية. يمكن[69]للخلايا التي تنمو على الأسطح اللولبية إظهار انحياز اتجاهي لليسار / لليمين يعتمد على الأكتوميوسين.
علم الأمراض الجزيئي
تمتلك غالبية الثدييات ستة جينات أكتين مختلفة . من بين هؤلاء ، هناك رمزان للهيكل الخلوي ( ACTB و ACTG1 ) في حين أن الأربعة الأخرى متورطة في العضلات المخططة الهيكلية ( ACTA1 ) ، وأنسجة العضلات الملساء ( ACTA2) ، وعضلات الأمعاء ( ACTG2 ) وعضلة القلب ( ACTC1). يشارك الأكتين الموجود في الهيكل الخلوي في الآلياتالمسببة للأمراض للعديد من العوامل المعدية ، بما في ذلكفيروس نقص المناعة البشرية . الغالبية العظمى منالطفراتالتي تؤثر على الأكتين هي طفرات نقطية لها تأثير مهيمن ، باستثناء ستة طفرات متضمنة في الاعتلال العضلي النيمالي. هذا لأنه في كثير من الحالات يعمل متحور مونومر الأكتين "كغطاء" عن طريق منع استطالة F-actin.
علم الأمراض المرتبط بـ ACTA1
ACTA1 هو الجين الذي يرمز لـ α- isoform من الأكتين السائد في العضلات المخططة للهيكل العظمي البشري، على الرغم من أنه يتم التعبير عنه أيضًا في عضلة القلب والغدة الدرقية . [73] لها تسلسل الحمض النووي يتكون من سبعة الإكسونات التي تنتج خمس المعروف النصوص . تتكون غالبية هذه الطفرات النقطية مما يؤدي إلى استبدالالأحماض الأمينية . ترتبط الطفرات في كثير من الحالات بنمط ظاهري يحدد شدة ومسار الإصابة. [74]
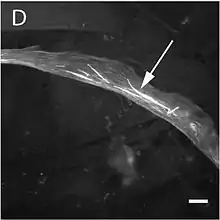
تغير الطفرة بنية ووظيفة عضلات الهيكل العظمي مما ينتج عنه أحد أشكال الاعتلال العضلي الثلاثة : اعتلال عضلي منالنوع الثالث ، اعتلال عضلي خلقي مع وجود فائض من الخيوط العضلية الرقيقة (CM) والاعتلال العضلي الخلقي مع عدم تناسق نوع الألياف (CMFTD). كما تم العثور على الطفرات التي تؤدي إلى اعتلال عضلي أساسي . على [75]الرغم من أن أنماطهم الظاهرية متشابهة ، إلا أن بعض المتخصصين ، بالإضافة إلى الاعتلال العضلي النمالي النموذجي ، يميزون نوعًا آخر من الاعتلال العضلي يسمى الاعتلال العضلي النيمالي الشعاعي. في السابق ، تتشكل كتل الأكتين بدلاً من القضبان النموذجية. من المهم الإشارة إلى أنه يمكن للمريض إظهار أكثر من واحد من هذه الأنماط الظاهرية في الخزعة. الأعراض الأكثر شيوعًا تتكون من شكل نموذجي للوجه ( الوجه العضلي ) وضعف عضلي وتأخر في النمو الحركي وصعوبات في التنفس. تم العثور على مسار المرض ، وخطورته ، والعمر الذي يظهر فيه كلها أشكال متغيرة ومتداخلة من اعتلال عضلي. من أعراض الاعتلال العضلي النيمالي ظهور "قضبان النيمالين" في أماكن مختلفة في ألياف العضلات من النوع الأول. هذه القضبان هي هياكل غير مرضية لها تركيبة مشابهة للأقراص Z الموجودة في قسيم عضلي . [76]
و المرضية من هذا عضلي متنوعة جدا. تحدث العديد من الطفرات في منطقة المسافة البادئة للأكتين بالقرب من مواقع الار.تباط بالنيوكليوتيدات ، بينما تحدث طفرات أخرى في المجال 2 ، أو في المناطق التي يحدث فيها التفاعل مع البروتينات المرتبطة. هذا يفسر بعض الطرق لشرح التنوع الكبير للكتل التي تتشكل في هذه الحالات ، مثل Nemaline أو الأجسام الداخلية أو الأجسام Zebra. التغييرات في الأكتين ل لطي تحدث في اعتلال عضلي خيطي فضلا عن التغيرات في تجميع وهناك أيضا تغييرات في التعبير من البروتينات الأخرى المرتبطة بها. في بعض المتغيرات حيث توجد الأجسام داخل النواة ، تخفي التغييرات في الطي إشارة تصدير البروتين في النواة بحيث يحدث تراكم شكل طفرة الأكتين في نواة الخلية . [77] من ناحية أخرى ، يبدو أن طفرات ACTA1 التي تؤدي إلى CFTDM لها تأثير أكبر على وظيفة قسيم عضلي أكثر من بنيتها. [78] حاولت التحقيقات الحديثة فهم هذا التناقض الظاهري ، مما يشير إلى عدم وجود علاقة واضحة بين عدد القضبان والضعف العضلي. يبدو أن بعض الطفرات قادرة ع.لى إحداث معدل موت الخلايا المبرمج أكبر في الألياف العضلية من النوع الثاني.
في العضلات الملساء
هناك نوعان من الأشكال الإسوية التي ترمز للأكتين في أنسجة العضلات الملساء :
أكواد ACTG2 لأكبر شكل إسوي أكتين ، والذي يحتوي على تسعة إكسونات ، أحدها ، الموجود في نهاية 5 ، غير مترجم. وهو أكتين بيتا يتم التعبير عنه في العضلة الملساء المعوية. لم يتم العثور على طفرات في هذا الجين تتوافق مع الأمراض ، على الرغم من أن المصفوفات الدقيقة أظهرت أن هذا البروتين يتم التعبير عنه في كثير من الأحيان في الحالات التي تقاوم العلاج الكيميائي باستخدام السيسبلاتين . [79]
أكواد ACTA2 لأكتين يقع في العضلات الملساء ، وكذلك في الأوعية الدموية الملساء. لقد لوحظ أن طفرة MYH11 يمكن أن تكون مسؤولة عن 14٪ على الأقل من حالات تمدد الأوعية الدموية الأبهري الصدري الوراثيوخاصة النوع 6. وذلك لأن المتغير المتحور ينتج مجموعة خيطية غير صحيحة وقدرة منخفضة على تقلص العضلات الملساء الوعائي. تدهور وسائل الإعلام الأبهر وقد سجلت في هؤلاء الأفراد، مع مناطق الفوضى وتضخم وكذلك تضيق في الشريان الأورطي والوعائية الأوعية . يتزايد عدد الآلام التي يتورط فيها الجين. لقد ارتبط بمرض موياموياويبدو من المرجح أن بعض الطفرات في تغاير الزيجوت يمكن أن تمنح الاستعداد للعديد من أمراض الأوعية الدموية ، مثل تمدد الأوعية الدموية الأبهري الصدري وأمراض القلب الإقفارية . الأكتين الموجود في العضلات الملساء هو أيضًا علامة مثيرة للاهتمام لتقييم تقدم تليف الكبد . [80]
في عضلة القلب
و ACTC1 رموز الجينات لα أكتين شكل الإسوي موجودة في عضلة القلب. تم تسلسله لأول مرة بواسطة حمادة وزملائه في عام 1982 ، عندما وجد أنه متقطع بخمس إنترونات. كان الأول من أصل ستة جينات حيث تم العثور على الأليلات المتورطة في العمليات المرضية.
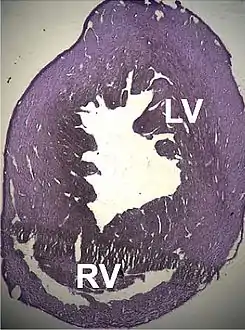
تم وصف عدد من الاضطرابات الهيكلية المرتبطة بالطفرات النقطية لهذا الجين والتي تسبب خللًا في عمل القلب ، مثلاعتلال عضلة القلب التوسعي من النوع 1R واعتلال عضلة القلب الضخامي من النوع 11 . تم وصف عيوب معينة في الحاجز الأذيني مؤخرًا والتي يمكن أيضًا أن تكون مرتبطة بهذه الطفرات. [82]
وقد تم دراسة حالتين من تمدد عضلة القلب التي تنطوي على استبدال غاية التمايز الأحماض الأمينية التي تنتمي إلى المجالات البروتين التي تربط وبعثر مع أقراص Z . وقد أدى ذلك إلى النظرية القائلة بأن التمدد ينتج عن خلل في انتقال القوة الانقباضية في الخلايا العضلية .
الطفرات في ACTC1 مسؤولة عن 5٪ على الأقل من اعتلال عضلة القلب الضخامي. كما تم العثور على عدد من الطفرات النقطية: [83]
- طفرة E101K: تغييرات في صافي الشحنة وتشكيل رابط إلكتروستاتيكي ضعيف في موقع ربط الأتوميوسين.
- P166A: منطقة التفاعل بين مونومرات الأكتين.
- A333P: منطقة تفاعل الأكتين والميوسين.
يبدو أن عملية التسبب في المرض تنطوي على آلية تعويضية: تعمل البروتينات الطافرة مثل السموم ذات التأثير المهيمن ، مما يقلل من قدرة القلب على الانقباض مسببة سلوكًا ميكانيكيًا غير طبيعي مثل أن يكون التضخم ، الذي يتأخر عادةً ، نتيجة لاستجابة عضلة القلب الطبيعية للإجهاد.
اكتشفت الدراسات الحديثة طفرات ACTC1 المتورطة في عمليتين مرضيتين أخريين: اعتلال عضلة القلب المقيدمجهول السبب عند الأطفال ، وعدم انضغاط عضلة القلب البطين الأيسر . [84]
في الأكتينات السيتوبلازمية
ACTB هو موضع معقد للغاية. يوجد عدد من الجينات الخادعة التي يتم توزيعها في جميع أنحاء الجينوم ، ويحتوي تسلسلها على ستة إكسونات يمكن أن تؤدي إلى ما يصل إلى 21 عملية نسخ مختلفة عن طريق التضفير البديل، والتي تُعرف باسم الأكتين. تمشيا مع هذا التعقيد ، توجد منتجاتها أيضًا في عدد من المواقع وتشكل جزءًا من مجموعة متنوعة من العمليات ( الهيكل الخلوي ،مجمع NuA4 هيستون - مركب ناقل أسيل ، نواة الخلية ) بالإضافة إلى أنها مرتبطة بآليات عدد كبير من العمليات المرضية ( السرطانات ، خلل التوتر العضلي عندالأحداثوآليات العدوى وتشوهات الجهاز العصبي وغزو الأورام وغيرها). تم اكتشاف شكل جديد من الأكتين ، وهو كابا أكتين ، والذي يبدو أنه يحل محل بيتا-أكتين في العمليات المتعلقة بالأورام .[85]
تم حتى الآن اكتشاف ثلاث عمليات مرضية ناتجة عن تغيير مباشر في تسلسل الجينات:
- ورم الخلايا الحولية مع تي (7 و 12) (P22؛ Q13) -translocations هو فتنة نادر، فيه طفرة translocational يتسبب في انصهار ACTB الجينات على GLI1 في كروموسوم 12 .
- يصيب الأحداث خلل التوتر هو نادر الأمراض التنكسية التي تؤثر على الجهاز العصبي المركزي . على وجه الخصوص، فإنه يؤثر على مناطق القشرة المخية الحديثة والمهاد ، حيث قضيب مثل الحمضة تتشكل الادراج. يمثل الأفراد المصابون نمطًا ظاهريًا مع تشوهات في الخط المتوسط وفقدان السمع الحسي وخلل التوتر العضلي. يحدث بسبب طفرة نقطية حيث يحلالتربتوفان الأحماض الأمينية محل الأرجينين في الموضع 183. هذا يغير تفاعل الأكتين مع نظام ADF / cofilin ، الذي ينظم ديناميات الخلية العصبية تشكيل الهيكل الخلوي.
- كما تم اكتشاف طفرة نقطية سائدة تسبب اختلال وظيفي للخلايا المحببة للعدلات والعدوى المتكررة . يبدو أن الطفرة تعدل المجال المسؤول عن الارتباط بين البروفيلين والبروتينات التنظيمية الأخرى. تقارب الأكتين للبروفيلين تقل بشكل كبير في هذا الأليل. [87]
و ACTG1 رموز مكان للعصاري خلوي البروتين γ-الأكتين هي المسؤولة عن تشكيل هيكل الخلية خيوط دقيقة .يحتوي على ستة إكسونات ، مما أدى إلى ظهور 22mRNAs مختلفة ، والتي تنتج أربعة أشكال إسوية كاملة يعتمد شكل تعبيرها على نوع النسيج الموجود فيها. كما أن لديها اثنين من محفزات الحمض النووي المختلفة . وقد لوحظ أن التسلسلات المترجمة من هذا الموضع ومن تسلسل بيتا-أكتين تشبه إلى حد بعيد تلك المتنبأ بها ، مما يشير إلى تسلسل سلف مشترك عانى من الازدواجية والتحويل الجيني.
من حيث علم الأمراض، وارتبط ذلك مع عمليات مثل الداء النشواني ، التهاب الشبكية الصباغي ، وآليات العدوى، والكلى الأمراض، وأنواع مختلفة من فقدان السمع الخلقية.
تم العثور على ستة طفرات نقطية سائدة في التسلسل تسبب أنواعًا مختلفة من فقدان السمع ، وخاصة فقدان السمع الحسي العصبي المرتبط بموضع DFNA 20/26.يبدو أنها تؤثر على الأهداب المجسمة للخلايا الهدبية الموجودة في عضو كورتي في الأذن الداخلية . -actin هو البروتين الأكثر وفرة في الأنسجة البشرية ، لكنه ليس بكثرة في الخلايا الهدبية ، مما يفسر موقع علم الأمراض. من ناحية أخرى ، يبدو أن غالبية هذه الطفرات تؤثر على المناطق المشاركة في الارتباط ببروتينات أخرى ، وخاصة الأكتوموسين. اقترحت بعض التجارب أن الآلية المرضية لهذا النوع من فقدان السمع تتعلق بـ F-actin في الطفرات التي تكون أكثر حساسية لـ cofilin من الطبيعي.
ومع ذلك ، على الرغم من عدم وجود سجل لأي حالة ، فمن المعروف أن الأكتين يتم التعبير عنه أيضًا في عضلات الهيكل العظمي ، وعلى الرغم من وجوده بكميات صغيرة ،فقد أظهرت الكائنات الحية النموذجية أن غيابه يمكن أن يؤدي إلى اعتلال عضلي. [88]
آليات مرضية أخرى
تستخدم بعض العوامل المعدية الأكتين ، وخاصة الأكتين السيتوبلازمي ، في دورة حياتها . يوجد شكلين أساسيين في البكتيريا :
- Listeria monocytogenes ، وبعض أنواع الريكتسيا ،والشيغيلا فليكسنري وغيرها من الجراثيم داخل الخلايا تهرب منفجوات البلعمة عن طريق تغليف نفسها بكبسولة من خيوط الأكتين. يولد كل من L. monocytogenesو S. flexneri ذيلًا على شكل "ذيل مذنب" يمنحهما القدرة على الحركة. يُظهر كل نوع اختلافات صغيرة في آلية البلمرة الجزيئية لـ "ذيول المذنب". وقد لوحظ السرعات التشريد مختلفة، على سبيل المثال، مع الليستيريا و الشيجلا جدت لتكون أسرع. أظهرت العديد من التجارب هذه الآلية في المختبر. يشير هذا إلى أن البكتيريا لا تستخدم محركًا بروتينيًا يشبه الميوسين ، ويبدو أن دفعها يتم الحصول عليه من الضغط الذي تمارسه البلمرة التي تحدث بالقرب من جدار خلية الكائن الدقيق. سبق يحيط البكتيريا عن طريق ABPs من المضيف، وكحد أدنى يحتوي على غطاء Arp2 / 3 معقدة ، إينا / VASP البروتينات ، cofilin، وهو بروتين التخزين المؤقت والتنوي المروجين، مثل فينكولين تعقيدا. من خلال هذه الحركات تشكل نتوءات تصل إلى الخلايا المجاورة وتصيبها أيضًا حتى لا يتمكنالجهاز المناعي من محاربة العدوى إلا من خلال مناعة الخلية. يمكن أن تكون الحركة ناتجة عن تعديل المنحنى وإزالة الشعيرات. الأنواع الأخرى ، مثل المتفطرة البحرية و Burkholderia pseudomallei ، قادرة أيضًا على بلمرة موضعية للأكتين الخلوي للمساعدة في حركتها من خلال آلية تتمحور حول مركب Arp2 / 3.بالإضافة إلى ذلك ،يستخدم فيروس اللقاح Vacciniaأيضًا عناصر من الهيكل الخلوي للأكتين لنشره. [89]
- الزائفة الزنجارية هي قادرة على تشكيل واقية بيوفيلم من أجل الهروب من الكائنات المضيفة دفاعات، وخاصة خلايا الدم البيضاء والمضادات الحيوية . يتكون البيوفيلم باستخدامخيوط الحمض النووي والأكتين من الكائن الحي المضيف.
بالإضافة إلى المثال المذكور سابقًا ، يتم تحفيز بلمرة الأكتين في الخطوات الأولية لاستيعاب بعض الفيروسات ، ولا سيما فيروس نقص المناعة البشرية ، عن طريق ، على سبيل المثال ، تعطيل مركب cofilin.
لم يتم بعد تحديد الدور الذي يلعبه الأكتين في عملية غزو الخلايا السرطانية. [90]
تطور
يحتوي الهيكل الخلوي حقيقي النواة للكائنات بين جميعالمجموعات التصنيفية على مكونات مماثلة للأكتين والتوبيولين. على سبيل المثال ، البروتين الذي تم ترميزه بواسطة جين ACTG2 في البشر يعادل تمامًا المتماثلات الموجودة في الجرذان والفئران ، على الرغم من أن التشابه على مستوى النوكليوتيدات ينخفض إلى 92٪. ومع ذلك، هناك اختلافات كبيرة مع حكمه في بدائيات النوى (بروتين زد و MreB )، حيث التشابه بين متواليات النوكليوتيدات ما بين 40-50٪ بين مختلف البكتيريا والعتائق محيط. يقترح بعض المؤلفين أن بروتين الأسلاف الذي أدى إلى ظهور الأكتين النموذجي حقيقي النواة يشبه البروتينات الموجودة في الهياكل الخلوية البكتيرية الحديثة.
يشير بعض المؤلفين إلى أن سلوك الأكتين والتوبيولينوالهيستون ، وهو بروتين يشارك في تثبيت وتنظيم الحمض النووي ، متشابه في قدرتها على ربط النيوكليوتيدات وقدرتها على الاستفادة من الحركة البراونية . كما تم اقتراح أن لديهم جميعًا سلف مشترك. لذلك، التطورية أسفرت العمليات في تنويع البروتينات الأجداد في أصناف موجودة اليوم، والمحافظة، من بين أمور أخرى، actins كما الجزيئات الفعالة التي كانت قادرة على معالجة العمليات البيولوجية الأجداد الأساسية، مثل الإلتقام . [92]
مكافئات في البكتيريا
و الهيكل الخلوي البكتيري قد لا تكون معقدة مثل تلك التي وجدت في حقيقيات النوى . ومع ذلك ، فإنه يحتوي على بروتينات تشبه إلى حد كبير مونومرات الأكتين والبوليمرات. يتبلمر البروتين البكتيري MreB في خيوط رقيقة غير حلزونية وأحيانًا في هياكل حلزونية مشابهة لـ F-actin. علاوة على ذلك ، فإن هيكله البلوري مشابه جدًا لهيكل G-actin (من حيث تشكيله ثلاثي الأبعاد) ، حتى أن هناك أوجه تشابه بين خيوط MreB الأولية و F-actin. يحتوي الهيكل الخلوي البكتيري أيضًا على بروتينات FtsZ ، والتي تشبه التوبولين . [93]
وبالتالي تمتلك البكتيريا على الهيكل الخلوي مع العناصر المتجانسة لالأكتين (على سبيل المثال، MreB، ألفا، بارم ، FtsA ، وMamK)، على الرغم من أن الأمينية تسلسل الحمض لهذه البروتينات يحيد عن تلك الموجودة في الخلايا الحيوانية. ومع ذلك ، فإن هذه البروتينات لديها درجة عالية من التشابه الهيكلي مع الأكتين حقيقيات النوى.تعتبر الأغشية الدقيقة عالية الديناميكية التي يتكون منها تجميع MreB و ParM ضرورية لحيوية الخلية وتشارك في تكوين الخلية ، وفصل الكروموسومات ، وقطبية الخلية. ParM هو متماثل أكتين يتم ترميزه في بلازميد ويشارك في تنظيم DNA البلازميد. يمكن أن تشكل ParMs من البلازميدات البكتيرية المختلفة هياكل حلزونية متنوعة بشكل مذهل تتكون من اثنين أو أربعة خيوط للحفاظ على الميراث البلازميد الأمين.
التطبيقات
يستخدم الأكتين في المختبرات العلمية والتكنولوجية كمسار للمحركات الجزيئية مثل الميوسين (سواء في الأنسجة العضلية أو خارجه) وكمكون ضروري للعمل الخلوي. يمكن أيضًا استخدامه كأداة تشخيصية ، حيث ترتبط العديد من المتغيرات الشاذة بظهور أمراض معينة.
- تقنية النانو . تعمل أنظمة أكتين-ميوسين كمحركات جزيئية تسمح بنقل الحويصلات والعضيات في جميع أنحاء السيتوبلازم. من الممكن تطبيق الأكتين على تكنولوجيا النانو حيث تم تسخير قدرته الديناميكية في عدد من التجارب بما في ذلك تلك التي أجريت في أنظمة لا خلوية. الفكرة الأساسية هي استخدام الميكروفيلامين كمسارات لتوجيه المحركات الجزيئية التي يمكنها نقل حمولة معينة. يمكن استخدام الأكتين لتحديد دائرة يمكن من خلالها نقل الحمولة بطريقة أكثر أو أقل تحكمًا وتوجيهًا. من حيث التطبيقات العامة ، يمكن استخدامه للنقل الموجه للجزيئات للإيداع في مواقع محددة ، مما يسمح بالتجميع المتحكم فيه للبنى النانوية.[94] يمكن تطبيق هذه السمات على العمليات المختبرية مثل المعامل على رقاقة ، وفي ميكانيكا المكونات النانوية وفي المحولات النانوية التي تحول الطاقة الميكانيكية إلى طاقة كهربائية.
- يستخدم الأكتين كعنصر تحكم داخلي في البقع الغربية للتأكد من أنه تم تحميل كميات متساوية من البروتين في كل ممر من الجل. في مثال اللطخة الموضح على الجانب الأيسر ، تم تحميل 75 ميكروغرام من البروتين الكلي في كل بئر. تم تفاعل اللطخة مع الجسم المضاد لـ β-actin (للحصول على تفاصيل أخرى عن اللطخة ، انظر المرجع [95] )
يعتمد استخدام الأكتين كعنصر تحكم داخلي على افتراض أن تعبيره ثابت عمليًا ومستقل عن الظروف التجريبية. من خلال مقارنة تعبير الجين المعني بتعبير الأكتين ، يمكن الحصول على كمية نسبية يمكن مقارنتها بين التجارب المختلفة ، عندما يكون التعبير عن الأخير ثابتًا. تجدر الإشارة إلى أن الأكتين لا يتمتع دائمًا بالاستقرار المطلوب في تعبيره الجيني . [96]
- الصحة. بعض أليلات الأكتين تسبب الأمراض. لهذا السبب تم تطوير تقنيات للكشف عنها. وبالإضافة إلى ذلك، الأكتين يمكن استخدام علامة غير مباشرة في الأمراض الجراحية: من الممكن استخدام الاختلافات في نمط توزيعه في الأنسجة كعلامة للغزو في الأورام ،التهاب الأوعية الدموية ، وغيرها من الشروط. علاوة على ذلك ، نظرًا لارتباط الأكتين الوثيق بجهاز الانقباض العضلي ، تقل مستوياته في العضلات الهيكلية عند ضمور هذه الأنسجة ، وبالتالي يمكن استخدامه كعلامة على هذه العملية الفسيولوجية.
- تكنولوجيا الغذاء . من الممكن تحديد جودة بعض الأطعمة المصنعة ، مثل النقانق ، عن طريق تحديد كمية الأكتين الموجودة في اللحوم المكونة. تقليديا ، تم استخدام طريقة تعتمد على اكتشاف 3-ميثيل هيستيدين في عينات متحللة مائيًا من هذه المنتجات ، حيث يوجد هذا المركب في السلسلة الثقيلة للأكتين و F-myosin (كلاهما مكونان رئيسيان للعضلات). الجيل من هذا المركب في يستمد الجسد من مثيلة من الحامض الاميني بقايا موجودة في كل من البروتينات.[97][98]
الجينات
تشمل الجينات البشرية التي تشفر بروتينات الأكتين ما يلي:
انظر أيضًا
مراجع
- online نسخة محفوظة 02 أبريل 2019 على موقع واي باك مشين.
- "Actin molecular structure and function". Current Opinion in Cell Biology. 5 (1): 41–7. Feb 1993. doi:10.1016/S0955-0674(05)80006-7. PMID 8448029. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The inter-ring arrangement of the cytosolic chaperonin CCT". EMBO Reports. 8 (3): 252–7. Mar 2007. doi:10.1038/sj.embor.7400894. PMC 1808031. PMID 17304242. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "On Muscle-Plasma". The Journal of Physiology. 8 (3–4): 133–202. Aug 1887. doi:10.1113/jphysiol.1887.sp000252. PMC 1485127. PMID 16991477. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Banga, Ilona (1942). Szent-Györgyi, Albert (المحرر). "Preparation and properties of myosin A and B." Studies from the Institute of Medical Chemistry University Szeged. 1941-1942. I: 5–15. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hanukogle, Israel; Tanese, Naoko; Fuchs, Elaine (1983-02-05). "Complementary DNA sequence of a human cytoplasmic actin: Interspecies Divergence of 3′ non-coding regions". Journal of Molecular Biology (باللغة الإنجليزية). 163 (4): 673–678. doi:10.1016/0022-2836(83)90117-1. ISSN 0022-2836. مؤرشف من الأصل في 5 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gunning, Peter W.; Ghoshdastider, Umesh; Whitaker, Shane; Popp, David; Robinson, Robert C. (2015-06-01). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science. 128 (11): 2009–2019. doi:10.1242/jcs.165563. ISSN 1477-9137. PMID 25788699. مؤرشف من الأصل في 18 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gunning, Peter W.; Ghoshdastider, Umesh; Whitaker, Shane; Popp, David; Robinson, Robert C. (2015-06-01). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science (باللغة الإنجليزية). 128 (11): 2009–2019. doi:10.1242/jcs.165563. ISSN 0021-9533. PMID 25788699. مؤرشف من الأصل في 30 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Marc (2002-02). Biologia Celular (باللغة الإسبانية). Elsevier España. ISBN 978-84-458-1105-4. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Ponte, P; Gunning, P; Blau, H; Kedes, L (1983-10). "Human actin genes are single copy for alpha-skeletal and alpha-cardiac actin but multicopy for beta- and gamma-cytoskeletal genes: 3' untranslated regions are isotype specific but are conserved in evolution". Molecular and Cellular Biology. 3 (10): 1783–1791. ISSN 0270-7306. PMID 6646124. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Book sources". Wikipedia (باللغة الإنجليزية). مؤرشف من الأصل في 7 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hara, Futoshi; Yamashiro, Kan; Nemoto, Naoki; Ohta, Yoshinori; Yokobori, Shin-ichi; Yasunaga, Takuo; Hisanaga, Shin-ichi; Yamagishi, Akihiko (2007-3). "An Actin Homolog of the Archaeon Thermoplasma acidophilum That Retains the Ancient Characteristics of Eukaryotic Actin". Journal of Bacteriology. 189 (5): 2039–2045. doi:10.1128/JB.01454-06. ISSN 0021-9193. PMID 17189356. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Graceffa, Philip; Dominguez, Roberto (2003-09-05). "Crystal Structure of Monomeric Actin in the ATP State STRUCTURAL BASIS OF NUCLEOTIDE-DEPENDENT ACTIN DYNAMICS". Journal of Biological Chemistry (باللغة الإنجليزية). 278 (36): 34172–34180. doi:10.1074/jbc.M303689200. ISSN 0021-9258. PMID 12813032. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Elzinga, Marshall; Collins, John H.; Kuehl, W. Michael; Adelstein, Robert S. (1973-09). "Complete Amino-Acid Sequence of Actin of Rabbit Skeletal Muscle". Proceedings of the National Academy of Sciences of the United States of America. 70 (9): 2687–2691. ISSN 0027-8424. PMID 4517681. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Collins, J. H.; Elzinga, M. (1975-08-10). "The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence". The Journal of Biological Chemistry. 250 (15): 5915–5920. ISSN 0021-9258. PMID 1150665. مؤرشف من الأصل في 6 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rould, Mark A.; Wan, Qun; Joel, Peteranne B.; Lowey, Susan; Trybus, Kathleen M. (2006-10-20). "Crystal Structures of Expressed Non-polymerizable Monomeric Actin in the ADP and ATP States". Journal of Biological Chemistry (باللغة الإنجليزية). 281 (42): 31909–31919. doi:10.1074/jbc.M601973200. ISSN 0021-9258. PMID 16920713. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Atomic model of the actin filament". Nature. 347 (6288): 44–49. Sep 1990. Bibcode:1990Natur.347...44H. doi:10.1038/347044a0. PMID 2395461. S2CID 4317981. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thomas M. (2004). Bioquímica. Con aplicaciones clínicas (باللغة الإسبانية). Reverte. ISBN 978-84-291-7208-9. مؤرشف من الأصل في 3 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - von der Ecken, Julian; Müller, Mirco; Lehman, William; Manstein, Dietmar J.; Penczek, Pawel A.; Raunser, Stefan (2015-03-05). "Structure of the F–actin–tropomyosin complex". Nature. 519 (7541): 114–117. doi:10.1038/nature14033. ISSN 0028-0836. PMID 25470062. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Reisler, Emil; Egelman, Edward H. (2007-12-14). "Actin Structure and Function: What We Still Do Not Understand". Journal of Biological Chemistry (باللغة الإنجليزية). 282 (50): 36133–36137. doi:10.1074/jbc.R700030200. ISSN 0021-9258. PMID 17965017. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Oda, Toshiro; Iwasa, Mitsusada; Aihara, Tomoki; Maéda, Yuichiro; Narita, Akihiro (2009-01). "The nature of the globular- to fibrous-actin transition". Nature (باللغة الإنجليزية). 457 (7228): 441–445. doi:10.1038/nature07685. ISSN 0028-0836. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments". The Journal of Cell Biology. 79 (3): 846–852. 1978-12-01. ISSN 0021-9525. PMID 569662. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Arthur C.; Hall, John E. (John Edward) (2006). Textbook of medical physiology. Philadelphia : Elsevier Saunders. ISBN 978-0-7216-0240-0. مؤرشف من الأصل في 31 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Selective contribution of eukaryotic prefoldin subunits to actin and tubulin binding". The Journal of Biological Chemistry. 279 (6): 4196–4203. Feb 2004. doi:10.1074/jbc.M306053200. PMID 14634002. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Martín-Benito, Jaime; Boskovic, Jasminka; Gómez-Puertas, Paulino; Carrascosa, José L.; Simons, C.Torrey; Lewis, Sally A.; Bartolini, Francesca; Cowan, Nicholas J.; Valpuesta, José M. (2002-12-02). "Structure of eukaryotic prefoldin and of its complexes with unfolded actin and the cytosolic chaperonin CCT". The EMBO Journal. 21 (23): 6377–6386. doi:10.1093/emboj/cdf640. ISSN 0261-4189. PMID 12456645. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brackley, Karen I.; Grantham, Julie (2009-1). "Activities of the chaperonin containing TCP-1 (CCT): implications for cell cycle progression and cytoskeletal organisation". Cell Stress & Chaperones. 14 (1): 23–31. doi:10.1007/s12192-008-0057-x. ISSN 1355-8145. PMID 18595008. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Stirling, Peter C.; Cuéllar, Jorge; Alfaro, Gabriel A.; Khadali, Fatima El; Beh, Christopher T.; Valpuesta, José M.; Melki, Ronald; Leroux, Michel R. (2006-03-17). "PhLP3 Modulates CCT-mediated Actin and Tubulin Folding via Ternary Complexes with Substrates". Journal of Biological Chemistry (باللغة الإنجليزية). 281 (11): 7012–7021. doi:10.1074/jbc.M513235200. ISSN 0021-9258. PMID 16415341. مؤرشف من الأصل في 11 سبتمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hansen, William J.; Cowan, Nicholas J.; Welch, William J. (1999-04-19). "Prefoldin–Nascent Chain Complexes in the Folding of Cytoskeletal Proteins". The Journal of Cell Biology. 145 (2): 265–277. ISSN 0021-9525. PMID 10209023. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Martín-Benito, Jaime; Grantham, Julie; Boskovic, Jasminka; Brackley, Karen I; Carrascosa, José L; Willison, Keith R; Valpuesta, José M (2007-03). "The inter-ring arrangement of the cytosolic chaperonin CCT". EMBO Reports. 8 (3): 252–257. doi:10.1038/sj.embor.7400894. ISSN 1469-221X. PMID 17304242. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Vavylonis, Dimitrios; Yang, Qingbo; O'Shaughnessy, Ben (2005-06-14). "Actin polymerization kinetics, cap structure, and fluctuations". Proceedings of the National Academy of Sciences of the United States of America. 102 (24): 8543–8548. doi:10.1073/pnas.0501435102. ISSN 0027-8424. PMID 15939882. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - McCullagh, Martin; Saunders, Marissa
G.; Voth, Gregory A. (2014-09-17). "Unraveling the Mystery of ATP Hydrolysis in Actin Filaments". Journal of the American Chemical Society. 136 (37): 13053–13058. doi:10.1021/ja507169f. ISSN 0002-7863. PMID 25181471. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|الأول2=على وضع 8 (مساعدة); line feed character في|عنوان=على وضع 11 (مساعدة) - "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science. 128 (11): 2009–2019. Jun 2015. doi:10.1242/jcs.165563. PMID 25788699. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vandekerckhove, Joel; Weber, Klaus (1978-12-25). "At least six different actins are expressed in a higher mammal: An analysis based on the amino acid sequence of the amino-terminal tryptic peptide". Journal of Molecular Biology (باللغة الإنجليزية). 126 (4): 783–802. doi:10.1016/0022-2836(78)90020-7. ISSN 0022-2836. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Garner, Ethan C.; Campbell, Christopher S.; Weibel, Douglas B.; Mullins, R. Dyche (2007-03-02). "Reconstitution of DNA Segregation Driven by Assembly of a Prokaryotic Actin Homolog". Science (New York, N.Y.). 315 (5816): 1270–1274. doi:10.1126/science.1138527. ISSN 0036-8075. PMID 17332412. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Actin - Wikipedia". en.m.wikipedia.org (باللغة الإنجليزية). مؤرشف من الأصل في 12 نوفمبر 2020. اطلع عليه بتاريخ 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bindschadler, M.; Osborn, E. A.; Dewey, C. F.; McGrath, J. L. (2004-5). "A Mechanistic Model of the Actin Cycle". Biophysical Journal. 86 (5): 2720–2739. ISSN 0006-3495. PMID 15111391. مؤرشف من الأصل في 21 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Visualizing the Ca2+-dependent activation of gelsolin by using synchrotron footprinting". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 3942–3947. Apr 2003. Bibcode:2003PNAS..100.3942K. doi:10.1073/pnas.0736004100. PMC 153027. PMID 12655044. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The expanding superfamily of gelsolin homology domain proteins". Cytoskeleton. 70 (11): 775–795. Nov 2013. doi:10.1002/cm.21149. PMID 24155256. S2CID 205643538. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Tropomodulin caps the pointed ends of actin filaments". The Journal of Cell Biology. 127 (6): 1627–1635. 1994-12-02. ISSN 0021-9525. PMID 7798317. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Morton, W. M.; Ayscough, K.; Mclaughlin, P. (2000). "Latrunculin alters the actin-monomer subunit interface to prevent polymerization". Nature Cell Biology. doi:10.1038/35014075. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cooper, J. A. (1987-10). "Effects of cytochalasin and phalloidin on actin". The Journal of Cell Biology. 105 (4): 1473–1478. doi:10.1083/jcb.105.4.1473. ISSN 0021-9525. PMID 3312229. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Digital object identifier - Wikipedia". en.m.wikipedia.org (باللغة الإنجليزية). مؤرشف من الأصل في 21 ديسمبر 2020. اطلع عليه بتاريخ 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Effects of cytochalasin and phalloidin on actin". The Journal of Cell Biology. 105 (4): 1473–1478. 1987-10-01. ISSN 0021-9525. PMID 3312229. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Huber, F.; Schnauß, J.; Rönicke, S.; Rauch, P.; Müller, K.; Fütterer, C.; Käs, J. (2013-1). "Emergent complexity of the cytoskeleton: from single filaments to tissue". Advances in Physics. 62 (1): 1–112. doi:10.1080/00018732.2013.771509. ISSN 0001-8732. PMID 24748680. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Zouwail, Soha; Pettitt, Trevor R.; Dove, Stephen K.; Chibalina, Margarita V.; Powner, Dale J.; Haynes, Lee; Wakelam, Michael J. O.; Insall, Robert H. (2005-07-01). "Phospholipase D activity is essential for actin localization and actin-based motility in Dictyostelium". Biochemical Journal. 389 (Pt 1): 207–214. doi:10.1042/BJ20050085. ISSN 0264-6021. PMID 15769249. مؤرشف من الأصل في 11 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); no-break space character في|الأول3=على وضع 8 (مساعدة); no-break space character في|الأول2=على وضع 7 (مساعدة); no-break space character في|first8=على وضع 7 (مساعدة); no-break space character في|first7=على وضع 8 (مساعدة); no-break space character في|الأول4=على وضع 10 (مساعدة); no-break space character في|الأول5=على وضع 5 (مساعدة) - Theriot, Julie A.; Mitchison, Timothy J. (1991-07). "Actin microfilament dynamics in locomoting cells". Nature (باللغة الإنجليزية). 352 (6331): 126–131. doi:10.1038/352126a0. ISSN 0028-0836. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Lee, Juliet; Ishihara, Akira; Theriot, Julie A.; Jacobson, Ken (1993-03). "Principles of locomotion for simple-shaped cells". Nature (باللغة الإنجليزية). 362 (6416): 167–171. doi:10.1038/362167a0. ISSN 0028-0836. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Trombocitopenias (باللغة الإسبانية). Elsevier España. 2001-10. ISBN 978-84-8174-595-5. مؤرشف من الأصل في 14 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "International Standard Book Number - Wikipedia". en.m.wikipedia.org (باللغة الإنجليزية). مؤرشف من الأصل في 24 ديسمبر 2020. اطلع عليه بتاريخ 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Xu, Ke; Zhong, Guisheng; Zhuang, Xiaowei (2013-01-25). "Actin, spectrin and associated proteins form a periodic cytoskeletal structure in axons". Science (New York, N.Y.). 339 (6118). doi:10.1126/science.1232251. ISSN 0036-8075. PMID 23239625. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Moseley, James B.; Goode, Bruce L. (2006-9). "The Yeast Actin Cytoskeleton: from Cellular Function to Biochemical Mechanism". Microbiology and Molecular Biology Reviews. 70 (3): 605–645. doi:10.1128/MMBR.00013-06. ISSN 1092-2172. PMID 16959963. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Meagher, R. B.; McKinney, E. C.; Kandasamy, M. K. (1999-06). "Isovariant Dynamics Expand and Buffer the Responses of Complex Systems: The Diverse Plant Actin Gene Family". The Plant Cell. 11 (6): 995–1006. ISSN 1040-4651. PMID 10368172. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Kovar, David R.; Staiger, Christopher J.; Weaver, Eric A.; McCurdy, David W. (2000). "AtFim1 is an actin filament crosslinking protein from Arabidopsis thaliana". The Plant Journal (باللغة الإنجليزية). 24 (5): 625–636. doi:10.1046/j.1365-313x.2000.00907.x. ISSN 1365-313X. مؤرشف من الأصل في 9 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clark, Theodore G.; Merriam, Robert W. (1977-12). "Diffusible and bound actin in nuclei of xenopus laevis oocytes". Cell. 12 (4): 883–891. doi:10.1016/0092-8674(77)90152-0. ISSN 0092-8674. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Bohnsack, Markus T.; Stüven, Theis; Kuhn, Christa; Cordes, Volker C.; Görlich, Dirk (2006-03). "A selective block of nuclear actin export stabilizes the giant nuclei of Xenopus oocytes". Nature Cell Biology (باللغة الإنجليزية). 8 (3): 257–263. doi:10.1038/ncb1357. ISSN 1476-4679. مؤرشف من الأصل في 28 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Dopie, Joseph; Skarp, Kari-Pekka; Kaisa Rajakylä, Eeva; Tanhuanpää, Kimmo; Vartiainen, Maria K. (2012-02-28). "Active maintenance of nuclear actin by importin 9 supports transcription". Proceedings of the National Academy of Sciences of the United States of America. 109 (9): E544–E552. doi:10.1073/pnas.1118880109. ISSN 0027-8424. PMID 22323606. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hofmann, Wilma A.; Arduini, Alessandro; Nicol, Samantha M.; Camacho, Carlos J.; Lessard, James L.; Fuller-Pace, Frances V.; de Lanerolle, Primal (2009-07-27). "SUMOylation of nuclear actin". The Journal of Cell Biology. 186 (2): 193–200. doi:10.1083/jcb.200905016. ISSN 0021-9525. PMID 19635839. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Migocka-Patrzałek, Marta; Makowiecka, Aleksandra; Nowak, Dorota; Mazur, Antonina J.; Hofmann, Wilma A.; Malicka-Błaszkiewicz, Maria (2015). "β- and γ-Actins in the nucleus of human melanoma A375 cells". Histochemistry and Cell Biology. 144 (5): 417–428. doi:10.1007/s00418-015-1349-8. ISSN 0948-6143. PMID 26239425. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hu, Ping; Wu, Si; Hernandez, Nouria (2004-12-15). "A role for β-actin in RNA polymerase III transcription". Genes & Development. 18 (24): 3010–3015. doi:10.1101/gad.1250804. ISSN 0890-9369. PMID 15574586. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cooper, Geoffrey M. (2000). "Actin, Myosin, and Cell Movement". The Cell: A Molecular Approach. 2nd edition (باللغة الإنجليزية). مؤرشف من الأصل في 27 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Antoni Bayés de (2002-12). Cardiologia Clinica (باللغة الإسبانية). Elsevier España. ISBN 978-84-458-1179-5. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - John W.; Dominiczak, Marek H. (2005-12). Bioquímica médica (باللغة الإسبانية). Elsevier. ISBN 978-84-8174-866-6. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Alpha-actinin localization in the cleavage furrow during cytokinesis". The Journal of Cell Biology. 79 (1): 268–275. 1978-10-01. ISSN 0021-9525. PMID 359574. مؤرشف من الأصل في 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mashima, Tetsuo; Naito, Mikihiko; Noguchi, Kohji; Miller, Douglas K.; Nicholson, Donald W.; Tsuruo, Takashi (1997-03). "Actin cleavage by CPP-32/apopain during the development of apoptosis". Oncogene (باللغة الإنجليزية). 14 (9): 1007–1012. doi:10.1038/sj.onc.1200919. ISSN 1476-5594. مؤرشف من الأصل في 2 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Huot, Jacques; Houle, François; Rousseau, Simon; Deschesnes, Réna G.; Shah, Girish M.; Landry, Jacques (1998-11-30). "SAPK2/p38-dependent F-Actin Reorganization Regulates Early Membrane Blebbing during Stress-induced Apoptosis". The Journal of Cell Biology. 143 (5): 1361–1373. ISSN 0021-9525. PMID 9832563. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Quantitative analysis of cadherin-catenin-actin reorganization during development of cell-cell adhesion". The Journal of Cell Biology. 135 (6): 1899–1911. 1996-12-02. ISSN 0021-9525. PMID 8991100. مؤرشف من الأصل في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fernandez-Valle, Cristina; Gorman, Douglas; Gomez, Anna M.; Bunge, Mary Bartlett (1997-01-01). "Actin Plays a Role in Both Changes in Cell Shape and Gene- Expression Associated with Schwann Cell Myelination". Journal of Neuroscience (باللغة الإنجليزية). 17 (1): 241–250. doi:10.1523/JNEUROSCI.17-01-00241.1997. ISSN 0270-6474. PMID 8987752. مؤرشف من الأصل في 2 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Grummt, Ingrid (2006-04-01). "Actin and myosin as transcription factors". Current Opinion in Genetics & Development. (باللغة الإنجليزية). 16 (2): 191–196. doi:10.1016/j.gde.2006.02.001. ISSN 0959-437X. مؤرشف من الأصل في 5 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Xu, Jingsong; Van Keymeulen, Alexandra; Wakida, Nicole M.; Carlton, Pete; Berns, Michael W.; Bourne, Henry R. (2007-05-29). "Polarity reveals intrinsic cell chirality". Proceedings of the National Academy of Sciences of the United States of America. 104 (22): 9296–9300. doi:10.1073/pnas.0703153104. ISSN 0027-8424. PMID 17517645. مؤرشف من الأصل في 28 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-renewal". The Journal of Cell Biology. 164 (6): 887–897. Mar 2004. doi:10.1083/jcb.200310055. PMC 2172292. PMID 15024034. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Autonomous right-screw rotation of growth cone filopodia drives neurite turning". The Journal of Cell Biology. 188 (3): 429–441. Feb 2010. doi:10.1083/jcb.200906043. PMC 2819689. PMID 20123994. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Micropatterned mammalian cells exhibit phenotype-specific left-right asymmetry". Proceedings of the National Academy of Sciences of the United States of America. 108 (30): 12295–12300. Jul 2011. Bibcode:2011PNAS..10812295W. doi:10.1073/pnas.1103834108. PMC 3145729. PMID 21709270. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Su, Andrew I.; Wiltshire, Tim; Batalov, Serge; Lapp, Hilmar; Ching, Keith A.; Block, David; Zhang, Jie; Soden, Richard; Hayakawa, Mimi (2004-04-20). "A gene atlas of the mouse and human protein-encoding transcriptomes". Proceedings of the National Academy of Sciences of the United States of America. 101 (16): 6062–6067. doi:10.1073/pnas.0400782101. ISSN 0027-8424. PMID 15075390. مؤرشف من الأصل في 4 يونيو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "ACTA1 - Actin, alpha skeletal muscle precursor - Homo sapiens (Human) - ACTA1 gene & protein". www.uniprot.org (باللغة الإنجليزية). مؤرشف من الأصل في 8 نوفمبر 2020. اطلع عليه بتاريخ 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kaindl, A; Ruschendorf, F; Krause, S; Goebel, H; Koehler, K; Becker, C; Pongratz, D; Muller-Hocker, J; Nurnberg, P (2004-11). "Missense mutations of ACTA1 cause dominant congenital myopathy with cores". Journal of Medical Genetics. 41 (11): 842–848. doi:10.1136/jmg.2004.020271. ISSN 0022-2593. PMID 15520409. مؤرشف من الأصل في 11 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Kathryn N.; Ryan, Monique M. (1993). Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E.; Bean, Lora JH; Stephens, Karen; Amemiya, Anne (المحررون). GeneReviews®. Seattle (WA): University of Washington, Seattle. PMID 20301465. مؤرشف من الأصل في 15 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ilkovski, B. (2004-06-15). "Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms". Human Molecular Genetics. 13 (16): 1727–1743. doi:10.1093/hmg/ddh185. ISSN 1460-2083. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clarke, Nigel F.; Ilkovski, Biljana; Cooper, Sandra; Valova, Valentina A.; Robinson, Phillip J.; Nonaka, Ikuya; Feng, Juan-Juan; Marston, Steven; North, Kathryn (2007). "The pathogenesis of ACTA1-related congenital fiber type disproportion". Annals of Neurology (باللغة الإنجليزية). 61 (6): 552–561. doi:10.1002/ana.21112. ISSN 1531-8249. مؤرشف من الأصل في 9 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Miwa, T; Manabe, Y; Kurokawa, K; Kamada, S; Kanda, N; Bruns, G; Ueyama, H; Kakunaga, T (1991-06). "Structure, chromosome location, and expression of the human smooth muscle (enteric type) gamma-actin gene: evolution of six human actin genes". Molecular and Cellular Biology. 11 (6): 3296–3306. ISSN 0270-7306. PMID 1710027. مؤرشف من الأصل في 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Akpolat, N.; Yahsi, S.; Godekmerdan, A.; Yalniz, M.; Demirbag, K. (2005). "The value of α-SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study". Histopathology (باللغة الإنجليزية). 47 (3): 276–280. doi:10.1111/j.1365-2559.2005.02226.x. ISSN 1365-2559. مؤرشف من الأصل في 2 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Pol II-expressed shRNA knocks down Sod2 gene expression and causes phenotypes of the gene knockout in mice". PLOS Genetics. 2 (1): e10. Jan 2006. doi:10.1371/journal.pgen.0020010. PMC 1358942. PMID 16450009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Online Mendelian Inheritance in Man - Wikipedia". en.m.wikipedia.org (باللغة الإنجليزية). مؤرشف من الأصل في 15 أكتوبر 2020. اطلع عليه بتاريخ 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Olson, Timothy M; Doan, Thao P; Kishimoto, Nina Y; Whitby, Frank G; Ackerman, Michael J; Fananapazir, Lameh (2000-09). "Inherited and de novo Mutations in the Cardiac Actin Gene Cause Hypertrophic Cardiomyopathy". Journal of Molecular and Cellular Cardiology. 32 (9): 1687–1694. doi:10.1006/jmcc.2000.1204. ISSN 0022-2828. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Pigott, Timothy J. D.; Jefferson, D. (1991-01-01). "Idiopathic common peroneal nerve palsy–a review of thirteen cases". British Journal of Neurosurgery. 5 (1): 7–11. doi:10.3109/02688699108998440. ISSN 0268-8697. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "AceView: Gene:ACTB, a comprehensive annotation of human, mouse and worm genes with mRNAs or ESTsAceView". www.ncbi.nlm.nih.gov. مؤرشف من الأصل في 28 سبتمبر 2016. اطلع عليه بتاريخ 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Hsp27 and axonal growth in adult sensory neurons in vitro". BMC Neuroscience. 6 (1): 24. 2005. doi:10.1186/1471-2202-6-24. PMC 1087488. PMID 15819993. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nunoi, Hiroyuki; Yamazaki, Tsuyoshi; Tsuchiya, Hiroyuki; Kato, Seishi; Malech, Harry L.; Matsuda, Ichiro; Kanegasaki, Shiro (1999-07-20). "A heterozygous mutation of β-actin associated with neutrophil dysfunction and recurrent infection". Proceedings of the National Academy of Sciences of the United States of America. 96 (15): 8693–8698. ISSN 0027-8424. PMID 10411937. مؤرشف من الأصل في 12 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sonnemann, Kevin J.; Fitzsimons, Daniel P.; Patel, Jitandrakumar R.; Liu, Yewei; Schneider, Martin F.; Moss, Richard L.; Ervasti, James M. (2006-09). "Cytoplasmic γ-Actin Is Not Required for Skeletal Muscle Development but Its Absence Leads to a Progressive Myopathy". Developmental Cell. 11 (3): 387–397. doi:10.1016/j.devcel.2006.07.001. ISSN 1534-5807. مؤرشف من الأصل في 2 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); no-break space character في|first7=على وضع 6 (مساعدة); no-break space character في|الأول5=على وضع 7 (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Gouin, Edith; Welch, Matthew D; Cossart, Pascale (2005-02-01). "Actin-based motility of intracellular pathogens". Current Opinion in Microbiology. (باللغة الإنجليزية). 8 (1): 35–45. doi:10.1016/j.mib.2004.12.013. ISSN 1369-5274. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Machesky, Laura M.; Tang, Hao Ran (2009-07-07). "Actin-Based Protrusions: Promoters or Inhibitors of Cancer Invasion?". Cancer Cell (باللغة الإنجليزية). 16 (1): 5–7. doi:10.1016/j.ccr.2009.06.009. ISSN 1535-6108. PMID 19573806. مؤرشف من الأصل في 28 سبتمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Evolution of the cytoskeleton". BioEssays. 29 (7): 668–677. Jul 2007. doi:10.1002/bies.20601. PMC 2630885. PMID 17563102. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Galletta, Brian J.; Cooper, John A. (2009-2). "Actin and Endocytosis: Mechanisms and Phylogeny". Current opinion in cell biology. 21 (1): 20–27. doi:10.1016/j.ceb.2009.01.006. ISSN 0955-0674. PMID 19186047. مؤرشف من الأصل في 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - van den Ent, Fusinita; Amos, Linda A.; Löwe, Jan (2001-09). "Prokaryotic origin of the actin cytoskeleton". Nature (باللغة الإنجليزية). 413 (6851): 39–44. doi:10.1038/35092500. ISSN 0028-0836. مؤرشف من الأصل في 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Mansson, A.; Sundberg, M.; Bunk, R.; Balaz, M.; Nicholls, I. A.; Omling, P.; Tegenfeldt, J. O.; Tagerud, S.; Montelius, L. (2005-11). "Actin-Based Molecular Motors for Cargo Transportation in Nanotechnology— Potentials and Challenges". IEEE Transactions on Advanced Packaging. 28 (4): 547–555. doi:10.1109/TADVP.2005.858309. ISSN 1557-9980. مؤرشف من الأصل في 7 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Actin - Wikipedia". en.m.wikipedia.org (باللغة الإنجليزية). مؤرشف من الأصل في 12 نوفمبر 2020. اطلع عليه بتاريخ 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Selvey, S.; Thompson, E. W.; Matthaei, K.; Lea, R. A.; Irving, M. G.; Griffiths, L. R. (2001-10). "Beta-actin--an unsuitable internal control for RT-PCR". Molecular and Cellular Probes. 15 (5): 307–311. doi:10.1006/mcpr.2001.0376. ISSN 0890-8508. PMID 11735303. مؤرشف من الأصل في 26 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Current advances in proteomic analysis and its use for the resolution of poultry meat quality". World's Poultry Science Journal. 62 (1): 123–130. 2006. doi:10.1079/WPS200589. S2CID 86189373. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Methods and Instruments in Applied Food Analysis". Handbook of food analysis. 3 (الطبعة 2). New York, N.Y: Marcel Dekker. 2004. صفحات 1741–2226. ISBN 978-0-8247-5039-8. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء الحيوية