هيكل خلوي
الهيكل الخلوي (بالإنجليزية: Cytoskeleton) هو عبارة عن دعامة أو هيكل بروتيني موجود مثل جميع العضيات الأخرى ضمن السايتوبلازم. يوجد الهيكل الخلوي في جميع الخلايا الحية النباتية والحيوانية إضافة إلى خلايا طلائعيات النوى وحقيقيات النوى قديما كان يعتقد أنها ليست موجودة إلا في الخلايا حقيقية النواة وبعد دراسات وجد انها متوافرة في الخلايا بدائية النواة حيث تم العثور على بروتينات في بدائيات النواة مماثلة للبروتينات الرئيسية المكونة للهيكل الخلوي في حقيقية النواة. ويشكل بنية حركية تحافظ على شكل الخلية، وتمكن بعض أنواع البكيريا من الحركة مستخدمةً السياط (flagella) أو هدب الخلية|الأهداب (cilia)، كما وتلعب دورا أساسياً في النقل والحركة داخل الخلية مثل نقل الحويصلات وحركة العضيات في السايتوبلازم، ويقوم الهيكل الخلوي بدور أساسي في عملية الانقسام الخلوي وفي ثبات شكل الخلية وفي الثبات العام للأنسجة.[1]
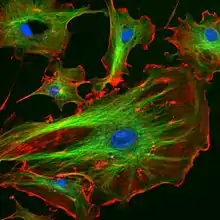
اقسام الهيكل الخلوي
وظيفة الهيكل الخلوي
- إعطاء الخلية دعامة وشكل ثابت
- انقباض العضلات وانبساطها
- حركة العضيات وتثبيتها
هيكل خلوي لحقيقيات النواة
الخيوط الدقيقة
قد أظهرت صور المجهر الإلكتروني تراكيب خيطية دقيقة في مواقع مختلفة من سايتوبلازم الخلية سميت هذه التركيب بالخيوط الدقيقة فقد توجد في بعض أنواع الخلايا قريبة من الغشاء البلازمي تؤلف ما يسمى بالشبكة الطرفية ومن امثلتها تلك الموجودة في حالة الخلايا الطلائية المعوية أو تلاحظ على الاسطح الجانبية للخلايا الطلائية المعوية أو تلاحظ منتشرة في السايتوبلازم كما في الخلايا العضلية المخططة ممثلة بخيوط المايوسين السميكة وخيوط الاكتين الرفيعة. تظهر الخيوط الدقيقة بصورة واضحة عندما تكون بهيئة حزم من خيوط أو لييفات ممتدة بصورة متجاورة ومتوازية مع بعضها وخاصة عند تثبيت الخلية بالالديهايد . أما التركيب الكيميائي لها فهي تتركب من سلسلة طويلة من جزيئات بروتينية من نوع الاكتين أو البروتينات الشبيهة بالاكتين وأن قسماً من هذه الخيوط منشأها البلمرة كرد فعل لعوامل بيئية أو حركة الخلية وقد تسبب الحالة الجيلاتينية لأرضية السايتوبلازم إلى التحول من الحالة الجزيئية المفردة (مونمر) إلى الحالة الجزيئية المتجمعة (بوليمر) شكل خيوط دقيقة تتراوح اقطارها بين 3-6 نانوميترا" مثل خيوط الاكتين في العضلات أو حوالي 10 نانوميترا" (مثل خيوط المايوسين في العضلات) أو قد تكون اسمك من ذلك حيث يصل قطرها ما بين 15-25 نانوميترا" كخيوط المايوسين الموجودة في الاميبا والفطريات المخاطية. يوجد في الاقل نوعين من الخيوط الدقيقة هي:
خيوط دقيقة من نوع (ل) يتألف هذا النوع (ويعني المشبك) من قطع قصيرة تكون قريبة من أغشية الخلايا ومتصلة بسطوحها الداخلية، فمثلاً في الخلية المعوية تشكل هذه القطع القصيرة للشبكة الطرفية اسفل الغشاء العلوي (المواجه للتجويف المعوي) مباشرة يمتاز هذا النوع من الخيوط بحساسية للمادة (سايتوكولاسين - ب ) الذي يعمل ايضاً على ايقاف العديد من وظائف ارضية السايتوبلازم ومنها الانسياب السايتوبلازمي (في الخلايا النباتية) وانقسام السايتوبلازم وحركة الخلية والإدخال الخلوي والإفراز الخلوي ووظائف أخرى. خيوط دقيقة من نوع( س) وهي عبارة عن خيوط متطاولة مرتبة بصورة موازية لبعضها البعض إلا أنها لا تؤلف حزم. وهي غير حساسة للدواء( سايتوكولاسين – ب) وتمتلك صفات مشابهة للاكتين في العضلات. وظائف الخيوط الدقيقة: 1- التقلص العضلي : توجد الخيوط الدقيقة في الخلايا العضلية المخططة والملساء والعضلة القلبية التي تلعب دوراً مهماً في تقلص هذه الخلايا. 2-انقسام السايتوبلازم: يتضمن الانقسام الخلوي في الخلايا الحيوانية آليتين منفصلتين انقسام النواة وانقسام السايتوبلازم فبالنسبة للآلية الاولى فان الانبيبات الدقيقة تلعب دوراً مهماً في انقسام وانفصال الكرموسومات الشقيقة اما الآلية الثانية المتمثلة بانقسام السايتوبلازم تبدأ في نهاية الطور الانفصالي ففي الخلايا الحيوانية ينجز الانقسام السايتوبلازمي في خطوتين: (1) تبدأ الخلية بالتخصر عند خط استواء المغزل. (2) تتجمع مادة كثيفة حول الياف المغزل المحيطية وكذلك على طول خط الاستواء تستمر كلا العمليتين في نفس الوقت يتحرك الغشاء البلازمي إلى الداخل مسبباً في اتخاذ الخلية شكل الدمبل ثم تصبح المادة المتجمعة على طول خط الاستواء المغزل واضحة الكثافة مشكلة التركيب الذي يعرف بالجسم الوسطي قبل اتصال حافات انبعاجات الغشاء البلازمي مباشرة فان الجسم الوسطي تقل كثافته ويختفي. ولاتزال القوى المسؤولة عن عملية التقلص التي تسبب تخصر الغشاء البلازمي في خلال انقسام السايتوبلازم تحت المناقشة ولكن هناك اعتقاد حول دور الخيوط الدقيقة في هذه العملية من خلال وجود هذه الخيوط بشكل منتظم في منطقة التقلص ومن خلال تثبيط هذه العملية بمادة ( سايتوكولاسين – ب) ولم تحدد بشكل اكيد الالية الجزيئية المسؤولة عن التقلص الا انه يعتقد بانها تتضمن انزلاق خيوط الاكتين والمايوسين بالشكل الذي يشابه الانزلاق المعروف حدوثه اثناء تقلص الخلية العضلية. 3- حركة الغشاء البلازمي: تمتلك الخلايا الطلائية المعوية امتدادات اصبعية صغيرة تسمى الزغب الدقيقة تكون نهاياتها الحرة ضمن القناة الهضمية. تعمل الزغب الدقيقة على زيادة المساحة السطحية للامعاء وبالتالي تزيد من امتصاص الغذاء المهضوم كما تقصر وتطول الزغب الدقيقة بشكل دوري في التجويف المعوي هذه العملية التي قد تسهل من امتصاص الغذاء ويمكن ملاحظة خيوط دقيقة اكتينية متعددة متصلة بالغشاء البلازمي في قمة وجانب كل زغبة دقيقة. 4- تكوين الاقدام الكاذبة والحركة الاميبية: نجز الاميبا والفطريات المخاطية وخلايا الدم البيضاء وعدد اخر من الخلايا حركة من خلال تكوين الاقدام الكاذبة.[2]
الانبيبيات الدقيقة
توجد الانيبيبات الدقيقة بصورة سابحة في سايتوبلازم خلايا حقيقة النواة وتدعى بالانيبيبات الدقيقة السايتوبلازمية ؤلف الانيبيبات الدقيقة التركيب الاساسي للعديد من الاجزاء مثل الاهداب والاسواط والجسم المركزي والمغزل والقدم المحوري(اكسوستايل ) وبطانة البلعوم الخلوي في بعض الهدبيات وقناة الفجوة المتقلصة والبروزات العديدة في الخلايا كما توجد في الخلايا العصبية وتسمى بالانيبيبات العصبية وفي السايتوبلازم قرب الجدار في الخلايا النامية. في النبات تكون الانيبيبات الدقيقة موجودة اما بصورة مفردة أو على شكل حزم مرتبطة ببعضها بجسور أو روابط بعد استخلاص هذه التراكيب وجد انها تتركب من بروتين كروي يدعى تيوبيولين وزنه الجزيئي55000 دالتون كما اشارت العديد من المصادر إلى وجود نوعين سميت ب( ب1 و ب2 )
تختلف الانيبيبات الدقيقة عن الخيوط الدقيقة في العديد من المظاهر الأساسية:
ا-تتألف من انواع مختلفة من البروتينات، فالخيوط الدقيقة مكونة من بروتين الاكتين أو الشبيه بالاكتين اما الانيبيبات الدقيقة فمكونة من بروتين التيوبيولين. ب-تمتلك تركيب مختلف فتكون جزيئات البروتين المكونة للخيوط الدقيقة مرتبة بشكل خيوط اولية ثنائية التحلزن اما الانيبيبات الدقيقة فتكون جزيئات البروتين فيها مرتبة بصورة انبوب مجوف جدرانه مؤلفة من 13 خيط بروتين. ج - تتفكك إلى جزيئات بروتينية بسيطة نتيجة معاملتها بمواد مختلفة فالخيوط الدقيقة عند معاملتها تتفكك عادة عند معاملتها بمادة في حين تتفكك الانيبيبات الدقيقة عند معاملتها بمادة الكولجسين. ( سايتوكولاسين – ب) اما وحيدات الانيبيبات الدقيقة تعتمد على جزيئات ATP د - يكون ارتباط وحيدات الخيوط الدقيقة معتمداً على جزيئات الـ .(GTP Guanosine triphosphate) وظيفة الانيبيبات الدقيقة: - الاسناد: تمثل الانيبيبات الدقيقة الهيكل الذي يحدد شكل الخلية واعادة توزيع محتوياتها، فمثلاً الشكل القرصي لكريات الدم الحمراء يعتمد على الانيبيبات الدقيقة فعند معاملة هذه الكريات الدموية بالكولجسين تفقد شكلها القرصي لان هذه المادة تؤثر على الانيبيبات الدقيقة من خلال تحويلها من الحالة الجزيئية المتعددة بوليمر إلى الحالة الجزيئية المفردة مونمر بعملية ازالة البلمرة.
- : - تكوين الشكل الخلوي: وهذه الوظيفة متعلقة بالوظيفة السابقة حيث تلعب الانيبيبات الدقيقة دوراً في شكل الخلية اثناء التمييز (التخصص) الخلوي فمثلاً استطالة الخلايا اثناء تكوين النطف في الحيوانات فان استطالة النواة تكون متلازمة مع تكوين حزم منتظمة من الانيبيبات الدقيقة.
النقل: تتلازم الانيبيبات الدقيقة مع نقل الجزيئات من حبيبات وحويصلات ضمن الخلية.- اصل الانيبيبات الدقيقة: يعتقد ان الانيبيبات الدقيقة لها القابلية على التكون الذاتي عند توفر الظروف المناسبة من جزيئات بروتينية ضمن سايتوبلازم الخلية كما مبين في هذه المعادلة: Monomer U Polymer ومن المعتقد ان هذه الظاهرة في حالة توازن داخل الخلايا كما يعتقد ايضاً ان المواد التي تؤثر على هذه تفكك الانيبيبات مثل الكولجسين تعمل على جعل اتجاه التوازن نحو الحالة الجزيئية المفردة. اما العوامل المساعدة في بناء وحدة الانيبيبات مثل() فتغير من اتجاه التوازن نحو الحالة الجزيئية المتعددة كما ويعتقد ايضاً ان الخيوط الدقيقة تكون كالاول وخاضعة إلى حالة التوازن اعلاه وتتأثر عادة ب ( سايتوكولاسين – ب) محولة حالة التوازن باتجاه الحالة الجزيئية المفردة كما تعمل الجزيئات()كعوامل مساعدة تغير من اتجاه التوازن نحو الحالة الجزيئية المتعددة.[3]
الخيوط البينية
تم اكتشاف الخيوط البينية بعد ظهور المجهر الإلكتروني وهي عبارة عن خيوط غير متفرعة ناعمة السطح وصلبة تتراوح ابعادها ما بين 11- 7 انوميتر تتوسط الحافة بين الانبيبات الدقيقة والخيوط الدقيقة وبسبب موضعها هذا سميت بالخيوط البينية وتظهر غالباً في ترتيب فراغي مشابه لما هو في الانيبيبات الدقيقة كما تظهر الخيوط البينية اختلافاً واسعاً في التركيب والعناصر الكيميائية والإذابة ويشفر لهذه الخيوط بما لا يقل عن60 جين وخاصة في خلايا الانسان. توجد الخيوط البينية في العديد من الخلايا وليس جميعها حيث توجد في خلايا الحيوانات الفقرية واللافقرية وكذلك في الخلايا النباتية وتوجد اصناف مختلفة من الخيوط الدقيقة وهذه الاصناف تكون متشابهة بالنسبة إلى الانواع المتماثلة فمثلاً الاجسام المضادة التي تتفاعل في الدسمين المكون للهيكل العضلي في الانسان يتفاعل ايضاً مع الدسمين في جميع الحيوانات الفقرية الاخرى ويعزى السبب إلى التشابه في ترتيب تعاقب الاحماض الامينية المكونة لهذا النوع من البروتين وعلى الرغم عن وجود هذه الاصناف من الخيوط البينية المختلفة فان التركيب العام لها يكون متشابهة إلى حد ما فجميعها تحتوي على ما لا يقل عن310 حامض اميني مركزي وتكون ذات شكل عصوي حلزوني وتكون الاحماض الامينية السبعة الاولى محبة للماء مما يساعد على حصول عملية تجميع بين السلاسل متعدد الببتيد الاساسية المكونة للخيوط البينية مما يحدث عملية تجميع بين هذه سلاسل والتجميع قد يحدث بين اثنين منها مكونة وحدة قطبية بطول45 نانوميتر تقريباً تمثل مجموعة (المحطة النهائية ن) احدى نهاياته وتنتهي النهاية المقابلة بمجموعة الكاربوكسيل (المحطة النهائية س). بوليمر يتألف من أربع وحدات مونومر بنهايتين متعاكستين وبذلك تفقد وقد تحدث عملية تجميع بين اثنين من هذه الوحدات مكونة قطبيتها وقد تتجمع هذه الوحدات جنباً إلى جنب مكونة تركيب الخيوط البينية وعندما تتحد أو تتجمع اربع خيوط اولية مع بعضها يبلغ قطرها حوالي 15نانوميتر وأطول خيط يبلغ وزنه الجزيئي حوالي240000 دالتون بطول 40مايكروميتر تقريباً. وعند عزل النواة من الخلية لوحظ وجود ارتباط بين الغلاف النووي وبين الخيوط البينية وهذا يقود إلى الاستنتاج ان الغلاف النووي قد يشترك في بلمرة الخيوط البينية وفي الحقيقة ان بروتينات الخيوط البينية تطرح إلى الخلية ثم تتحد مع الغلاف النووي ولكن لايعرف شيئاً عن مركز تنظيم الخيوط البينية توجد العديد من البروتينات المتخصصة تتحد مع الخيوط البينية مثل بارامينين وسايمينين مكونة ما يشبه الشبكة مع الخيوط البينية والبعض من هذه البروتينات قد ترتبط مع بروتينات الخيوط الدقيقة.[4]
هيكل خلوي في الخلايا بدائية النواة (Prokaryotic cytoskeleton)
كان من المغتقد أن الهيكل الخلوي موجود فقط في الخلايا حقيقية النواة (eukaryotes)، لكن تم اثبات وجوده في بدائيات النواة (prokaryotes)، حيث تم العثور بروتينات في بدائيات النواة مماثلة للبروتينات الرئيسية المكونة للهيكل الخلوي في حقيقيات النواة.[5] على الرغم من أن العلاقات التطورية بعيدة بحيث تكون غير واضحة من مقارنات تسلسل البروتين وحده، لكن تشابه هياكلها ثلاثية الأبعاد ومماثلة ظائفها من حيث المحافظة على شكل الخلية والاستقطاب يوفر أدلة قوية على أن الهيكل الخلوي لحقيقية النواة وبدائية النواة متماثل حقا.[6] ومع ذلك، قد يكون لها بعض المكونات في الهيكل الخلوي البكتيري لم تتحدد بعد.[7][8]
بروتين FtsZ
يعد البروتين اف تي اس زي (FtsZ) من أول البروتينات التي تم تحديدها في الهيكل الخلوي الخاص ببدائيات النواة. يقوم البروتين FtsZ بتشكيل خيوط بوجود جوانوزين ثلاثي الفسفات ((guanosine triphosphate (GTP)، ولكن هذه الخيوط لا تتجمع لتشكيل الأنابيب. خلال الانقسام الخلوي، FtsZ هو أول البوتينات التي تنتفل إلى موقع الانقسام، حيث يكون ضروري لتجنيد البروتينات الأخرى التي تقوم بتكوين جدارخلوي جديد بين الخلايا المنقسمة.
| بروتينات الهيكل الخلوي |
|---|
|
الخييطات - أكتين | ميوزين | بروتينات مرتبطة بالأكتين هيكل خلايا طلائعيات النوى - إف تي إس زد (FtsZ) | مريب (MreB) | كريسسينتين خيط متوسط - كيراتينات | بروتينات IF نمط III | خيوط عصبية | لامينا نووية | البروتينات المرافقة للخيوط المتوسطة نبيبات دقيقة - تيوبيولين | داينيئين | كينيسين | بروتين مرافق للنبييبات الدقيقة |
MreB و ParM
MreB هو أحد البروتينات الشبيهة بالأكتين (actin-like proteins) التي تشارك في الحفاظ على شكل الخلية.في البكتيريا غير الكروية يوجد جينات ترميز البروتينات الشبيهة بالأكتين، وهذه البروتينات تشكل شبكة حلزونية تحت غشاء الخلية التي تقوم بتوجيه البروتينات المشاركة في جدار الخلية الحيوي.[9]
بعض البلازميدات تقوم بترميز نظام التقسيم الذي ينطوي على البروتين PARM شبيه الأكتين. خيوط البروتين PARM تبدي عدم استقرار ديناميكي، ويمكن لها تقسيم DNA البلازميد إلى خلايا وليدة قابلة للانقسام من خلال آلية مماثلة لتلك المستخدمة من قبل الأنابيب الدقيقة أثناء انقسام المتساوي في حقيقيات النواة.[7][9]
بروتين Crescentin
تحتوي بكتيريا كريسينتاس العنيقاء (Caulobacter crescentus) على بروتين ثالث وهو بروتين كريسينتين (crescentin)، الذي يرتبط بالشعيرات المتوسطة في الخلايا الحقيقية النواة، كما أنه يشارك في الحفاظ على شكل الخلية، مثل البكتيريا الحلزونية الشكل، لكن الية عمل هذا البروتين لم يتم تحديدها بعد.[10]
الفرق في الهيكل الخلوي بين اوليات وحقيقيات النوى
البروتينات مثل تويولين وتويولين في حقيقيات النوى وFtsZ، TubZ، RepX في بدائيات النوى. اما البروتينات مثل الأكتين والأكتين في حقيقيات النوى وMreB، FtsA فهي متواجدة في بدائيات النوى. مثال على WACA البروتينات _والتي توجد معظمها في بدائيات النوى _هو MinD. أمثلة عن خيوط الوسيطة_ التي وجه الحصر تقريبا وجدت في الحيوانات (أي حقيقيات النوى) _هي lamins، keratins، vimentin، neurofilaments، desmin.[11]
على الرغم من البروتينات مثل تويولين تشترك في بعض التشابه تسلسل الأحماض الأمينية، وتشابهها في البروتين أضعاف والتشابه في الموقع ملزم [GTP] هو أكثر لفتا. وينطبق الشيء نفسه على البروتينات مثل الأكتين وهيكلها ومجال الربط ATP.[2][12]
عادة ما ترتبط البروتينات هيكل الخلية مع شكل الخلية، حمض نووي ريبوزي منقوص الأكسجين وانقسام الخلايا في بدائيات النوى وحقيقيات النوى. التي تفي البروتينات المهمة التي هي مختلفة جدا. على سبيل المثال، DNA في جميع حقيقيات النوى يحدث من خلال استخدام تويولين، ويمكن استخدام مثل الأكتين أو البروتينات مثل تويولين. وتوسطت انقسام الخلايا في حقيقيات النوى التي كتبها الأكتين، ولكن في بدائيات النوى عادة عن طريق (غالبا FtsZ الدائري) البروتينات مثل تويولين وأحيانا Crenarchaeota) ESCRT-III)، الذي لا يزال في حقيقيات النوى دورا في الخطوة الأخيرة من دوري الدرجة.[11]
تاريخ الهيكل الخلوي
التسمية
في عام 1903، اقترح Nikolai K Koltsov أن شكل الخلايا وتحديد شبكة من الأنابيب التي وصفها بأنها الهيكل الخلوي. واقترح مفهوم فسيفساءالبروتين الذي يعتمد على الكيمياء الحيوية من قبل رودولف بيترز في عام 1929 في حين تم إدخال مصطلح (cytosquelette، بالفرنسية) أول من الأجنة الفرنسية paul Wintrebert في عام 1931 [13]
انابيب دقيقة
وثمة عنصر هيكل الخلية حقيقية النواة الرابع، انابيب دقيقة، اقترح كيث بورتر بناء على الصور التي تم الحصول عليها من ارتفاع الجهد المجهر الإلكتروني للخلايا كاملة في 1970s. وأظهرت لقطات، هياكل الخيطية قصيرة من التركيب الجزيئي غير معروف المرتبطة الهياكل حشوية المعروفة. اقترح بورتر أن هذا الهيكل يمثل شبكة الخيطية رواية متميزة من الأنابيب الدقيقة، الأكتين الخيطية، أو شعيرات متوسطة. ومن المقبول عموما الآن أن ليست أكثر من مجرد قطعة أثرية من أنواع معينة من العلاج التثبيت، على الرغم من تعقيد الهيكل الخلوي للخلية ليست مفهومة تماما حتى الآن.[14]
انظر أيضًا
مراجع
- Fletcher DA, Mullins RD (Jan 2010). "Cell mechanics and the cytoskeleton". Nature 463 (7280): 485–92. Bibcode:2010Natur.463..485F. doi:10.1038/nature08908. PMC 2851742. ببمد 20110992.
- Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (Jun 2015). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science 128 (11): 2009–2019. doi:10.1242/jcs.165563. ببمد 25788699.
- Unless else specified in boxes, then ref is:Walter F., PhD. Boron (2003). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. p. 1300. ISBN 1-4160-2328-3. Page 25
- Paulin D, Li Z (Nov 2004). "Desmin: a major intermediate filament protein essential for the structural integrity and function of muscle". Experimental Cell Research 301 (1): 1–7. doi:10.1016/j.yexcr.2004.08.004. ببمد 15501438. Retrieved 17 April 2015.
- Shih YL, Rothfield L (Sep 2006). "The bacterial cytoskeleton". Microbiology and Molecular Biology Reviews 70 (3): 729–54. doi:10.1128/MMBR.00017-06.PMC 1594594. {{PMID|16959967}}.
- Michie KA, Löwe J (2006). "Dynamic filaments of the bacterial cytoskeleton" (PDF).Annual Review of Biochemistry 75: 467–92.doi:10.1146/annurev.biochem.75.103004.142452. {{PMID|16756499}}.
- Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (Jun 2015). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science 128 (11): 2009–2019. doi:10.1242/jcs.165563. {{PMID|25788699}}.
- Briegel A, Dias DP, Li Z, Jensen RB, Frangakis AS, Jensen GJ (Oct 2006). "Multiple large filament bundles observed in Caulobacter crescentus by electron cryotomography".Molecular Microbiology 62 (1): 5–14. doi:10.1111/j.1365-2958.2006.05355.x.PMID 16987173.
- Popp D, Narita A, Lee LJ, Ghoshdastider U, Xue B, Srinivasan R, Balasubramanian MK, Tanaka T, Robinson RC (2012). "Novel actin-like filament structure from Clostridium tetani". The Journal of Biological Chemistry 287 (25): 21121–9.doi:10.1074/jbc.M112.341016. PMC 3375535. {{PMID|22514279}}.
- Ausmees N, Kuhn JR, Jacobs-Wagner C (Dec 2003). "The bacterial cytoskeleton: an intermediate filament-like function in cell shape". Cell 115 (6): 705–13. doi:10.1016/S0092-8674(03)00935-8. {{PMID|14675535}}.
- Wickstead B, Gull K (Aug 2011). "The evolution of the cytoskeleton". The Journal of Cell Biology 194 (4): 513–25. doi:10.1083/jcb.201102065. PMC 3160578. ببمد 21859859.
- Wickstead B, Gull K (Aug 2011). evolution of the cytoskeleton". The Journal of Cell Biology 194 (4): 513–25. doi:10.1083/jcb.201102065. PMC 3160578. ببمد 21859859.
- Frixione E (Jun 2000). "Recurring views on the structure and function of the cytoskeleton: a 300-year epic". Cell Motility and the Cytoskeleton 46 (2): 73–94. doi:10.1002/1097-0169(200006)46:2<73::AID-CM1>3.0.CO;2-0. ببمد 10891854.
- Heuser J (Dec 2002). "Whatever happened to the 'microtrabecular concept'?". Biology of the Cell / Under the Auspices of the European Cell Biology Organization 94 (9): 561–96. doi:10.1016/S0248-4900(02)00013-8. ببمد 12732437.
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
