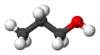
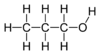
1-بروبانول
1- بروبانول أحد الكحولات ويكون الكحول أولياً إذا كانت مجموعة OH على أول ذرة كربون في الكحول. ويسمى الكحول حينئذ (1 ـ الكانول) .
| 1-بروبانول | |
|---|---|
1-بروبانول | |
 1-بروبانول |
 1-بروبانول |
| الاسم النظامي (IUPAC) | |
بروبان-1-ول[1] | |
| المعرفات | |
| رقم CAS | 71-23-8 |
| بوب كيم (PubChem) | 1031 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C3H8O |
| كتلة مولية | 60.1 غ.مول−1 |
| المظهر | Colorless liquid |
| الكثافة | .803 g/mL |
| نقطة الانصهار | -126 °س، 147 °ك، -195 °ف |
| نقطة الغليان | 97-98 °س، 370-371 °ك، 206-208 °ف |
| الذوبانية في الماء | قابل للامتزاج |
| log P | 0.329 |
| ضغط البخار | 1.99 kPa (at 20 °C) |
| حموضة (pKa) | 16 |
| القاعدية (pKb) | −2 |
| معامل الانكسار (nD) | 1.387 |
| اللزوجة | 1.938 mPa s |
| عزم جزيئي ثنائي القطب | 1.68 D |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−302.79–−302.29 kJ mol-1 |
| تغير الإنتالبي القياسي للاحتراق ΔcH |
−2.02156–−2.02106 MJ mol-1 |
| إنتروبيا مولية قياسية S |
192.8 J K−1 mol−1 |
| الحرارة النوعية، C | 143.96 J K−1 mol−1 |
| المخاطر | |
| رمز الخطر وفق GHS |  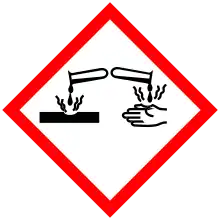  |
| وصف الخطر وفق GHS | DANGER |
| بيانات الخطر وفق GHS | H225, H318, H336 |
| بيانات وقائية وفق GHS | P210, P261, P280, P305+351+338 |
| فهرس المفوضية الأوروبية | 603-003-00-0 |
| ترميز المخاطر |  F F
 Xi Xi |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
3
1
0
|
| نقطة الوميض | 22 °C |
| درجة حرارة الاشتعال الذاتي |
371 °C |
| حدود الاشتعال | 13.7% |
| مركبات متعلقة | |
| مركبات ذات علاقة | Butane Propanamine |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
CH3CH2CH2OH.
البروبانول: يعرف أيضًا باسم الكحول البروبيلي ، ويحتوي على مجموعة واحدة من الهيدروكسيل
- الصيغتة الكيميائية: C3H8O.
وهنالك صورتان للبروبانول يعرفان بالمتماكبات.
- والمتماكبات مركبات كيميائية تحتوي على أنواع وأعداد متماثلة من الذرات ولكنها مختلفة من حيث التركيب الجزيئي ، وبالتالي من حيث الخصائص الكيميائية والفيزيائية.
- فمثلا يغلي أحد مماكبات البروبانول المعروف باسم البروبانول العادي أو 1ـ بروبانول أو الكحول البروبيلي العادي عند 98°م ويتجمد عند - 126°م.
- أما المماكب الآخر المعروف باسم الآيسوبروبانول أو 2ـ البروبانول أو الكحول الآيسوبروبيلي فيغلي عند 83°م ويتجمد عند -88°م،
الخواص الكيميائية
- تتميز الرابطة بين الأوكسجين والهيدروجين في مجموعة الهيدروكسيل بالقطبية وبذلك تنعكس هذه الخاصية على خواص الكولات :
- تغلي الكولات عند درجات غليان عالية مقارنة بالهيدروكربونات المطابقة ويعزى الارتفاع في درجة الغليان لتكوين روابط هيدروجينية بين الجزيئات مع بعضها البعض
- تذوب الكحولات البسيطة في الماء وتقل الذوبانية بازدياد الوزن الجزيئي
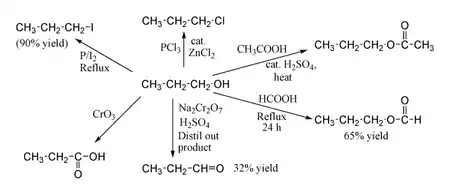
التحضير
يصنع البروبانول العادي تجاريا من الإثيلين والغاز الاصطناعي وهو خليط من الهيدروجين وأول أكسيد الكربون في وجود حفاز هو الروديوم أو الكوبالت ، يستخدم الكحول البروبيلي في تحضير مواد كيميائية أخرى ، كما يستخدم مذيبًا للمواد اللاصقة المعروفة باسم الراتينج ، ينتج الآيزوبروبانول بتفاعل غاز البروبيلين وهو أحد مكونات خام البترول مع الماء في وجود فلز أو حامض بمثابة حفاز ، ويستخدم أساسًا في إنتاج الأسيتون (وهو مذيب صناعي معروف) كما يُستخدم للتنظيف وفي صناعة مستحضرات التجميل ومحاليل الغسيل. .[2]
- H2C=CH2 + CO + H2 → CH3CH2CH=O
- CH3CH2CH=O + H2 → CH3CH2CH2OH
تفاعلات الكحولات
- 1/ حمضية الكحولات (تكوين الأملاح)
نجد إن الكحول يشبه الماء في تركيبه ، لذلك يتفاعل مع فلزات المجموعة الأولى والثانية في الجدول الدوري ولكن بسرعة ابطا مقارنة بتفاعل الماء.
- 2/ تفاعل الكحولات مع هاليدات الهيدروجين
عند تفاعل الكحولات مع هاليدات الهيدروجين تتكون هاليدات الالكيل، ويتم التفاعل في وجود الحمض ونجد أن فاعلية الكحولات تجاه هاليدات الهيدروجين تكون كالأتي :الاولية ˃ الثانوية ˃الثالثية. فالكحول الثالثي يتفاعل مع حمض الهيدروكلوريك المخفف عند درجة حرارة الغرفة ، أما الكحول الأولي لا يتفاعل إلا مع حمض الهيدروكلوريك المركز مع التسخين.
- 3/ انتزاع الماء من الكحولات
يتم انتزاع الماء من الكحول لتكوين الالكين المقابل وذلك عند درجات حرارة عالية وبوجود تركيز عالي من حمض مثل الكبريتيك 0 ونجد أن الكحول الثالثي يتفاعل بسرعة أكثر مقارنة بالثانوي والأولي.
4/تكوين الاسترات
المراجع
- "1-Propanol - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Inتنسيقion. 26 مارس 2005. Identification and Related Records. مؤرشف من الأصل في 09 فبراير 2014. اطلع عليه بتاريخ 10 أكتوبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Anthony J. Papa "Propanols" in Ullmann’s Encyclopedia of Industrial Chemistry 2011, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_173.pub2
قراءات اضافية
- Furniss, B. S.; Hannaford, A. J.; Smith, P. W. G.; Tatchell, A. R. (1989), Vogel's Textbook of Practical Organic Chemistry (الطبعة 5th), Harlow: Longman, ISBN 0-582-46236-3 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) CS1 maint: ref=harv (link) - CRC Handbook of Chemistry and Physics, 87th الطبعة (الطبعة 87). TF-CRC. 2006-06-26. ISBN 0-8493-0487-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Maryadele J. O'Neil, المحرر (2006-11-03). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (الطبعة 14). Merck. ISBN 0-911910-00-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Perkin, W. H.; Kipping, F. S (1922). Organic Chemistry. London: W. & R. Chambers. ISBN 0-08-022354-0. الوسيط
|CitationClass=تم تجاهله (مساعدة)

