ورم ليفي عصبي
الورم الليفي العصبي (بالانجليزية:neurofibroma) ورم حميد صبغي جسدي سائد الوراثة ينشأ من غلاف الأعصاب في الجهاز العصبي الطرفي. في 90% من الحالات وجد أنها أورام قائمة بذاتها في حين أن الباقي كانت في الأشخاص الذين يعانون من الورم الليفي العصبي من النوع الأول. تنشأ الأورام الليفية العصبية من خلايا شوان غير المفرزة للميالين حيث بحدث تثبيط للأليلين لجين NF1 والذي يتم تشفيره لبروتين النيوروفيبرومين.[1]
| ورم ليفي عصبي | |
|---|---|
.jpg.webp) صورة هستولوجية لورم ليفي عصبي جلدي. | |
| معلومات عامة | |
| الاختصاص | علم الأورام |
الأنواع
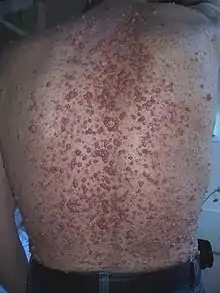
تم تقسيم الأورام الليفية العصبية إلى فئتين رئيسيتين: الجلدية والضفيرية. ترتبط الأورام الليفية العصبية الجلدية بعصب طرفي واحد، في حين ترتبط الأورام الليفية العصبية الضفيرية بحزم عصبية متعددة. ووفقا لنظام تصنيف منظمة الصحة العالمية، تعتبر الأورام الليفية العصبية الجلدية والضفيرية أورام درجة أولى. الورم الليفي العصبي الضفيري أكثر صعوبة في علاجه، ويمكن أن يتحول إلى أورام خبيثة. بينما لا يتحول الورم الليفي العصبي الجلدي إلى ورم خبيث.
التشريح
تنشأ الأورام الليفية العصبية الجلدية في الأعصاب الموجودة في الجلد. تتميز بثلاثة أنواع:[2]
- أورام ليفية عصبية جلدية منفصلة: كتل لاطئة "لا عنقية" أو مُسوقة "ذات عنق" على سطح الجلد، وتكون لحمية وغير مؤلمة وتختلف في الحجم.
- أورام ليفية عصبية تحت جلدية منفصلة: تقع تحت الجلد وتظهر كتحاديب "bumps" على سطح الجلد، أحياناً تكون مؤلمة.
- أورام ليفية عصبية عقيدية عميقة: تشمل أنسجة وأعضاء تحت أدمة الجلد، لكن فيما عدا ذلك فإنها تشبه النوعين السابقين.
سن البدأ
تنشأ الأورام الليفية العصبية الجلدية عادة في سنوات المراهقة وترتبط كثيراً مع بداية سن البلوغ. تستمر في الازدياد في العدد والحجم طوال مرحلة البلوغ، ولكن على الرغم من ذلك فإن هناك حدوداً لمدى ضخامة ما قد تصل إليه.
المضاعفات الطبية
من الممكن أن تؤدي الأورام الليفية العصبية إلى: وخز، حكة، ألم، وتشوه.
لا يوجد دليل على تحولها إلى أورم خبيثة.[1]

التشريح
من الممكن أن تنمو الأورام الليفية العصبية الضفيرية من أعصاب في الجلد أو من حزم عصبية أكثر عمقاً. من الصعب جداً إزالة الأورام الليفية العصبية الغائرة بالكامل لأنها تمتد خلال طبقات عديدة من الأنسجة وبالتالي فمحاولة إزالتها قد تُتلِف أنسجة وأعضاء سليمة.
سن البدأ

تظهر الأورام الليفية العصبية الضفيرية في سن أبكر ويُعتقد بأنها أمراض خلقية.[2]
الأسباب
جين نيوروفيبرومين 1 "NF1"
يتكون NF1 من 60 إكسون يمتد عبرهم 350 كيلوبايت من البيانات الجينومية، وخرائط للمنطقة الكروموسومية 17qll.2.[5] يترجم هذا الجين لبروتين النيوروفيبرومين وهو بروتين سيتوبلازمي كبير يتكون من 2818 حمض أميني وثلاثة إكسونات مترابطة على التوالي (9a, 23a and 48a) في الجين المشفر.
خلايا شوان
يوجد نوعين من خلايا شوان، ميالينية وغير ميالينية. تقوم خلايا شوان الميالينية بتغطية الأعصاب الطرفية كبيرة القطر (أكبر من 1 ميكرومتر) بالميالين، في حين أن غير الميالينية تقوم بإحاطة الأعصاب الطرفية صغيرة القطر بزوائدها السيتوبلازمية. خلايا شوان غير الميالينية هي العنصر الورمي في الورم الليفي العصبي. هذا التكتل بين خلايا شوان غير الميالينية والمحاور يعرف باسم حزمة ريماك.
التشخيص
تحليل دم لاكتشاف بروتين "melanoma inhibitory activity" من الممكن استخدامه في تحديد وجود الاورام الليفية العصبية.[6][7]
العلاج
الورم الليفي العصبي الجلدي
لا يتم ازالتها جراحياً في الغالب إلا إذا أصبحت مؤلمة أو مشوِهة، لأنه على العموم يوجد الكثير منها كما أنها ليست خطرة. يتم استخدام ليزر ثاني أكسيد الكربون في إزالة الأورام اللبفية العصبية في ورقة بحثية بعنوان "الندوب الضخامية بعد معالحة أورام ليفية عصبية جلدية عديدة باستخدام ليزر ثاني أكسيد الكربون" قال Ostertag et al. بأن "التشوه يعتبر هو المعضلة الوحيدة التي تقف أمام اتخاذ القرار بمعالحة الأعراض الجلدية للورم الليفي العصبي. ولكن يظل العلاج باستخدام ليزر ثاني أكسيد الكربون الخيارالأمثل. ومع ذلك، ينصح بشدة بعمل علاج تجريبي لاختبار مدى فعالية الاجراء وما إذا كان الندب المتكون مقبول."
الجراحة
بداية من عام 2002، اعتبرت الجراحة هي الخيار المبدأي في علاج الأوران الليفية العصبية الضفيرية.
إزالة مثل هذا الورم قد يكون صعباً لأنه قد يصل لأحجام كبيرة ويتخطى حدود الأنسجة. ومع ذلك يتم إزالة الورم الليفي العصبي الضفيري -على الرغم من الألم- نتيجة احتمالية تحوله لورم خبيث.
الأمثلة التالية توضح أن الأورام الليفية العصبية قد تنشأ في أي مكان مما يحعل إزالتها جراحياً أمراً صعباً:
- ورم ليفي عصبي في البطين الأيسر. تم ازالته وتم اتسبدال الصمام المترالي.
- فتاة تبلغ من العمر 14 عشر عاماً مصابة بورم ليفي عصبي من النوع الأول تم تشخيصها بورم ليفي عصبي في مثانتها، وهو مكان نادر.
العلاج الاشعاعي
من الممكن استخدام العلاج الإشعاعي والكيميائي في علاج الورم الليفي العصبي الضفيري في حال تحوله إلى ورم خبيث. ومع ذلك لا يتم استعمال الإشعاع في علاج الورم الليفي العصبي الضفيري نتيجة لمخاوف أن نفس ذات العلاج الإشعاعي قد يساعد على تحوله لورم خبيث.
الأبحاث
يوجد العديد من الأدوية تحت الاختبار لعلاج الأورام الليفية العصبية.[8][9] وهي في مراحل مختلفة من البحث، وسنحتاج المزيد من الوقت لتحديد ما إذا كانت خيارات ممكنة لعلاج الأورام الليفية العصبية.
يتم دراسة مزج erlotinib مع سيروليمس لعلاج الأورام الدبقية ذات الدرجة المنخفضة "low grade glioma".[10]
انظر أيضاً
المراجع
- Muir D, Neubauer D, Lim IT, Yachnis AT, Wallace MR (2003). "Tumorigenic properties of neurofibromin-deficient neurofibroma Schwann cells". American Journal of Pathology. 158 (2): 501–13. doi:10.1016/S0002-9440(10)63992-2. PMC 1850316. PMID 11159187. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Case Based Pediatrics For Medical Students and Residents: Chapter XVIII.11. Neurofibromatosis", by Vince K. Yamashiroya, MD. August, 2002. Department of Pediatrics, University of Hawaii John A. Burns School of Medicine. نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين.
- Kluwe L, Hagel C, Mautner V (April 2007). "Neurofibroma". مؤرشف من الأصل في 20 أكتوبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mautner VF, Friedrich RE, von Deimling A, Hagel C, Korf B, Knöfel MT, Wenzel R, Fünsterer C (2003). "Malignant peripheral nerve sheath tumours in neurofibromatosis type 1: MRI supports the diagnosis of malignant plexiform neurofibroma". American Journal of Pathology. 45 (9): 618–25. doi:10.1007/s00234-003-0964-6. PMID 12898075. الوسيط
|CitationClass=تم تجاهله (مساعدة) - MH Shen; PS Harper; M Upadhyaya. (1996). "Molecular genetics of neurofibromatosis type 1 (NF1)". Journal of Medical Genetics. 33 (1): 2–17. doi:10.1136/jmg.33.1.2. PMC 1051805. PMID 8825042. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Rare genetic condition tracked down with potential new biomarker". خدمة المعلومات البحثية والتنمية المجتمعية News. 4 July 2011. مؤرشف من الأصل في 12 أكتوبر 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kolanczyk M, Mautner V, Kossler N, et al. (2011). "MIA is a potential biomarker for tumour load in neurofibromatosis type 1". BMC Medicine. 9: 82. doi:10.1186/1741-7015-9-82. PMC 3224593. PMID 21726432. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- Viskochil, David (2010). "Neurofibromatosis 1: Current Issues in Diagnosis, Therapy, and Patient Management" (PDF). Denver: Mountain States Genetic Foundation. مؤرشف من الأصل (PDF) في 6 نوفمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Klesse, Laura (2010). "Current Therapies for Neurofibromatosis Type 1" (PDF). Denver: Mountain States Genetic Foundation. مؤرشف من الأصل (PDF) في 9 مارس 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - ["Tarceva/Rapamycin for Children With Low-Grade Gliomas With or Without Neurofibromatosis Type 1 (NF1" Children's Research Institute study NCT00901849
وصلات خارجية
- DermAtlas 67
- "Neurofibroma" في معجم دورلاند الطبي
- بوابة طب
