معايرة أكسدة-اختزال
معايرة أكسدة-اختزال في الكيمياء (بالإنجليزية: Redox titration ) هي طريقة في الكيمياء لتعيين تركيز محلول عن طريق المعايرة.[1] ويمكن بواسطتها تعيين محتويات وتركيب مادة تكون قابلة للأكسدة أو للاختزال. كلمة Redox الإنجليزية هي اختصار لكلمتين :Reduction "اختزال" و oxidation "أكسدة" .
مقــدمة
لتعيين كمية مادة بواسطة الأكسدة نقطر محلولا عياريا (معروف التركيز) في قارورة تحتوي على المادة المراد أكسدتها فيتفاعل المحلولان في تفاعل أكسدة-اختزال. تتاكسد المادة في القارورة رويدا رويدا مع زيادة قطرات المحلول العياري المضاف حتى تكتمل الأكسدة أو الاختزال ، وعندئذ لا تجد نقطة من محلول المعايرة المضافة مادة تتفاعل معها في محلول القارورة . تلك هي النقطة الواجب ملاحظتها لتعيين كمية محلول المعايرة المستهلكة من السحاحة. بعد ذلك نقوم بقياس تلك الكمية على تدريج السحاحة ، ومنها نقوم بحساب كمية المادة المجهولة في محلول القارورة (انظر معايرة).
من التفاعلات التي تجري تدريسها في الجامعات في معايرة الأكسدة-اختزال قياس المعايرة بإضافة محلول البروميد كمادة مؤكسدة Bromation :
- إضافة البروميد (حالة الأكسدة : +5) و ايونات البروميد (أكسدة : -1) فيتحول إلى بروم ( أكسدة : 0)
كما يستخدم أيضا تفاعل البرمنجنات كمادة مؤكسدة Permanganation مع المحلول المراد معايرته:
- عيارية أكسدة-اختزال باستخدام البرمنجنات بواسطة (حالة أكسدة : +7) مع الحديد II-أيونات الحديد .
كما تستخدم طريقة المعايرة باستخدام أيونات السيريوم ذات التكافؤ الرباعي لأكسدة المادة المرغوب تعيين كميتها :
- أكسدة أيونات الحديد (II) بواسطة أيونات السيريوم ( Cer(IV الرباعي التكافؤ .
وقد قل استخدام ثنائي كرومات البوتاسيوم لمحلول معاير ، كان يستخدم كمادة مؤكسدة:
في هذا التفاعل يمكن استخدام كاشف لوني مثل ديفينيلامين Diphenylamin .[2]
التعرف على نقطة اكتمال التفاعل
باللون الذاتي
تستخدم طريقة تعيين نقطة اكتمال التفاعل باستخدام معايرة المنجنيز (KMnO4) أو معايرة اليود حيث يستخدم قليل من النشا مع اليود حيث يكون اليود مع النشا مركب ملون . كلا من طريقة المنجنيز وطريقة اليود في المعايرة تسنخدم لأن اللون الذاتي للمحلول يتغير فجأة عند نقطة اكتمال التفاعل .
باستخدام كاشف لوني
يمكن استخدام كواشفا لونية من نوع كواشف أكسدة-اختزال تتميز بتغير لونها بالإكسدة أو الاختزال مثل الفريون Ferroin ، وهو مركب من خلات الحديد . كذلك يمكن استخدام كواشف عادية مثلما في طريقة البروم Bromatometry حيث يحدد تغير لون الكاشف نقطة اكتمال التفاعل .
طريقة قياس الجهد الكهربي
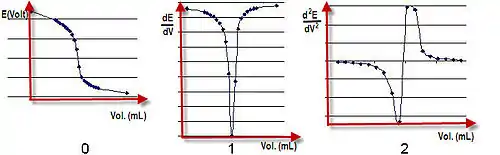
يتغير الجهد الكهربي بين المحلول وقطب قياسي (مثل قطب زجاجي) خلال عملية المعايرة . وعند إجراء ذلك نقوم بقراءة الجهد وتسجيله خلال المعايرة واعتماده على حجم محلول السحاحة المستخدم ، فنحصل من تلك القيم على منحنى للمعايرة ، ومنه نحصل على نقطة اكتمال التفاعل .
المعايرة بمقياس الجهد (Potentiometric titration) هي تقنية في الكيمياء التحليلية تستخدم في معايرة تفاعلات أكسدة-اختزال وذلك دون استخدام مؤشر إنما بالاعتماد على قياس الجهد الكهربائي في المادة المراد تحليلها، والتي غالباً ما تكون محلولاً كهرلياً.
للقيام بذلك، يستخدم قطبان كهربائيان، أحدهما يسمى القطب المؤشر (الدليل) والآخر هو القطب القياسي (أو المرجعي). يشكل القطب المؤشر مع الأيونات محط الدراسة نصف خلية كهركيميائية، والتي تشكل النصف الآخر مع القطب القياسي. من أمثلة الأقطاب القياسية القطب القياسي للهيدروجين وقطب كالومل المشبع وقطب كلوريد الفضة.
يحسب الجهد الكهربائي الكلي وفق العلاقة:
- Ecell = Eind - Eref + Esol.
حيث: Eind كمون أو جهد القطب المؤشر و Eref كمون أو جهد القطب القياسي، في حين أن Esol هو الفرق في قيمة الجهد للمحلول بين القطبين، والتي تقاس على فترات منتظمة عند المعايرة.
يرسم مخطط بياني للجهد الكهربائي مقابل الحجم المضاف، ويمكن تحديد انتهاء المعايرة بأنها منتصف المسافة للقفزة في الجهد على المخطط.
اقرأ أيضا
المراجع
- قالب:Gold Book
- Jander/Jahr/Knoll: Maßanalyse, Sammlung Göschen Band 221/221a, Walter de Gruyter Berlin 1966
- بوابة الفيزياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء
