مخطط عبارات
مخطط العبارات في فيزياء الذرة (بالإنجليزية: Termchart) أو مخطط مستويات طاقة ذرة، هو رسم بياني تسجل فيه عبارات تصف مستويات الطاقة لذرة، أو أيون، أو جزيء، أو نواة الذرة، بطريقة مبسطة توضيحية.[1]
تكوينها
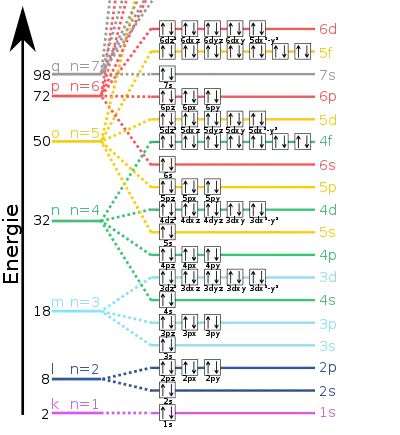
يرسم على المحور الرأسي الأغلفة والرئيسية والثانوية للإلكترونات في الذرة (أو النظام) كمستويات طاقة، ويعطي المحور الأفقي عدد الإلكترونات. ويبدأ عد الأغلفة الرئيسية من النواة إلى الخارج بالرقم 1 (وقد يستخدم بدلا منها حروفا أبجدية، نعرفها من المطيافية). ويوافق أعلى غلاف في النظام دورة العنصر في الجدول الدوري للعناصر.
لكل ذرة منظومة بناء من الإلكترونات. وكلما بعد غلاف عن النواة تزداد طاقة إلكترون موجود فيه.
يبسط مخطط العبارات نظام يحتوي على إلكترون واحد، فهو يكتفي بسلم واحد للطاقات. ولكن بالنسبة لأنظمة تتعدد فيها الإلكترونات فتتعدد فيها سلالم الطاقات، فقد تكون متداخلة أو بجانب بعضها.
قواعد
ترسم طاقة كل عبارة كخط أفقي بحيث يكون خط الحالة القاعية هو الخط السفلي ويكون بعيدا عن المستويات الأخرى. وعند شغل الأغلفة المدارية نتبع قاعدة هوند وهي تقول: "أن المدارات ذات طاقات متساوية تُشغل أولا بإلكترونات لها نفس الزخم المغزلي Spin، وذلك قبل بدء شغلها بإلكترونات معكوسة الزخم المغزلي."
يملأ الغلاف الأول s بإلكترونين معكوسي الزخم المغزلي. الإلكترون الثالث في ذرة الليثيوم يشغل المدار 2s. في البريليوم ذو 4 إلكترونات: يشغل الكترونان معكوسي المغزلية الغلاف 1s، ويشغل الإلكترونان الآخران الغلاف 2s ويكونان معكوسي المغزلية. وتأتي بعد ذلك ذرة البورون (طبقا لتسلسل الجدول الدوري) وفيها خمسة إلكترونات: الأربعة إلكترونات الأولى تشغل المدارات كما في حالة البريليوم، أما الإلكترون الخامس فيصعد إلى الغلاف 2p. يمكن أن يحوي الغلاف 2p عدد 6 إلكترونات حتى يكتمل. يحدث ذلك مع النيون (عدده الذري 10)، ويكون كل اثنين من الإلكترونات معكوسي الزخم المغزلي في الغلاف 2p وهو غاز نبيل.
يأتي بعد النيون في الجدول الدوري الصوديوم وله 11 إلكترون في أغلفته. 10 من هذه الإلكترونات تشغل مستويات الطاقة مثلها مثل النيون، والإلكترون الأخير يشغل الغلاف 3s (انظر مخطط العبارات). فيكون التوزيع الإلكتروني للإلكترونات في ذرة الصوديوم كالآتي: نيون 3s1.
الذرات التي تشغل الإلكترونات الخارجية فيها الغلاف 4f تنتمي إلى مجموعة لانثانيدات، بينما تلك التي تشغل فيها الإلكترونات الغلاف 5f فهي تنتمي إلى مجموعة اكتينيدات.
الانتقالات
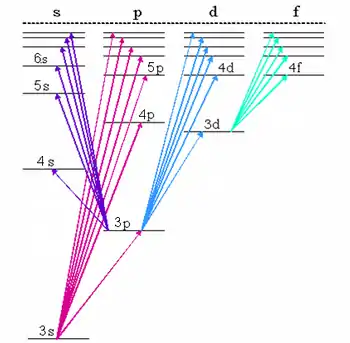
عند انتقال الإلكترون من عبارة عليا إلى عبارة سفلى (مستوى طاقة سفلي) تُعبّر المسافة بينهما عن مقدار الطاقة التي يشعها الإلكترون في هيئة فوتون (شعاع ضوئي). وينتج عن هذا الانتقال خطا معينا في خطوط الطيف. ولكن ليست جميع الانتقالات مسموح بها، فبعضها ممنوع على أسس تفسره لنا ميكانيكا الكم. فالانتقالات الممنوعة لا نجد لها خطوطا في الطيف (أنظر قواعد اختيار).
مخطط جروتريان للهيدروجين
يسمى مخطط العبارات أيضا مخطط جروتريان، تكريما للعالم الفلكي الألماني "فالتر جروتريان" الذي كان يدرس الأطياف وقام بابتكار مخطط العبارات.
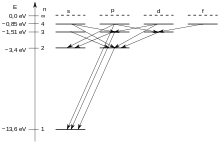
يبين مخطط جروتريان الانتقالات المسموحة بين مستويات الطاقة المختلفة للذرة. ويمكن رسمها واستخدامها لذرة فيها إلكترون واحد أو لذرة بعدة إلكترونات. وتأخذ المخططات قواعد الاختيار في الاعتبار، وهي قواعد متعلقة بما هو مسموح به أو غير مسموح بالنسبة لتغير الزخم الزاوي للإلكترون.
اقرأ أيضا
مراجع
- Grotrian, Walter (1928). M. Born, J. Franck (المحررون). Graphische Darstellung der Spektren von Atomen und Ionen mit ein, zwei und drei Valenzelektronen: Zweiter Teil. (باللغة الألمانية). 7. Berlin: سبرنجر. مؤرشف من الأصل في 22 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: يستخدم وسيط المحررون (link)
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة ميكانيكا الكم
