لا فلز
في الكيمياء ، العنصر اللافلزي (أو غير المعدني) هو عنصر كيميائي يفتقر في الغالب إلى الخصائص المعدنية. فيزيائيًا يميل العنصر اللافلزي إلى أن يكون له نقطة انصهار ونقطة غليان وكثافة منخفضة نسبيًا.
فضلًا أزل القالب لو لم تُجرى أي تعديلات كبيرة على الصفحة في آخر شهر. لو كنت أنت المحرر الذي أضاف هذا القالب وتُحرر المقالة بشكلٍ نشطٍ حاليًّا، فضلًا تأكد من استبداله بقالب {{تحرر}} أثناء جلسات التحرير النشطة.
آخر من عدل المقالة كان JarBot (نقاش | مساهمات) منذ 4 ثوانٍ (تحديث)
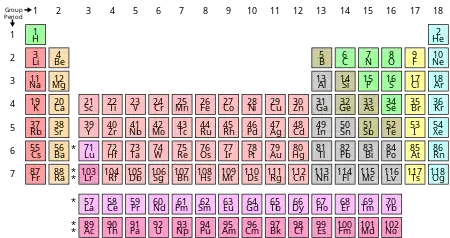
عادةً ما يكونُ اللافلز هشًا في الحالة الصلبة ولديه توصيل حراري وموصلية كهربائية ضعيفة جدا . كيميائيًا ، تميل اللافلزات إلى امتلاك طاقة تأين وألفة إلكترونية وكهرسلبية عالية نسبيًا.
تكتسب اللافلزات الإلكترونات أو تتشارك بها عندما تتفاعل مع العناصر والمركبات الكيميائية الأخرى. هناك سبعة عشر عنصرًا صُنِّفت بشكل عام على أنها غيرُ فلزية معظمها غازات وهي: (الهيدروجين ، والهيليوم ، والنيتروجين ، والأكسجين ، والفلور ، والنيون ، والكلور ، والأرجون ، والكريبتون ، والزينون ، والرادون) ؛ وسائل واحد وهو البروم ؛ والقليل من المواد الصلبة (الكربون والفوسفور والكبريت والسيلينيوم واليود). تُعامل الفلزات مثل البورون والسيليكون والجرمانيوم أحيانًا على أنها لا فلزات.[1]
تنقسم اللافلزات إلى مجموعتين بحسب مدى ميلها النسبي لتكوين مركبات كيميائية وهما : اللافلزات التفاعلية والغازات النبيلة. تختلف اللافلزات التفاعلية في خصائصها الغير معدنية. العناصر التي لها كهرسلبية قليلة ( مثل الكربون والكبريت) ، تحتوي في الغالب على خصائص غير معدنية ضعيفة إلى متوسطة القوة وتميل إلى تكوين مركبات تساهمية مع المعادن، أما اللافلزات التفاعلية الأكثر كهرسلبية ( مثل الأكسجين والفلور) فتتميز بخصائص غير معدنية أقوى وتميل لتشكيل مركبات أيونية مع المعادن في الغالب. بينما تتميز الغازات النبيلة بخمولها عن تكوين مركبات مع عناصر أخرى.
التمييز بين المجموعتين ليس مطلقا. حيث تحدث تداخلات بين الخصائص (بما في ذلك مع أشباه الفلزات) مما يؤدي إلى ظهور خصائص أقل تميزًا أو شبيهة بالهجين أو غير نمطية. على الرغم من أن عدد العناصر اللافلزية تزيد بخمس مرات عن العناصر اللافلزية ، إلا أن اثنين من اللافلزات - الهيدروجين والهيليوم - يشكلان أكثر من 99 بالمائة من الكون المرئي.[2] ويشكل الأكسجين الآخر اللافلزي ما يقرب من نصف قشرة الأرض والمحيطات والغلاف الجوي. [3] تتكون الكائنات الحية بشكل شبه كامل من اللافلزات: الهيدروجين والأكسجين والكربون والنيتروجين.[4] تشكل اللافلزات مركبات أكثر بكثير من المعادن. [5]
التعريف
لا يوجد تعريف دقيق لللافلزات. بشكل عام ، يمكن اعتبار أي عنصر يفتقر إلى الخصائص المعدنية على أنه لا فلز.
تشمل العناصر المصنفة عمومًا على أنها غير فلزية عنصرًا واحدًا في المجموعة 1 (الهيدروجين) ؛ واحد في مجموعة الكربون وهو الكربون ؛ اثنان في مجموعة النتروجين (النيتروجين والفوسفور) ؛ ثلاثة في مجموعة الكالكوجين 16 (الأكسجين والكبريت والسيلينيوم) ؛ ومعظم عناصر مجموعة الهالوجينات (الفلور والكلور والبروم واليود) ؛ وجميع عناصر مجموعة الغازات النبيلة (مع استثناء محتمل لغاز الأوغانيسون).
ونظرًا لعدم وجود تعريف متفق عليه على نطاق واسع لللافلزات ، لذا يتم تصنيف العناصر الموجودة في الجدول الدوري المجاور للمكان الذي تلتقي فيه المعادن باللافلزات بشكل غير متسق من قبل علماء مختلفين. العناصر المصنفة أحيانًا على أنها لا فلزية هي: البورون (B) ، السيليكون (Si) ، الجرمانيوم (Ge) ، الزرنيخ (As) ، الأنتيمون (Sb) ، التيلوريوم (Te) ، والأستاتين (At). يُصنف السيلينيوم غير المعدني (Se) أحيانًا على أنه شبه فلز ، خاصة في الكيمياء البيئية.
الخصائص
تُظهر اللافلزات تباينًا في خصائصها أكثر من المعادن.[6] يتم تحديد هذه الخصائص من خلال قوى الترابط بين الذرات والتراكيب الجزيئية لذلك اللافلز ، وكلاهما يتغير عندما يختلف عدد إلكترونات التكافؤ في اللافلز. بالمقابل ، تمتلك المعادن بنية أكثر تجانسًا ويمكن التوفيق بين خصائصها بسهولة أكبر. [7]
من الناحية الفيزيائية ، تتواجد اللافلزات بشكل كبير كغازات ثنائية الذرة أو أحادية الذرة ، أما الباقي فهو موجود بأشكال أكثر متانة (معبأة مفتوحة) على عكس المعادن التي تكون كلها تقريبًا صلبة ومعبأة بشكل وثيق. عندما تكون اللافلزات في الحالة الصلبة ، فإنها تكون ذات مظهر شبه معدني (باستثناء الكبريت) وتكون في الغالب هشة ، على عكس المعادن التي تكون براقة لها قابلية للسحب والطرق أو التشكيل بشكل عام؛ عادة ما يكون للافلزات كثافة أقل من المعادن ؛ وموصلية قليلة للحرارة والكهرباء ؛ وتميل إلى أن تكون نقاط انصهارها وغليانها أقل بكثير من تلك الخاصة بالمعادن.
كيميائيًا ، تحتوي اللافلزات في الغالب على طاقات تأين عالية ، وألفة إلكترونية عالية (قيمة الألفة إلكترونية للنيتروجين والغازات النبيلة تكون سالبة) وقيم كهرسلبية عالية مع ملاحظة أنه بشكل عام ، كلما زادت طاقة التأين للعنصر والألفة الألكترونية والكهرسلبية كلما اقترب هذا العنصر من خصائص اللافلزات. [8] عادة ما توجد اللافلزات (بما في ذلك - إلى حد محدود - الزينون وربما الرادون) كأنيونات أو أوكسينات في محلول مائي ؛ تشكل اللافلزات بشكل عام مركبات أيونية أو تساهمية عندما تتفاعل مع المعادن (على عكس المعادن ، التي تشكل في الغالب سبائك عند تفاعلها مع معادن أخرى) ؛ ولها أكاسيد حمضية في حين أن الأكاسيد الشائعة لجميع المعادن تقريبًا قاعدية.
اقرأ أيضا
مراجع
- Kratz, J. V. (5 September 2011). The Impact of Superheavy Elements on the Chemical and Physical Sciences (PDF). 4th International Conference on the Chemistry and Physics of the Transactinide Elements. مؤرشف من الأصل (PDF) في 6 يناير 2017. اطلع عليه بتاريخ 27 أغسطس 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sukys 1999, p. 60. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bettelheim et al. 2016, p. 33. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schulze-Makuch & Irwin 2008, p. 89. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Steurer 2007, p. 7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - BIRTWISTLE, I.; ROGERS, V. (1987-10-06). "ChemInform Abstract: Reaction of Dimethylvinylidene Carbene with Methylpyrroles". ChemInform. 18 (40). doi:10.1002/chin.198740184. ISSN 0931-7597. مؤرشف من الأصل في 10 مارس 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "ROGERS v ROGERS". Victorian Reports. [1972] VR: 935–938. 1972. doi:10.25291/vr/1972-vr-935. ISSN 2208-4886. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pyle, James L. (1977-12). "Chemistry (Yoder, Claude H.; Suydam, Fred H.; Snavely, Fred A.)". Journal of Chemical Education. 54 (12): A497. doi:10.1021/ed054pa497.1. ISSN 0021-9584. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة)
- بوابة العناصر الكيميائية
- بوابة الكيمياء
