كلوريد المنغنيز الثنائي
كلوريد المنغنيز الثنائي تصف سلسلة من المركبات ذات الصيغة MnCl2(H2)x، وتكون قيمة x إما صفر أو 2 أو 4. والشكل رباعي الهيدرات ذو الصيغة MnCl2.4H2O هو الأكثر شيوعاً، مع توفر الملح اللامائي والملح ثنائي الهيدرات ذو الصيغة MnCl2.2H2O أيضاً. وكما هو الحال في الفصائل الأخرى من أملاح المنغنيز الثنائي، يتلون هذا الملح باللون الوردي، وشحوب اللون خاصية المعقد الانتقالي ذي الترتيب الالكتروني d5 واللف المغزلي العالي.[1]
| كلوريد المنغنيز الثنائي | |
|---|---|
 Anhydrous Anhydrous | |
_chloride_tetrahydrate.jpg.webp) Tetrahydrate Tetrahydrate | |
| الاسم النظامي (IUPAC) | |
Manganese(II) chloride | |
| المعرفات | |
| رقم CAS | 7773-01-5 38639-72-4 (dihydrate) 13446-34-9 (tetrahydrate) |
| بوب كيم (PubChem) | 24480 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| الصيغة الجزيئية | MnCl2 |
| الكتلة المولية | 125.844 g/mol (anhydrous) 161.874 g/mol (dihydrate) 197.91 g/mol (tetrahydrate) |
| المظهر | pink solid (tetrahydrate) |
| الكثافة | 2.977 g/cm3 (anhydrous) 2.27 g/cm3 (dihydrate) 2.01 g/cm3 (tetrahydrate) |
| نقطة الانصهار | 654 °C (anhydrous) dihydrate بلمهة at 135 °C tetrahydrate dehydrates at 58 °C |
| نقطة الغليان | 1225 °C |
| الذوبانية في الماء | 63.4 g/100 ml (0 °C) 73.9 g/100 ml (20 °C) 88.5 g/100 ml (40 °C) 123.8 g/100 ml (100 °C) |
| الذوبانية | soluble in بيريدين, إيثانول insoluble in إيثر |
| البنية | |
| البنية البلورية | CdCl2 |
| التنسيق الهندسي [الإنجليزية] | ثماني سطوح |
| المخاطر | |
| فهرس المفوضية الأوروبية | Not listed |
| NFPA 704 |
0
1
0
|
| نقطة الوميض | Non-flammable |
| LD50 | 250-275 mg/kg (rat, oral) |
| مركبات متعلقة | |
| أنيونات أخرى | فلوريد المنغنيز الثنائي Manganese(II) bromide Manganese(II) iodide |
| كتيونات أخرى | Manganese(III) chloride Technetium(IV) chloride Rhenium(III) chloride Rhenium(IV) chloride Rhenium(V) chloride Rhenium(VI) chloride |
| مركبات ذات علاقة | كلوريد الكروم الثنائي كلوريد الحديد الثنائي |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضر كلوريد المنغنيز من تفاعل أكسيد المنغنيز الرباعي مع حمض الهيدروكلوريك المركز.
- MnO2 + 4 HCl → MnCl2 + 2 H2O + Cl2
وقد استخدم هذا التفاعل في تحضير الكلور، ويمكن عن طريق معادلة المحلول الناتج بحذر مع MnCO3 يمكن ترسيب أملاح الحديد انتقائياً، وهي شوائب شائعة في أكسيد المنغنيز.
ويمكن تحضير كلوريد المنغنيز مختبرياً عن طريقة مفاعلة فلز المنغنيز أو كربونات المنغنيز الثنائية مع حمض الهيدروكلوريك:
- Mn + 2 HCl → MnCl2 + H2
- MnCO3 + 2 HCl → MnCl2 + H2O + CO2
الخواص الكيميائية
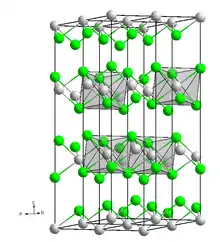
كلوريد المنغنيز اللامائي مبلمر صلب، ويكون على شكل طبقات تشبه تركيب كلوريد الكادميوم، أما الملح رباعي التميؤ فيتألف من جزيئات ثمانية السطح بوضعية ترانز. تذوب أملاح كلوريد المنغنيز المائية في الماء لتعطي محلولاً حامضياً دالته الحامضية تقارب 4.
وهو حمض لويس ضعيف.
المراجع
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- بوابة الكيمياء

