كلوريد الكادميوم
كلوريد الكادميوم مركب كيميائي له الصيغة CdCl2، ويكون على شكل بلورات بيضاء.
| كلوريد الكادميوم | |
|---|---|
 كلوريد الكادميوم | |
 كلوريد الكادميوم | |
| الاسم النظامي (IUPAC) | |
كلوريد الكادميوم | |
| المعرفات | |
| رقم CAS | 10108-64-2 |
| بوب كيم | 24947 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | CdCl2 |
| الكتلة المولية | 183.32 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 4.08 غ/سم3 |
| نقطة الانصهار | 568 °س |
| نقطة الغليان | 960 °س |
| الذوبانية في الماء | 135 غ/100 مل ماء |
| الذوبانية | ينحل في الأسيتون والكحول |
| المخاطر | |
| ترميز المخاطر |  T+ T+
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- لمركب كلوريد الكادميوم انحلالية كبيرة في الماء، حيث ينحل منه حوالي 1400 غ/ل. ولبلوراته خاصة استرطاب عالية، فهي تتسيل عند التماس مع الرطوبة. يوجد منه شكل مائي مرتبط مع جزيئين ونصف من الماء CdCl2 . 2 1/2H2O، أي أن كل جزيئتين من المركب مرتبطة مع خمس جزيئات ماء.[4]
- بوجود زيادة من أيونات الكلور في المحاليل المائية، أو بوجود أسيتونتريل، فإن كلوريد الكادميوم يشكل معقد من 2−[CdCl4] ، الذي له بنية جزيئية رباعية الوجوه:
- CdCl2 (aq) + 2 Cl− (aq) → [CdCl4]2− (aq)
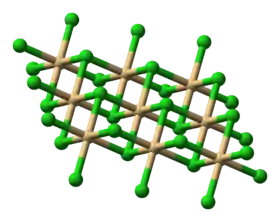
البنية
لمركب كلوريد الكادميوم بنية بلورية تتبع النظام البلوري الثلاثي، بحيث أن أيونات الكلوريد ترتص على بعضها البعض مشكلة طبقة من الأنيونات، في حين أن كاتيونات الكادميوم توجد في الفجوات ثمانية الوجوه بين الطبقات، أي أن كل يون كادميوم تحيط به ست أيونات كلور. وكل أيون كلور يشكل قمة هرم ثلاثي، قاعدته ثلاث ذرات من الكادميوم.
تشبه بنية كلوريد الكادميوم بنية يوديد الكادميوم، وتعد من البنى النمطية.
التحضير
يحضر كلوريد الكادميوم من التفاعل المباشر بين عنصري الكلور والكادميوم عند درجات حرارة مرتفعة، أو من أثر حمض الهيدروكلوريك على فلز الكادميوم، بحيث نحصل على الشكل المائي من كلوريد الكادميوم (هيدرات):
- Cd + 2 HCl → CdCl2 + H2
الاستخدامات
- يستخدم كلوريد الكادميوم من أجل تحضير كبريتيد الكادميوم، والمستعمل في تركيب خضاب الكادميوم، وذلك بتمرير غاز كبريتيد الهيدروجين على محلول كلوريد الكادميوم:
CdCl2 (aq) + H2S (g) → CdS (s) + 2 HCl (aq)
- يستخدم كلوريد الكادميوم مخبرياً لتحضير مركبات الكادميوم العضوية، والتي كانت مستخدمة من أجل تحضير الكيتونات وكلوريدات الأسيل
- CdCl2 + 2 RMgX → R2Cd + MgCl2 + MgX2
- R2Cd + R'COCl → R'COR + CdCl2
إلا أنها استعيضت بمركبات النحاس العضوية الأقل سمية.
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24947 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Cadmium dichloride — الرخصة: محتوى حر
- معرف المكون الفريد: https://fdasis.nlm.nih.gov/srs/unii/J6K4F9V3BA — تاريخ الاطلاع: 14 فبراير 2018 — المحرر: إدارة الأغذية والأدوية — العنوان : Unique Ingredient Identifier
- صفحة البيانات الكيميائية من Alfa [وصلة مكسورة] نسخة محفوظة 17 ديسمبر 2019 على موقع واي باك مشين.
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
