كالكون
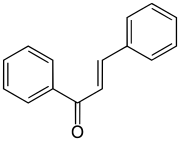
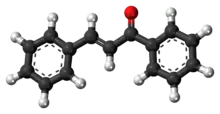
الكالكون هو مركب عضوي عطري غير مشبع صيغته C15H12O، ويوجد على شكل صلب بلوري أصفر.
| كالكون | |
|---|---|
 Skeletal formula of chalcone | |
 Ball-and-stick model of the chalcone molecule | |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
| تسمية الاتحاد الدولي للكيمياء | |
(2E)-1,3-Diphenylprop-2-en-1-one | |
| المعرفات | |
| CAS | 614-47-1 |
| بوب كيم | 637760 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C15H12O |
| الكتلة المولية | 208.26 غ/مول |
| المظهر | صلب أصفر |
| الكثافة | 1.07 غ/سم3 |
| نقطة الانصهار | 55 - 57 °س |
| نقطة الغليان | 346 °س (مزيج من المتصاوغين E و Z) |
| الذوبانية في الماء | غير منحل |
| الذوبانية | كلوروفورم وثنائي إيثيل الإيثر |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
ينتمي الكالكون كيميائياً إلى الكيتونات والإينونات؛ وهو يعد نواة مجموعة من المركبات ذات الأهمية الحيوية التي تعرف باسم الكالكونات (أو الكالكونويدات).
التحضير
يحضر الكالكون بواسطة تكاثف ألدولي بين البنزألدهيد والأسيتوفينون بوجود قاعدة كيميائية مثل هيدروكسيد الصوديوم.[5][6]
يمكن أن يحضر المركب بأسلوب تفاعل الوسط الجاف؛[7] ويعد التفاعل مثالاً على تفاعلات الكيمياء الخضراء.[8][9]
الخواص
يوجد المركب في الشروط القياسية على شكل صلب أصفر، صعب الانحلال في الماء؛ لكنه ينحل في المذيبات العضوية مثل الكلوروفورم وثنائي إيثيل الإيثر؛ للمركب قمتي امتصاص عند 280 نانومتر و 340 نانومتر.[10]
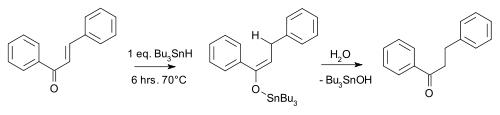
يمكن أن تختزل الرابطة المضاعفة في الكالكون بواسطة هيدريد ثلاثي بوتيل القصدير:[11]
الاستخدامات
يمكن أن يدخل الكالكون في عدة تفاعلات تكاثف بوجود كواشف مناسبة للحصول على مركبات موافقة، مثلما هو الحال في تحضير البيرازولات المستبدلة؛ وذلك إما من التفاعل مع مشتقات الهيدرازين باستخدام حفاز من الكبريت،[12] أو بيركبريتات الصوديوم.[13] كما يمكن أن تحضر تلك البيرازولات المستبدلة من تكاثف الكالكون مع هيدرازون.[14]
مراجع
- "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. صفحة 722. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Merck Index, 11th Edition, 2028
- وصلة : معرف بوب كيم — الرخصة: محتوى حر
- وصلة : معرف بوب كيم
- Dumitru, Sîrbu; Ion, Marin (2011). "SYNTHESIS AND IR, NMR CARACTERISATION OF NEW P-(N,N-DIPHENYLAMINO) CHALCONES". مؤرشف من الأصل في 22 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Gómez-Rivera, Abraham; Aguilar-Mariscal, Hidemí; Romero-Ceronio, Nancy; Roa-de la Fuente, Luis F.; Lobato-García, Carlos E. (2013-10-15). "Synthesis and anti-inflammatory activity of three nitro chalcones". Bioorganic & Medicinal Chemistry Letters (باللغة الإنجليزية). 23 (20): 5519–5522. doi:10.1016/j.bmcl.2013.08.061. ISSN 0960-894X. مؤرشف من الأصل في 22 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Toda, Fumio; Tanaka, Koichi; Hamai, Koki (1990). "Aldol condensations in the absence of solvent: Acceleration of the reaction and enhancement of the stereoselectivity". Journal of the Chemical Society, Perkin Transactions 1 (11): 3207–9. doi:10.1039/P19900003207. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Palleros, Daniel R (2004). "Solvent-Free Synthesis of Chalcones". Journal of Chemical Education. 81 (9): 1345. Bibcode:2004JChEd..81.1345P. doi:10.1021/ed081p1345. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Comisar, Craig M; Savage, Phillip E (2004). "Kinetics of crossed aldol condensations in high-temperature water". Green Chemistry. 6 (4): 227–31. doi:10.1039/b314622g. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Song, Dong-mee; Jung, Kyoung-Hoon; Moon, Ji-hye; Shin, Dong-Myung (2003). "Photochemistry of chalcone and the application of chalcone-derivatives in photo-alignment layer of liquid crystal display". Optical Materials. 21 (1–3): 667–71. Bibcode:2003OptMa..21..667S. doi:10.1016/S0925-3467(02)00220-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Leusink, A.J; Noltes, J.G (1966). "Reaction of organotin hydrides with α,β-unsaturated ketones". Tetrahedron Letters. 7 (20): 2221–5. doi:10.1016/S0040-4039(00)72405-1. hdl:1874/17014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Outirite, Moha; Lebrini, Mounim; Lagrenée, Michel; Bentiss, Fouad (2008). "New one step synthesis of 3,5-disubstituted pyrazoles under microwave irradiation and classical heating". Journal of Heterocyclic Chemistry. 45 (2): 503–5. doi:10.1002/jhet.5570450231. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zhang, Ze; Tan, Ya-Jun; Wang, Chun-Shan; Wu, Hao-Hao (2014). "One-Pot Synthesis of 3,5-Diphenyl-1H-pyrazoles from Chalcones and Hydrazine under Mechanochemical Ball Milling". Heterocycles. 89: 103–12. doi:10.3987/COM-13-12867. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lasri, Jamal; Ismail, Ali I. (2018). "Metal-free and FeCl3-catalyzed synthesis of azines and 3,5-diphenyl-1H-pyrazole from hydrazones and/or ketones monitored by high resolution ESI+-MS". Indian Journal of Chemistry, Section B. 57B (3): 362–373. مؤرشف من الأصل في 15 سبتمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة الكيمياء