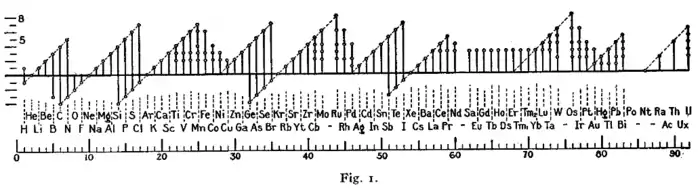
قائمة حالات أكسدة العناصر
هذه هي قائمة لجميع حالات الأكسدة المعروفة حبيبي والله علي المرجاني أبو عطوان جدو الشايب بي جي للعناصر الكيميائية، باستثناء القيم الغير تكاملية. والتأكسد الأكثر شيوعا هي ذات الخط العريض. ويستند هذا الجدول على غرينوود،[1] مع جميع الملاحظات المضافة. حالة التأكسد 0 الموجودة في جميع العناصر مضمنة في العمود مع رمز العنصر. تم تنسيق الجدول على أساس واحد والذي وضعه مندليف عام 1889 ، موضحا بعض اتجاهات الجدول الدوري.
| −1 | هيدروجين | +1 | |||||||||||
| هيليوم | |||||||||||||
| ليثيوم | +1 | ||||||||||||
| بيريليوم | +2 | ||||||||||||
| بورون | +1 | +2 | +3 | ||||||||||
| −4 | −3 | −2 | −1 | كربون | +1 | +2 | +3 | +4 | |||||
| −3 | −2 | −1 | نيتروجين | +1 | +2 | +3 | +4 | +5 | |||||
| −2 | −1 | أكسجين | +1 | +2 | |||||||||
| −1 | فلور | ||||||||||||
| نيون | |||||||||||||
| −1 | Na | +1 | |||||||||||
| مغنسيوم | +1 | +2 | [2] | ||||||||||
| ألومنيوم | +1 | +3 | |||||||||||
| −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | |||||
| −3 | −2 | −1 | فسفور | +1 | +2 | +3 | +4 | +5 | |||||
| −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | كلور | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| آرغون | |||||||||||||
| −1 | بوتاسيوم | +1 | |||||||||||
| كالسيوم | +2 | ||||||||||||
| Sc | +1 | +2 | +3 | ||||||||||
| −1 | Ti | +2 | +3 | +4 | |||||||||
| −1 | V | +1 | +2 | +3 | +4 | +5 | |||||||
| −2 | −1 | كروم | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −2 | −1 | منغنيز | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| −2 | −1 | حديد | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | كوبالت | +1 | +2 | +3 | +4 | +5 | |||||||
| −1 | نيكل | +1 | +2 | +3 | +4 | ||||||||
| نحاس | +1 | +2 | +3 | +4 | |||||||||
| Zn | +1 | +2 | |||||||||||
| غاليوم | +1 | +2 | +3 | ||||||||||
| −4 | جرمانيوم | +1 | +2 | +3 | +4 | ||||||||
| −3 | زرنيخ | +2 | +3 | +5 | |||||||||
| −2 | Se | +2 | +4 | +6 | |||||||||
| −1 | بروم | +1 | +3 | +4 | +5 | +7 | |||||||
| كريبتون | +2 | ||||||||||||
| Rb | +1 | ||||||||||||
| Sr | +2 | ||||||||||||
| Y | +1 | +2 | +3 | [3][4] | |||||||||
| Zr | +1 | +2 | +3 | +4 | |||||||||
| −1 | نيوبيوم | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | موليبدنوم | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| بالاديوم | +2 | +4 | |||||||||||
| Ag | +1 | +2 | +3 | ||||||||||
| كادميوم | +1 | +2 | |||||||||||
| إنديوم | +1 | +2 | +3 | ||||||||||
| −4 | Sn | +2 | +4 | ||||||||||
| −3 | إثمد | +3 | +5 | ||||||||||
| −2 | Te | +2 | +4 | +5 | +6 | ||||||||
| −1 | يود | +1 | +3 | +5 | +7 | ||||||||
| Xe | +2 | +4 | +6 | +8 | |||||||||
| سيزيوم | +1 | ||||||||||||
| باريوم | +2 | ||||||||||||
| لانثانوم | +2 | +3 | |||||||||||
| سيريوم | +2 | +3 | +4 | ||||||||||
| براسوديميوم | +2 | +3 | +4 | ||||||||||
| نيوديميوم | +2 | +3 | |||||||||||
| بروميثيوم | +3 | ||||||||||||
| Sm | +2 | +3 | |||||||||||
| يوروبيوم | +2 | +3 | |||||||||||
| غادولينيوم | +1 | +2 | +3 | ||||||||||
| Tb | +1 | +3 | +4 | ||||||||||
| ديسبروسيوم | +2 | +3 | |||||||||||
| هولميوم | +3 | ||||||||||||
| إربيوم | +3 | ||||||||||||
| Tm | +2 | +3 | |||||||||||
| Yb | +2 | +3 | |||||||||||
| لوتيشيوم | +3 | ||||||||||||
| هافنيوم | +2 | +3 | +4 | ||||||||||
| −1 | Ta | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | −1 | أوزميوم | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| −3 | −1 | إريديوم | +1 | +2 | +3 | +4 | +5 | +6 | [5] | ||||
| −2 | بلاتين | +2 | +4 | +5 | +6 | ||||||||
| −1 | ذهب | +1 | +2 | +3 | +5 | ||||||||
| زئبق | +1 | +2 | +4 | [6] | |||||||||
| Tl | +1 | +3 | |||||||||||
| −4 | رصاص | +2 | +4 | ||||||||||
| −3 | بزموت | +3 | +5 | ||||||||||
| −2 | بولونيوم | +2 | +4 | +6 | |||||||||
| −1 | أستاتين | +1 | +3 | +5 | |||||||||
| Rn | +2 | [7] | |||||||||||
| فرانسيوم | +1 | ||||||||||||
| Ra | +2 | ||||||||||||
| أكتينيوم | +3 | ||||||||||||
| Th | +2 | +3 | +4 | ||||||||||
| بروتكتينيوم | +3 | +4 | +5 | ||||||||||
| U | +3 | +4 | +5 | +6 | |||||||||
| نبتونيوم | +3 | +4 | +5 | +6 | +7 | ||||||||
| بلوتونيوم | +3 | +4 | +5 | +6 | +7 | ||||||||
| أمريسيوم | +2 | +3 | +4 | +5 | +6 | ||||||||
| كوريوم | +3 | +4 | |||||||||||
| بركيليوم | +3 | +4 | |||||||||||
| كاليفورنيوم | +2 | +3 | +4 | ||||||||||
| أينشتاينيوم | +2 | +3 | |||||||||||
| فرميوم | +2 | +3 | |||||||||||
| مندليفيوم | +2 | +3 | |||||||||||
| نوبليوم | +2 | +3 | |||||||||||
| لورنسيوم | +3 | ||||||||||||
| Rf | +4 |
المراجع
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة), p. 28. - Low-valent magnesium compounds with Mg(I) have been obtained using bulky ligands; see Green, S. P. (2007). "Stable Magnesium(I) Compounds with Mg-Mg Bonds". Science. 318 (5857): 1754–1757. Bibcode:2007Sci...318.1754G. doi:10.1126/science.1150856. PMID 17991827. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Yttrium: yttrium(II) hydride compound data". WebElements.com. مؤرشف من الأصل في 13 مايو 2008. اطلع عليه بتاريخ 10 ديسمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - bromide_jmol.html "Yttrium: yttrium(I) bromide compound data" تحقق من قيمة
|مسار أرشيف=(مساعدة). OpenMOPAC.net. مؤرشف من الأصل في 10 فبراير 2012. اطلع عليه بتاريخ 10 ديسمبر 2007. الوسيط|CitationClass=تم تجاهله (مساعدة) - Ir(−3) has been observed in Ir(CO)33−; see Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) p.1117 - Hg4+ has been observed in mercury tetrafluoride; see Xuefang Wang (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4". Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi:10.1002/anie.200703710. PMID 17899620. الوسيط
|CitationClass=تم تجاهله (مساعدة). - Rn2+ has been observed in ثنائي فلوريد الرادون; see Stein, L. (1970). "Ionic Radon Solution". Science. 168 (3929): 362–4. Bibcode:1970Sci...168..362S. doi:10.1126/science.168.3929.362. PMID 17809133. الوسيط
|CitationClass=تم تجاهله (مساعدة) and Kenneth S. Pitzer (1975). "Fluorides of radon and element 118". J. Chem. Soc., Chem. Commun.,: 760b - 761. doi:10.1039/C3975000760b. الوسيط|CitationClass=تم تجاهله (مساعدة)CS1 maint: extra punctuation (link)
- بوابة العناصر الكيميائية
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.