طفرة مغلطة
الطفرة المُغلطة (بالإنجليزية: Missense mutation) تُعرف الطفرة المُغلطة في علم الوراثة بِأنها طفرة موضعية أو نقطية وذلك لأنها عبارة عن تغيير في نيوكليوتيدة واحدة خاصة بكودون لحمض أميني وهذا بدورة ينتج عنه حمض أميني مختلف عن المقصود أى أن هذا نوع من التبادل الغير مترادف.[1]
يُعد استبدال البروتين نوع من انواع طفرات الحمض النووي
تنشا الطفرة المغلطة أحيانا اثناء عملية استبدال البروتين، وذلك عندما يحدث تغيير في أحد الأحماض الأمينية المكونة للبروتين، وتكون الطفرة في هذه الحالة عبارة عن طفرة نقطية أي في نقطة بعينها وليس في سلسلة البروتين المتكونة بأكملها.
الطفرة المغلطة هي نوع من أنواع الاستبدال الغير متناظر في تسلسل الحمض النووي، حيث يحدث استبدال غير متزامن يتم فيها تغيير كودون إلى كودون توقف سابق لأوانه ينتج عنه قطع البروتين الناتج. وهذه الطفرات المغلطة تجعل البروتين الناتج غير وظيفي،كما انها مسؤولة عن بعض الأمراض البشرية مثل مرض انحلال البشرة، ومرض الخلايا المنجلية.[2]
في الأنواع الأكثر شيوعا لمرض الخلايا المنجلية، يتم استبدال النوكليوتيدة العشرين من جين "سلسلة بيتا " الخاص بالهيموجلوبين ويتغير الكودون من GAG إلى GTG. وهكذا، يتم استبدال حمض الجلوتاميك الحمض الأميني السادس بالحمض الأميني الفالين - الذي يُشار إليه كطفرة "E6V" [3]- وبذلك تم تغيير البروتين بالقدر الكافي لجعلة يتسبب في مرض الخلايا المنجلية.[4]
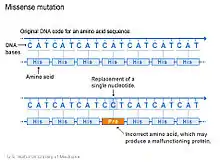
لا تؤدي جميع الطفرات المغلطة إلى تغييرات بروتينية ملحوظة. يمكن استبدال الحمض الأميني بحمض أميني من خواص كيميائية متشابهة جدا، وفي هذه الحالة، قد يستمر البروتين في العمل بشكل طبيعي. ويطلق على هذه الحالة طفرة محايدة أو "هادئة" أو "صامتة" أو محافظة. بدلا من ذلك، يمكن أن يحدث استبدال الأحماض الأمينية في منطقة من البروتين الذي لا يؤثر بشكل كبير على بنية أو وظيفة ثانوية البروتين. عندما يمكن تشفير الأحماض الأمينية بأكثر من كودون واحد (ما يسمى "الترميز المنحل") فإن أي طفرة في كودون قد لا ينتج عنها أي تغيير في الترجمة ؛ هذا سيكون بديلا مرادفا وليس طفرة خطيرة.
أمثلة
_mutation_R527L_PMID_22549407.png.webp)
DNA: 5' - AAC AGC CTG CGT ACG GCT CTC - 3' 3' - TTG TCG GAC GCA TGC CGA GAG - 5' mRNA: 5' - AAC AGC CUG CGU ACG GCU CUC - 3' Protein: Asn Ser Leu Arg Thr Ala Leu
الطفرة المغلطة تم تقديمها في جين LMNA - الموضع 1580 (nt) في تسلسل (DNA)علي شريط (CGT) مما أدى إلى استبدال الجوانين بالثايمين، مما أدي إلى وجود CTT في تسلسل الحمض النووي. هذه النتائج على مستوى البروتين في استبدال الأرجينين بواسطة الليوسين في الموضع 527.[5] هذا يؤدي إلى تدمير جسر الرابط بينهم وبناء هيكل عدم الاستقرار. الذي يتجلى مع تداخل خلل النسيج المفصلي التناسلي ومتلازمة بروجيريا.
نتائج نسخ البروتين:
DNA: 5' - AAC AGC CTG CTT ACG GCT CTC - 3' 3' - TTG TCG GAC GAA TGC CGA GAG - 5' mRNA: 5' - AAC AGC CUG CUU ACG GCU CUC - 3' Protein: Asn Ser Leu Leu Thr Ala Leu
التحليل التجريبي
يمكن أن تؤدي الطفرات المرتبطة بالسرطان إلى عدم استقرار وخلل كبير في البروتين الناتج. تم اقتراح طريقة لفحص مثل هذه التغييرات في عام 2012، وهي تحليل البروتينات المتوازية السريعة[6]
مراجع
- "Definition of Missense mutation". MedTerms medical dictionary. MedicineNet. 2012-03-19. مؤرشف من الأصل في 2 ديسمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Minde, David P; Anvarian, Zeinab; Rüdiger, Stefan GD; Maurice, Madelon M (1 January 2011). "Messing up disorder: how do missense mutations in the tumor suppressor protein APC lead to cancer?". Molecular Cancer. 10 (1): 101. doi:10.1186/1476-4598-10-101. PMC 3170638. PMID 21859464. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "141900 Hemoglobin—Beta Locus; HBB: .0243 Hemoglobin S. Sickle Cell Anemia, included. Malaria, Resistance to, included. HBB, GLU6VAL — 141900.0243". Online 'Mendelian Inheritance in Man' (OMIM). مؤرشف من الأصل في 25 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Boillée, S; Vande Velde, C; Cleveland, D. W. (2006). "ALS: A disease of motor neurons and their nonneuronal neighbors". Neuron. 52 (1): 39–59. doi:10.1016/j.neuron.2006.09.018. PMID 17015226. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Al-Haggar M, Madej-Pilarczyk A, Kozlowski L, Bujnicki JM, Yahia S, Abdel-Hadi D, Shams A, Ahmad N, Hamed S, Puzianowska-Kuznicka M (2012). "A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome". Eur J Hum Genet. 20 (11): 1134–40. doi:10.1038/ejhg.2012.77. PMC 3476705. PMID 22549407. مؤرشف من الأصل في 13 أغسطس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bullock, AN; Henckel, J; DeDecker, BS; Johnson, CM; Nikolova, PV; Proctor, MR; Lane, DP; Fersht, AR (23 December 1997). "Thermodynamic stability of wild-type and mutant p53 core domain". Proc. Natl. Acad. Sci. U.S.A. 94 (26): 14338–42. doi:10.1073/pnas.94.26.14338. PMC 24967. PMID 9405613. الوسيط
|CitationClass=تم تجاهله (مساعدة)
روابط خارجية
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الوراثة
- بوابة علم الأحياء
