سوء تغذية الكظرية وبيضاء الدماغ
سوء تغذية الكظرية وبيضاء الدماغ (بالإنجليزية: Adrenoleukodystrophy) ايضا معروف بسوء التغذية الكظري وبيضاء الدماغ - المرتبط بالكروموسوم x، هو اضطراب جيني ثانوي يؤدي إلى تراكم الاحماض الدهنية. الذي يأثر بالدرجة الاولى على القشرة الكظرية و الجهاز العصبي.
| Adrenoleukodystrophy | |
|---|---|
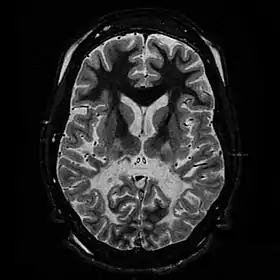 المادة البيضاء, حيث تظهر ناقصة الحجم وبها زيادة في شدة الإشارة. وتظهر المادة البيضاء الأمامية غير متأثرة. هذه الصفات تتسق مع سوء تغذية الكظرية وبيضاء الدماغ المرتبط بالكروموسوم إكس. المادة البيضاء, حيث تظهر ناقصة الحجم وبها زيادة في شدة الإشارة. وتظهر المادة البيضاء الأمامية غير متأثرة. هذه الصفات تتسق مع سوء تغذية الكظرية وبيضاء الدماغ المرتبط بالكروموسوم إكس. | |
| معلومات عامة | |
| الاختصاص | علم الوراثة الطبية |
| من أنواع | حثل المادة البيضاء ، ومرض الجهاز العصبي الوراثي التنكسي ، ومرض متنح مرتبط بالجنس |
| التاريخ | |
| سُمي باسم | توماس أديسون |
هذا المرض ينتج عن اختلال في الجسيم التأكسدي لأكسدة الحمض الدهني و تراكم سلسلة طويلة من الحمض الدهني(VLCFA) في جميع الأنسجة. أكثر الأنسجة تأثراً هي الميالين، القشرة الكظرية، الجهازي العصبي المركزي وخلايا لايديغ البينية . تاثير المرض على الجهاز العصبي متباين، ممكن أن يصيب بالاتهاب المزيل للنخاعين ( ALD الدماغي) أو تقدم بطيئ بإصابة المحور العصبي الذي يؤثر على صعود وهبوط السبل للنخاع الشوكي.
كأي مرض مرتبط بالكرومسوم x، سوء تغذية الكظرية وبيضاء الدماغ أكثر انتشار بالذكور، على كل حال، تقريبا 50% من الإناث الذين يمتلكون مغاير الزيجوت أظهرو بعض الأعرض في مراحله متقدمه.
سوء تغذية الكظرية وبيضاء الدماغ يحدث بسبب طفره في ABCD1 جين، وهو جين يقع على كرومسوم X، البروتين الناقل في غشاء الجسيم التأكسيدي. إلى الآن لا يعرف الالية الدقيقة للعديد من أشكال هذا المرض. الأشخاص المصابين بسوء تغذية الكظرية وبيضاء الدماغ أظهروا أرتفاع في مستوى الأحماض الدهنية ذات السلسلة الطويل المشبعة والغير المتشعبة.
خيارات العلاج لمرض سوء تغذية الكظرية وبيضاء الدماغ محدوده، يوجد علاج عن طريق إتباع حميه غذائية. إحدى أشكال هذا المرض التي تصيب الدماغ في الاطفال يتم علاجها عن طريق نقل الخلايا الجذعية. العلاج الجيني ممكن ان يكون خيارا لهذا المرض إذا إكتشفت في المراحل المبكره. قصور الغده الكظرية يتم علاجها بنجاح في المصابين.
أعراض وعلامات مرض
سوء تغذية الكظرية وبيضاء الدماغ يمكن أن يظهر بطرق مختلفة. فيوجد 7 من الأنماط الظاهرية في الذكور و 5 في الإناث.[1] يمكن تقسيم النمط الظاهري إلى 4 مجموعات: الاتهاب الدماغي، اعتلال النخاع الكظري، الأديسون ( القصور الكظري الأولي ) وبدون أعراض ظاهرة. الأعراض الأولية في الذكور المصابين بإحدى اشكال هذا المرض الذي يصيب الدماغ يتضمن عدم إستقرار عاطفي،قصور الانتباه وفرط الحركة والسلوك التخريبي في المدرسة. المرضى الأكبر عمرا المصابين ب (ALD الدماغي ) يظهروا أعراض مشابهة. (ALD الدماغي ) الغير معالج تتميز بإزالة الميالين تدرجيا يؤدي الي الحالة الإنباتية المستديمة والموت [2] الذكور البالغين المصابين باعتلال النخاع الكظري يظهرون أعراض أوليه كتصلب العضلات، الشلل السفلي، والضعف الجنسي [3] . جميع المرضى المصابين بسوء تغذية الكظرية وبيضاء الدماغ معرضون لخطر الإصابة بقصور الغدة الكظرية.[2] أنماط ظاهرية مختلفة لهذا المرض يمكن أن تحدث ضمن العائلة الواحد.[4] بداية القصور الكظري هي غالبا العرض الأول من أعراض المرض حيث يظهر مبكرا في حدود السنتين من العمر.[3]
الطرز الشكلية لسوء تغذية الكظرية وبيضاء الدماغ في الذكور
| الطراز الشكلي | الوصف | بداية الأصابة | التكرار النسبي التقريبي |
|---|---|---|---|
| النمط الدماغي للأطفال | الأنخفاض التدريجي في التنكسي العصبي، الذي بدون علاج يؤدي إلي الحالة الإنباتية المستديمة | عام 10-3 | 31-35% |
| المراهقين | يشابه النمط الدماغي للاطفال لكنه ابطئ | عام 21-11 | 4-7 % |
| الاعتلال النخاع الكظري | تدريج في الاعتلال العصبي، الشلل السفلي، 40% يتطور إلي نمط الدماغي | عام 37-21 | 40-46% |
| النمط الدماغي للبالغين | الخرف، اضطرابات سلوكية، يشابه تطور النمط الدماغي لاطفال لكن بدون أن يسبق بالإعتلال النخاع الكظري | مرحله البلوغ | 2-5% |
| زيتوني جسري مخيخي | يضمن الدماغ و جذع الدماغ | من المراهقه إلى البلوغ | 1-2% |
| الأديسون ( القصور الكظري الأولي ) | قصور الكظر | قبل 7.5 عام | يصل ل 50% في الاطفال. ومتغير مع لاعمار الاخرى |
| وبدون أعراض ظاهرة | لايوجد اعراض مرضية، لكن دراسة اظهرت وجود اعراض طفيفة قصور الكظر أو الاعتلال النخاع الكظري | معظم الانوع الانماط الظاهريه للذكور اقل من 4 سنوات | تنخفض نسبة المرضى مع تقدم السن |
الطرز الشكلية لسوء تغذية الكظرية وبيضاء الدماغ في الإناث
| الطراز الشكلي | الوصف | بداية الإصابة | التكرار النسبي التقريبي |
|---|---|---|---|
| بدون أعراض ظاهرة | لا يوجد إصابة عصبية أو بالغده الكظرية | معظم الإناث تحت سن ال 30 لا يتضمن اي إصابه عصبيه | يتناقص مع تقدم السن |
| اعتلال النخاغ المعتدل | زيادة الرد الفعل للوتر، تغيرات الحسية للأطراف السفلية | البالغين | تقريا 50 % من النساء ما فوق ال 40 عاما |
| اعتلال النخاع من المعتدل إلى الحاد | تشابة الاعتلال النخاع الكظري في الذكور لكن تختلف في بداية الإصابة | البالغين | تقريا 15 % من النساء ما فوق 40 عاما |
| إصابة الدماغ | إصابة تدريجا بالخرف | نادر بالاطفال لكن شائع بين البالغين | 2% |
| إصابة الغده الكظرية | القصور بالغده الكظرية الأولية | يصيب جميع الاعمار | 1% |
علم الوراثة
سببب سوء تغذية الكظرية وبيضاء الدماغ حدوث طفرة في جين ABCD1، الذي يقع على إكس كيو 27 هو الذي ويوضح الوراثة المتنحية المرتبطة بالكروموسوم x . ABCD1 جين هو مشفر لبروتين سوء تغذية الكظرية وبيضاء الدماغ (ALDP). ABCD1 هو مشفر للنواقل الغشائية في الجسيم التأكسدي المسؤول عن نقل ركيزة السلسلة الطويلة من الحمض الدهني إلى داخل الجسيم التأكسدي للتحلل.[5] الطفرة في هذا الجين التي تأثر على هذه العملية هي التي تسبب سوء تغذية الكظرية وبيضاء الدماغ.
الذكور الذين يحملون طفره في ABCD1 هم فرداني الزيجوت، هذا لانهم يملكون كرومسوم x واحد. الإناث الحمالين لهذه الطفرة سوف يتجنبون المظاهر الخطيرة لهذا المرض، لكن لأعراض تظهر بالعادة في مراحل متقدمه من العمر. على الرغم من كشف طفره في جين ABCD1 في الأشخاص المصابين بإحدى أشكال سوء تغذية الكظرية وبيضاء الدماغ لايوجد علاقة بين النمط الشكلي والنمط الظاهري.[6] ضمن العائلة الوحدة يوجد بالعادة أنماط ظاهرية مختلفه على الرغم من ظهور نفس الطفرة. لايوجد طفره معروفه مشتركه بين المصابين، معظمها خاصة أو متعلقة بالعائلات. يوجد ما يقارب من 600 طفرة تم تعرفيها في الأشخاص المصابين. حدوث طفرات جديدة في الاشخاص المصابين بسوء تغذية الكظرية وبيضاء الدماغ ( ليس ورثيا، لكن عفويا ) تشكل ما يقارب 4.1% من الإصابات
طريقة تطور المرض
السبب الفعلي لمجموعة الأعراض المتنوعة الموجودة في مختلف الأنماط الظاهرية لسوء تغذية الكظرية وبيضاء الدماغ غير واضحة. المادة البيضاء، خلايا لايديغ البينية في الخصية والقشرة الكظرية هي أكثر الانظمة المصابة خطورة.[1] فائض السلسلة الطويلة من الحمض الدهني يمكن أن يكشف في معظم الأنسجة في الجسم بغض النظر عن موقغ الأعراض.[1] أفتقار لمرافق الانزيم A لا يسمح لسلسلة الطويلة من الحمض الدهني بالتحلل، تراكم هذا في المادة البيضاء، القشرة الكظرية والخصية خصوصا خلايا لايديغ البينية لاتسمح لهذه الأعضاء عن تعمل بشكل صحيح. العلاجات الناجحة بستخدم عملية زَوالُ المَيَالين التي تؤثر على دماغ إما بالخلايا الجذعية أو العلاج الجيني لاترجع مستوى السلسلة الطويلة من الحمض الدهني إلى وضعها طبيعي مباشرة.[7] هو غير واضح إذا كان تراكم السلسلة الطويلة من الحمض الدهني هو مرتبط بتطور المرض، أو فقط يمكن الأستفاده منه كدال على المرض
التشخيص
الأعراض السريرية لسوء تغذية الكظرية وبيضاء الدماغ تختلف أختلافات كبير، مما يجعل التشخيص صعبا. الشك السريري لسوء تغذية الكظرية وبيضاء الدماغ تكون نتيجة أعراض مختلفة تعتمد على النمط الظاهري للمرض حتى ضمن العائلة الواحده أو حتى التوأم. عندما يتم الشك بالأصابة بسوء تغذية الكظرية وبيضاء الدماغ اعتماده على الأعراض السريرية، الفحص الأولي عادة يتضمن تحديد بلازما السلسلة الطويلة من الحمض الدهني بستخدام كروماتوغرافيا الغاز - مطياف الكتلة. تركيز السلسلة الطويلة من الحمض الدهني الغير مشبعة وخصوصا 26 سلسلة كربون مرتفعة بشكل ملحوظ في الذكورالمصابين سوء تغذية الكظرية وبيضاء الدماغ، حتى قبل الظهور الأعراض اخرى.[8] بعد النتائج الإجابية لفحص تحديد بلازما السلسلة الطويلة من الحمض الدهني تأكيد بسوء تغذية الكظرية وبيضاء الدماغ يتضمن تحليل الوراثي لجزيئي الجين ABCD1. في الإناث حيث قياس بلازما السلسلة الطويلة من الحمض الدهني ليس قاطع، فيفضل استخدم التحليل الوراثي الجزيئي، خصوصا في الحالات التي تكون فيها الطفرة بالعائلة معروفة. على الرغم من التنوع الكبير للأنماظ الظاهرية السريرية في الذكور المصابين، تقيم السلسلة الطويلة من الحمض الدهني في كل الذكور الذين يحملون طفره على ABCD1 جين.
طرق العلاج
العلاج بالحمية الغذائية
المحاولات الأولية للعلاج بالحمية الغذائية الشخاص المصابين بسوء تغذية الكظرية وبيضاء الدماغ يتضمن تقيد الكمية المتناولة من السلسلة الطويلة من الحمض الدهني. الحمية الغذائية ليست المصدر الوحيد للسلسلة الطويلة من الحمض الدهني، هو ايضا يتم تصنيعها داخليا. الحمية الغذائية الصارمة لا تأثر على مستوى تركيز السلسلة الطويلة من الحمض الدهني في البلازما و الأنسجة الجسم الأخرى. بعد أدراك أن التصنيع الداخلي هو مساهم مهم في مستوى السلسلة الطويلة من الحمض الدهني في الجسم. انتقلت الجهود العلاج بالحمية الغذائية إلى تثبيط مسارات بناء السلسلة الطويلة من الحمض الدهني في الجسم. والدي لورينزو أودون، هو طفل مصاب بسوء تغذية الكظرية وبيضاء الدماغ، قامو بجهود كبيره في تطوير علاج بالحمية الغذائية لإبطاء تقدم المرض. فقد عملو على تطوير خليط من الاحماض الدهنية الغير مشبعة المعروفة بزيت لورينزو التي تعمل على تثبيط علمية استطالة الأحماض الدهنية في الجسم. وجدوا أن تكملة الغذائية بزيت لورينزو يؤدي إلي إعادة مستوى تركيز السلسلة الطويلة من الحمض الدهني للوضع طبيعي، على الرغم من علاج المظاهر الدماغية للمرض لاتزال مثيرة للجدل وغير ومثبتة[9] تجارب العلاج بستخدم زيت لورينزو اثبت انهم لا يوقف الأعتلال العصبي أو يحسن عمل القشرة الكظرية.
العلاج بالزراعة
بينما العلاج بالحمية الغذائية أظهرت فاعلية في إعادة مستوى السلسلة الطويلة من الحمض الدهني للوضع طبيعي، العلاج بزراعة الخلايا الجذعية هو العلاج الوحيد الذي يستطيع أن يوقف عملية إزالة الميالين التي تعتبر كعلامة على الشكل الدماغي من المرض. حتى تكون عملية الزراعة فعالة يجب أن تتم في مرحلة مبكرة من المرض، إذا عملية إزالة الميالين كانت متقدمة، عملية الزراعة قد تزيد الوضع سوء، تزيد سرعة إزالة الميالين. عملية الزراعة كانت فعالة في علاج إزالة الميالين، لكن لمرضى لم يظهرو تحسن في عمل القشرة الكظرية
العلاج الجيني
للمرضى الذين لايعثرون على مطابق مناسب لعملية الزراعة، هناك ابحاث لاستخدام العلاج الجيني . يتم اختيار الناقل المناسب وتعديله لينتج النمط البري لجين ABCD1 ، الذي يتم نقله للمريض بنفس الطريقة التي تتم فيها زرع الخلايا الجذعية. العلاج الجيني تم تجربته على عدد قليل من المرضى معظمهم في فرنسا. هولاء المرضى تم اخضاعهم للعلاج الجيني بعد تأكد من عدم وجود مستضد الكريات البيضاء البشرية متطابقة الأجراء عملية الزراعة التقليدية. في حالتين أبلغ عنهما، العلاج الجيني كان ناجح، تحسن في عملية إزالة الميالين لمدة عامين. على الرغم من ان العلاج الجيني اظهر نجاحا في الأعراض العصبية، إلى أن مستوى بناء السلسلة الطويلة من الحمض الدهني بقية مرتفعة.
قصور القشرة الكظرية
علاج قصور القشرة الكظرية الذي يصاحب أي نمط ظاهري لسوء تغذية الكظرية وبيضاء الدماغ في الذكور لا يعالج اي من الأعراض المختصة في الأعتلال العصبي. الهرومنات البديلة هي علاج أساسي للأشخاص المصابين لسوء تغذية الكظرية وبيضاء الدماغ الذين يعانون من اعراض القصور القشرة الكظرية.
روابط خارجية
- ALD Connect
- ALD Life
- European Leukodystrophy Foundation
- Fight ALD
- March of Dimes Foundation
- United Leukodystrophy Foundation
- سوء تغذية الكظرية وبيضاء الدماغ على مشروع الدليل المفتوح
- adrenoleukodystrophy على موقع المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NINDS)
- Images of ALD at جامعة الخدمات المنظمة للعلوم الصحية
- Adrenoleukodystrophy at المركز الوطني لمعلومات التقانة الحيوية
مراجع
- Moser, Hugo W.; Smith, Kirby D.; Watkins, Paul A.; Powers, James; Moser, Ann (2001). "131. X-Linked Adrenoleukodystrophy". In Scriver, C.W.; Beaudet, A.L.; Sly, W.S.; Valle, D.; Childs, B.; Kinzler, K.W.; Vogelstein, B. (المحررون). Metabolic and Molecular Bases of Inherited Disease. 2 (الطبعة 8th). New York: McGraw Hill. ISBN 0-07-136320-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Berger, J.; Gärtner, J. (2006). "X-linked adrenoleukodystrophy: Clinical, biochemical and pathogenetic aspects". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (12): 1721–1732. doi:10.1016/j.bbamcr.2006.07.010. PMID 16949688. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Steinberg, S. J.; Moser, A. B.; Raymond, G. V.; Pagon, R. A.; Bird, T. D.; Dolan, C. R.; Stephens, K.; Adam, M. P. (1993). "X-Linked Adrenoleukodystrophy". Gene Reviews. PMID 20301491. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "#300100 - Adrenoleukodystrophy". Johns Hopkins University. مؤرشف من الأصل في 24 سبتمبر 2015. اطلع عليه بتاريخ 27 يونيو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hung KL, Wang JS, Keng WT, Chen HJ, Liang JS, Ngu LH, Lu JF (2013). "Mutational analyses on X-linked adrenoleukodystrophy reveal a novel cryptic splicing and three missense mutations in the ABCD1 gene". Pediatric Neurology. 49: 185–190. doi:10.1016/j.pediatrneurol.2013.04.021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Smith, K. D.; Kemp, S.; Braiterman, L. T.; Lu, J. F.; Wei, H. M.; Geraghty, M.; Stetten, G.; Bergin, J. S.; Pevsner, J.; Watkins, P. A. (1999). "X-linked adrenoleukodystrophy: Genes, mutations, and phenotypes". Neurochemical research. 24 (4): 521–535. doi:10.1023/A:1022535930009. PMID 10227685. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cartier, N.; Aubourg, P. (2009). "Hematopoietic Stem Cell Transplantation and Hematopoietic Stem Cell Gene Therapy in X-Linked Adrenoleukodystrophy". Brain Pathology. 20 (4): 857–862. doi:10.1111/j.1750-3639.2010.00394.x. PMID 20626747. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Moser, Hugo W.; Smith, Kirby D.; Watkins, Paul A.; Powers, James; Moser, Ann (2001). "131. X-Linked Adrenoleukodystrophy". In Scriver, C.W.; Beaudet, A.L.; Sly, W.S.; Valle, D.; Childs, B.; Kinzler, K.W.; Vogelstein, B. (المحررون). Metabolic and Molecular Bases of Inherited Disease. 2 (الطبعة 8th). New York: McGraw Hill. ISBN 0-07-136320-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sandlers, Y.; Moser, A. B.; Hubbard, W. C.; Kratz, L. E.; Jones, R. O.; Raymond, G. V. (2012). "Combined extraction of acyl carnitines and 26:0 lysophosphatidylcholine from dried blood spots: Prospective newborn screening for X-linked adrenoleukodystrophy". Molecular Genetics and Metabolism. 105 (3): 416–420. doi:10.1016/j.ymgme.2011.11.195. PMID 22197596. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب