خلية بركنجي
خلايا بركنجي أو عصبون بركنجي هي فئة من العصبونات المنتجة للناقل العصبي غابا والموجودة في المخيخ. سميت هذه الخلايا نسبة لمكتشفها عالم التشريح التشيكي جان بركنجي، والذي وصف تلك الخلايا عام 1839.
| خلية بركنجي | |
|---|---|
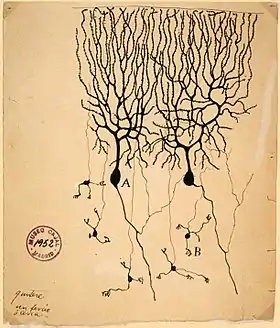 رسم شبكة خلايا بركنجي (أ) لسانتياغو كاخال | |
| تفاصيل | |
| موقع | المخيخ |
| وظيفة | عصبون مثبط |
| ناقل عصبي | غابا |
| الشكل | شجري متفرع مسطح |
| الاتصالات قبل المِشبكية | ألياف متوازية وألياف متسلقة |
| الاتصالات بعدَ المِشبكية | أنوية مخيخية عميقة |
| نوع من | عصبون [1] |
| ترمينولوجيا أناتوميكا | 14.1.07.404 |
| FMA | 67969 |
| UBERON ID | 0002979 |
| ن.ف.م.ط. | D011689 |
البنية
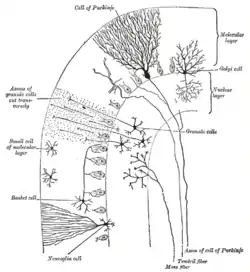

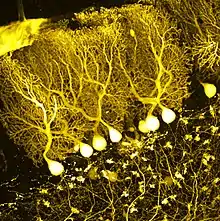
تعد هذه الخلايا واحدة من أكبر الخلايا العصبية في الدماغ (خلايا بتز هي أكبرها)،[2] وتمتلك زوائد شجرية دقيقة ومعقدة، وتتصف تلك الزوائد بالعدد الكبير لتفرعاتها. وتوجد خلايا بركنجي في طبقة بركنجي في المخيخ، وتكون تلك الخلايا مصطفة كأحجار الدومينو متراصة الواحدة أمام الأخرى. تشكل الزوائد الشجرية طبقات ثنائية الأبعاد تعبر من خلالها الألياف المتوازية القادمة من الطبقات الأعمق للمخيخ، تشكل تلك الألياف المتوازية تشابكات مهيجة غلوتاماتية ضعيفة نسبياً مع تفرعات زوائد خلايا بركنجي، بينما تشكل الألياف المتسلقة القادمة من النواة الزيتونية السفلى تشابكات مهيجة قوية جداً مع الزوائد الشجرية القريبة ومع جسد خلية بركنجي. تعبر الألياف المتوازية عامودياً عبر زوائد عصبون بركنجي الشجرية، ويصل عددها نحو 200,000 من تلك الألياف المتوازية[3] مشكلة تشابكات خلايا حبيبية-خلايا بركنجي حيث تتشابك مجموعة من الألياف مع خلية بركنجي واحدة، كل خلية من خلايا بركنجي تستقبل حوالي 500 تشابك من الألياف المتسلقة، جميعها قادمة من ليف متسلق واحد.[4] تزود الخلايا السليّة والخلايا النجميّة (موجودتان في الطبقة الجزيئية للمخيخ) أوامر مثبطة (غابا) لخلايا بركنجي، حيث تتشابك الخلايا السليّة مع بداية محور عصبون بركنجي، وتتشابك الخلايَا النجمية مع الزوائد الشجرية.
ترسل خلايا بركنجي إشارات مثبطة نحو أنوية المخيخ، وتعد المخرج الأساسي لكل المنظمات الحركية في قشرة المخيخ.
جزيئياً
تعبر طبقة بركنجي في المخيخ -التي تحتوي على خلايا بركنجي وخلايا بيرغمان الدبقية- عن عدد كبير من الجينات المميزة.[5] وقد طرحت فكرة أن هنالك علامات جينية محددة لطبقة بركنجي من خلال مقارنة نتاجات أحماض نووية رسولة لفأر لديه عوز في خلايا بركنجي وفأر بري عادي. [6] من الأمثلة التوضيحية لهذا الأمر هو البروتين 4 في خلية بركنجي (PCP4 [الإنجليزية]) في فئران معدلة جينياً، حيث أظهرت تلك الفئران تلفاً في التعلم الحركي وتأثر ملحوظ في للدونة المشبكية في عصبونات بركنجي.[7][8] تقوم بروتينات PCP4 بتسريع ارتباط وفك ارتباط الكالسيوم مع الكالموديولين في سيتوبلازم خلايا بركنجي، وغياب تلك البروتينات يعطل فيزيولوجية هذه العصبونات.[7][8][9][10]
النمو
هنالك دليل من فئران التجارب والبشر أن خلايا نخاع العظام تندمج مشكلة خلايا بركنجي أو أنها تنتجها، ومن الممكن كذلك أن يكون لدى خلايا النخاع العظمي دور في إصلاح إصابات الجهاز العصبي المركزي بشكل مباشر أو غير مباشر.[11][12][13][14][15] وتشير مزيد من الأدلة إلى إمكانية وجود سلف مشترك من الخلايا جذعية لكل من خلايا بركنجي، والخلايا البائية، والخلايا المنتجة للألدوستيرون في القشرة الكظرية
الوظيفة
تُظهر خلايا بركنجي شكلين منفصلين من النشاطات الإلكتروفيزيولوجية:
- تصاعدات بسيطة تحدث بوتيرة 17-150 هيرتز (رامين وبين،1999)، إما تلقائياً أو عند تهييج خلايا بركنجي بفعل الألياف المتوازية.
- تصاعدات معقدة بطيئة وبمعدل 1-3 هيرتز، تتميز بتصاعد مبدأي ذو سعة كبيرة طويلة المدة، متبوعاً بجهود فعل صغيرة السعة وبتردد عالي. تسبب الألياف المتسلقة هذا النوع من التصاعدات، ويمكن للألياف المتسلقة أن تنشئ جهود فعل في الزوائد الشجرية من خلال نواقل الكالسيوم. وبسبب التأثير القوي للتصاعدات المعقدة، يمكن لها أن تمنع نشوء التصاعدات البسطية.[16] تظهر خلايا بركنجي نشاطاً إلكتروفيزيولوجياً تلقائياً على شكل سلسة من التصاعدات المعتمدة على الكالسيوم أو الصوديوم. قدم هذا التصور في البداية على يد رودولفو ليناس [الإنجليزية]. قنوات الكالسيوم نوع P سميت نسبة لخلايا بوركينجي حيث عثر عليهن لأول مرة، وتؤدي تلك القنوات وظيفة مهمة في عمل المخيخ. من المعلوم أن تهييج خلايا بركنجي بفعل الألياف المتسلقة يمكن أن ينقل حالة الخلية من الهدوء إلى النشاط التلقائي، والعكس صحيح، أي أنها تعمل كمفتاح تشغيل.[17] إلا أن هذه الاكتشافات واجهت تحديات من دراسة أخرى تقترح أن الوظيفة التشغيلية للألياف المتسلقة تحدث عادة في الحيوانات المخدرة وأن خلايا بركنجي إجمالاً تعمل بشكل متواصل في الحيوانات اليقظة.[18] إلا أن هذه الدراسة واجهت تحديات أيضاً[19] إذ رصدت حالة من تشغيل خلايا بركنجي في القطط اليقظة.[20] أجري كذلك محاكاة على الكومبيوتر لعمل خلايا بركنجي، وأظهرت تلك المحاكاة أن الكالسيوم داخل الخلية مسؤول عن تشغيلها.[21]
تقترح بعض الاكتشافات أن زوائد خلايا بركنجي تنتج إندوكانابينويدات يمكنها أن تبطئ كلا التشابكات المهيجة والمثبطة بشكل مؤقت.[22] تتحكم مضخات الصوديوم والبوتاسيوم بالنشاط الداخلي لخلية بركنجي.[23] مما يقترح بأن المضخة قد لا تكون "عامل استتباب" وحفظ لمكونات الخلية، وإنما كمعالج في المخيخ والدماغ.[24] إن حدوث طفرة في مضخة الصوديوم بوتاسيوم يسبب حالة سريعة من انقباضات باركينسون، وأعراض تلك الحالة تشير إلى أنه خلل في الحسابات والمعالجة في المخيخ.[25] كذلك فإن استعمال سم الوابين [الإنجليزية] الذي يوقف مضخات صوديوم-بوتاسيوم على فئران حية أدى إلى ترنحها ووانقباضات في عضلاتها.[26] تشير العديد من البيانات المخبرية إلى أن مضخات البوتاسيوم-صوديوم تنتج فترات سكون طويلة (>> 1 ثانية) في خلية بركنجي، وقد يكون لتلك الفترات دور في المعالجة والحساب.[27] يثبط الكحول مضخات الصوديوم-بوتاسيوم في المخيخ، وهو ما يشرح تأثيرها السلبي على توازن الجسد وعلى حسابات المخيخ.[28][29]
الأهمية السريرية
يمكن أن تتضرر خلايا بركنجي لعدة أسباب عند البشر منها: التعرض للسموم؛ كالكحول أو الليثيوم، أمراض مناعية ذاتية؛ كطفرات جينية تسبب ترنح نخاعي مخيخي، أو ترنح غلوتيني، أو مرض انفريشت-لندبورغ [الإنجليزية]، أو التوحد، أمراض التحلل العصبي التي لم يعلم لها سبب جيني؛ كالترنح المتقطع والضمور عديد الأنظمة المخيخي.[30][31]
الترنح الغلوتيني هو مرض مناعي ذاتي يحفز عند تناول الغلوتين.[32] وإن موت خلايا بركنجي الناتج عن التعرض للغلوتين لا يعكس. والفحص المبكر والعلاج بحمية خالية من الغلوتين يمكنه أن يقلل من الترنح وأن يمنع تطوره.[30][33] أقل من 10% ممن لديهم ترنحا غلوتينياً تظهر عليهم آثار في جهازهم الهضمي، ويعاني 40% من الأشخاص من إصابات معوية.[33] مشكل
التحلل العصبي، تحديدا مرض الترنح النخاعي المخيخي نوع-1 [الإنجليزية] (SCA1 ) يسبب بفعل توسع حزمة عديدة الغلوتامين في بروتين الأتاكسين 1. هذا الخلل في الأتاكسين 1 يسبب تلفاً في الميتوكندريا في خلايا بركنجي، مما يؤدي إلى تحلل الخلايا مبكراً.[34] فيؤدي إلى اختلال التوازن الحركي، ثم الموت.
يمكن لبعض الحيوانات المستأنسة كالخيل والكلاب والقطط أن تتعرض لحالة من ضمور خلايا بركنجي مباشرة بعد الولادة، وتسمى بضمور حيوية المخيخ. يمكن لهذه الحالة أن تؤدي إلى أعراض كالترنح، الرعاش، ردود فعل زائدة، جمود أو خطوات صعبة، عدم وعي واضح في موقع القدم، وعدم قدرة عامة على تحديد البعد والمحيط.[35] هنالك حالة أخرى مشابهة تحدث عند فشل خلايا بركنجي في النمو أثناء الحمل أو موتها قبل الولادة وتسمى بانكماش المخيخ [الإنجليزية].
الحالات الجينية كمتلازمة لويس بار ومرض نيمان-بيك نوع-ج، وكذلك المتلازمة اليد المهتزة، تحتوي على فقدان لخلايا بركنجي. في مرض الزهايمر، تظهر أحيانا أمراض في الحبل الشوكي، وكذلك نقصان لتفرعات الزوائد الشجرية في خلية بركنجي.[36] يمكن أن تضرر الخلية كذلك من فيروسات داء الكلب التي تنتقل من مكان العدوى في الجهاز العصبي المحيطي إلى الجهاز المركزي.[37]
اقرأ أيضاً
مراجع
- معرف النموذج التأسيسي في التشريح: 67969 — تاريخ الاطلاع: 1 أغسطس 2019
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia A, McNamara JO, and White LE (2008). Neuroscience. 4th ed. Sinauer Associates. صفحات 432–4. ISBN 978-0-87893-697-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tyrrell, T; Willshaw, D (1992-05-29). "Cerebellar cortex: its simulation and the relevance of Marr's theory". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 336 (1277): 239–57. doi:10.1098/rstb.1992.0059. PMID 1353267. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wadiche, JI; Jahr, CE (2001-10-25). "Multivesicular release at climbing fiber-Purkinje cell synapses". Neuron. 32 (2): 301–13. doi:10.1016/S0896-6273(01)00488-3. PMID 11683999. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kirsch, L; Liscovitch, N; Chechik, G (December 2012). Ohler, Uwe (المحرر). "Localizing Genes to Cerebellar Layers by Classifying ISH Images". PLoS Computational Biology. 8 (12): e1002790. doi:10.1371/journal.pcbi.1002790. PMC 3527225. PMID 23284274. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rong, Y; Wang T; Morgan J (2004). "Identification of candidate purkinje cell-specific markers by gene expression profiling in wild-type and pcd3j mice". Molecular Brain Research. 13 (2): 128–145. doi:10.1016/j.molbrainres.2004.10.015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Felizola SJ, Nakamura Y, Ono Y, Kitamura K, Kikuchi K, Onodera Y, Ise K, Takase K, Sugawara A, Hattangady N, Rainey WE, Satoh F, Sasano H (Apr 2014). "PCP4: a regulator of aldosterone synthesis in human adrenocortical tissues". Journal of Molecular Endocrinology. 52 (2): 159–167. doi:10.1530/JME-13-0248. PMC 4103644. PMID 24403568. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wei P, Blundon JA, Rong Y, Zakharenko SS, Morgan JI (2011). "Impaired locomotor learning and altered cerebellar synaptic plasticity in pep-19/PCP4-null mice". Mol. Cell. Biol. 31 (14): 2838–44. doi:10.1128/MCB.05208-11. PMC 3133400. PMID 21576365. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Putkey JA, Kleerekoper Q, Gaertner TR, Waxham MN (2004). "A new role for IQ motif proteins in regulating calmodulin function". J. Biol. Chem. 278 (50): 49667–70. doi:10.1074/jbc.C300372200. PMID 14551202. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kleerekoper QK, Putkey JA (2009). "PEP-19, an intrinsically disordered regulator of calmodulin signaling". J. Biol. Chem. 284 (12): 7455–64. doi:10.1074/jbc.M808067200. PMC 2658041. PMID 19106096. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hess DC, Hill WD, Carroll JE, Borlongan CV (2004). "Do bone marrow cells generate neurons?". Archives of Neurology. 61 (4): 483–485. doi:10.1001/archneur.61.4.483. PMID 15096394. مؤرشف من الأصل في 23 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Weimann JM, Johansson CB, Trejo A, Blau HM (2003). "Stable reprogrammed heterokaryons form spontaneously in Purkinje neurons after bone marrow transplant". Nature Cell Biology. 5 (11): 959–966. doi:10.1038/ncb1053. PMID 14562057. مؤرشف من الأصل في 23 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Alvarez-Dolado M, Pardal R, Garcia-Verdugo JM, Fike JR, Lee HO, Pfeffer K, Lois C, Morrison SJ, Alvarez-Buylla A (2003). "Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes". Nature. 425 (6961): 968–973. doi:10.1038/nature02069. PMID 14555960. مؤرشف من الأصل في 25 سبتمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Felizola SJ, Katsu K, Ise K, Nakamura Y, Arai Y, Satoh F, Sasano H (2015). "Pre-B lymphocyte protein 3 (VPREB3) expression in the adrenal cortex: precedent for non-immunological roles in normal and neoplastic human tissues". Endocrine Pathology. 26: 119–28. doi:10.1007/s12022-015-9366-7. PMID 25861052. مؤرشف من الأصل في 25 سبتمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kemp K, Wilkins A, Scolding N (2014). "Cell fusion in the brain: two cells forward, one cell back". Acta Neuropathologica. 128 (5): 629–638. doi:10.1007/s00401-014-1303-1. PMC 4201757. PMID 24899142. مؤرشف من الأصل في 23 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eric R. Kandel, James H. Schwartz, Thomas M. Jessell (2000). Principles of Neural Science. 4/e. McGraw-Hill. pp.837-40.
- Loewenstein Y, Mahon S, Chadderton P, Kitamura K, Sompolinsky H, Yarom Y, et al. (2005). "Bistability of cerebellar Purkinje cells modulated by sensory stimulation". Nature Neuroscience. 8: 202–211. doi:10.1038/nn1393. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schonewille M, Khosrovani S, Winkelman BH, Hoebeek FE, DeJeu MT, Larsen IM, et al. (2006). "Purkinje cells in awake behaving animals operate at the up state membrane potential". Nature Neuroscience. 9: 459–461. doi:10.1038/nn0406-459. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Loewenstein Y, Mahon S, Chadderton P, Kitamura K, Sompolinsky H, Yarom Y, et al. (2006). "Purkinje cells in awake behaving animals operate at the up state membrane potential–Reply". Nature Neuroscience. 9: 461. doi:10.1038/nn0406-461. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yartsev MM, Givon-Mayo R, Maller M, Donchin O (2009). "Pausing Purkinje cells in the cerebellum of the awake cat". Frontiers in Systems Neuroscience. 3: 2. doi:10.3389/neuro.06.002.2009. PMC 2671936. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Forrest MD (2014). "Intracellular Calcium Dynamics Permit a Purkinje Neuron Model to Perform Toggle and Gain Computations Upon its Inputs". Frontiers in Computational Neuroscience. 8: 86. doi:10.3389/fncom.2014.00086. PMC 4138505. PMID 25191262. مؤرشف من الأصل في 6 أكتوبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kreitzer AC, Regehr WG (March 2001). "Retrograde inhibition of presynaptic calcium influx by endogenous cannabinoids at excitatory synapses onto Purkinje cells". Neuron. 29 (3): 717–27. doi:10.1016/S0896-6273(01)00246-X. PMID 11301030. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Forrest MD, Wall MJ, Press DA, Feng J (December 2012). Cymbalyuk G (المحرر). "The Sodium-Potassium Pump Controls the Intrinsic Firing of the Cerebellar Purkinje Neuron". PLoS ONE. 7 (12): e51169. doi:10.1371/journal.pone.0051169. PMC 3527461. PMID 23284664. مؤرشف من الأصل في 4 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Forrest MD (December 2014). "The sodium-potassium pump is an information processing element in brain computation". Frontiers in Physiology. 5 (472). doi:10.3389/fphys.2014.00472. PMC 4274886. مؤرشف من الأصل في 19 يناير 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cannon C (July 2004). "Paying the Price at the Pump: Dystonia from Mutations in a Na+/K+-ATPase". Neuron. 43 (2): 153–154. doi:10.1016/j.neuron.2004.07.002. PMID 15260948. مؤرشف من الأصل في 13 ديسمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Calderon DP, Fremont R, Kraenzlin F, Khodakhah K (March 2011). "The neural substrates of rapid-onset Dystonia-Parkinsonism". Nature Neuroscience. 14 (3): 357–65. doi:10.1038/nn.2753. PMC 3430603. PMID 21297628. مؤرشف من الأصل في 17 أغسطس 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Forrest MD (2014). "Intracellular Calcium Dynamics Permit a Purkinje Neuron Model to Perform Toggle and Gain Computations Upon its Inputs". Frontiers in Computational Neuroscience. 8: 86. doi:10.3389/fncom.2014.00086. PMC 4138505. PMID 25191262. مؤرشف من الأصل في 6 أكتوبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Forrest MD (April 2015). "Simulation of alcohol action upon a detailed Purkinje neuron model and a simpler surrogate model that runs >400 times faster". BMC Neuroscience. 16 (27). doi:10.1186/s12868-015-0162-6. مؤرشف من الأصل في 28 أكتوبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Forrest, Michael (April 2015). "the_neuroscience_reason_we_fall_over_when_drunk". Science 2.0. مؤرشف من الأصل في 14 يناير 2019. اطلع عليه بتاريخ May 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Mitoma H, Adhikari K, Aeschlimann D, Chattopadhyay P, Hadjivassiliou M, Hampe CS, et al. (2016). "Consensus Paper: Neuroimmune Mechanisms of Cerebellar Ataxias". Cerebellum (Review). 15 (2): 213–32. doi:10.1007/s12311-015-0664-x. PMC 4591117. PMID 25823827. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jaber M (2017). "The cerebellum as a major player in motor disturbances related to Autistic Syndrome Disorders". Encephale (Review). 43 (2): 170–175. doi:10.1016/j.encep.2016.03.018. PMID 27616580. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PH, Hadjivassiliou M, Kaukinen K, Rostami K, Sanders DS, Schumann M, Ullrich R, Villalta D, Volta U, Catassi C, Fasano A (2012). "Spectrum of gluten-related disorders: consensus on new nomenclature and classification". BMC Medicine (Review). 10: 13. doi:10.1186/1741-7015-10-13. PMC 3292448. PMID 22313950. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hadjivassiliou M, Sanders DD, Aeschlimann DP (2015). "Gluten-related disorders: gluten ataxia". Dig Dis (Review). 33 (2): 264–8. doi:10.1159/000369509. PMID 25925933. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stucki DM, Ruegsegger C, Steiner S, Radecke J, Murphy MP, Zuber B, Saxena S (August 2016). "Mitochondrial impairments contribute to Spinocerebellar ataxia type 1 progression and can be ameliorated by the mitochondria-targeted antioxidant MitoQ". Free Radic. Biol. Med. 97: 427–440. doi:10.1016/j.freeradbiomed.2016.07.005. PMID 27394174. الوسيط
|CitationClass=تم تجاهله (مساعدة) - للمزيد راجع مقالة Cerebellar abiotrophy [الإنجليزية]
- Mavroudis, IA; Fotiou, DF; Adipepe, LF; Manani, MG; Njau, SD; Psaroulis, D; Costa, VG; Baloyannis, SJ (November 2010). "Morphological changes of the human purkinje cells and deposition of neuritic plaques and neurofibrillary tangles on the cerebellar cortex of Alzheimer's disease". American Journal of Alzheimer's Disease & Other Dementias. 25 (7): 585–91. doi:10.1177/1533317510382892. PMID 20870670. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fekadu, Makonnen (27 March 2009). "Rabies encephalitis, Negri bodies within the cytoplasm of cerebellar Purkinje cell neurons". CDC/Frontal Cortex Inc. مؤرشف من الأصل في 26 ديسمبر 2017. اطلع عليه بتاريخ 21 يونيو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) Note: not peer-reviewed.
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علوم عصبية
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
