حمض الألجينيك
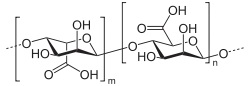
حمض الألجينيك يسمى أيضًا الألجينات، هو متعدد سكّريد شاردي منتشر انتشارًا كبيرًا في الجدران الخلوية للطحالب الخلوية، وعند مزجها بالماء تترابط وتشكل صمغًا [الإنجليزية] لزجًا. ويقوم الشكل المستخلص من الألجينات بامتصاص الماء سريعًا، فهو قادر على امتصاص 200-300 مرة من وزنه ماءً.[1] ولونها يتفاوت من الأبيض إلى البني المصفر. وتباع الألجينات بشكل مسحوق أو حبيبي أو ليفي.
| حمض الألجينيك | |
|---|---|
 حمض الألجينيك | |
| أسماء أخرى | |
E400 | |
| المعرفات | |
| رقم CAS | 9005-32-7 |
| الخواص | |
| الصيغة الجزيئية | (C6H8O6)n |
| الكتلة المولية | 10,000 - 600,000 |
| المظهر | أبيض إلى أصفر، مسحوق ليفي |
| الكثافة | 1.601 غ/سم3 |
| حموضة (pKa) | 1.5-3.5 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |

الاستخدامات
تمتص الألجينات الماء سريعًا مما يجعلها مفيدة كمادة مضافة في منتجات التجفاف مثل مساعدات إنقاص الوزن، وفي صناعة الورق والنسيج. وتستخدم أيضًا في معالجة الأقمشة المقاومة للماء والمقاومة للاشتعال [الإنجليزية]، وتستخدم كعامل مثخن من أجل تغليظ السوائل والمشروبات والمثلجات ومواد التجميل.
تستخدم الألجينات في المستحضرات الصيدلانية مثل Gaviscon، وBisodol وAsilone. وتستخدم بكثرة في المادة المستخدمة في الطبعات السنية في طب الأسنان، وفي الأعضاء الاصطناعية والصب الحي [الإنجليزية] كما تستخدم أحيانًا لتصنيع نسخ عن المسبوكات صغيرة الحجم. وتستخدم بكثرة في صناعة الأغذية لتثخين الحساء والهلام. تستخدم ألجينات الكالسيوم بأشكال متنوعة في المنتجات الطبية مثل تضميد الحروق لتساعدها على الشفاء ويمكن إزالتها مع ألم أقل من الضمادات التقليدية. وبسبب التوافقية الحيوية والشرجبات ثنائية التكافؤ مثل Ca2+، فإنها تستخدم في تثبيت الخلايا وفي تمحفظ [الإنجليزية] الخلايا.
وبسبب امتصاص الألجينات الماء بسرعة فإنها تستخدم في التجفيد لتتحول إلى بنية جديدة لها القابلية على التمدد. وهي تستخدمها صناعة فقد الوزن كمادة مفقدة للشهية
وفي آذار 2010، أعلن باحثون في جامعة نيوكاسل أن الحمية باستخدام الألجينات تخفض دهون الإنسان بمقدار 75%.[2]
الاستخدام الصيدلاني
عامل مثبت ، عامل مفكك في المضغوطات و المحافظ ، و عامل رافع للزوجة . يستخدم الحمض الألجيني بشكل واسع في الأشكال الصيدلانية الموضعية و الفموية ويعمد إلى استخدام الحمض الألجيني كعامل رابط ومفكك في آن واحد في المضغوطات و المحافظ بتراكيز تتراوح بين (1-5% ) كذلك يستخدم بشكل واسع كعامل رافع للزوجة و معلق في العديد من المعاجين Pastes و الكريمات و الهلامات Gels . و كعامل مثبت في مستحلبات ن/م . أما في العلاج فقد استخدم حمض الألجيني كحامل لحاصرات مستقبلات الهستامين H2 الـذي يستخـدم في عـلاج اضطرابات المنعكسات المعدية المريئية . و أخيراً يستعمل في مستحضرات التجمـيل و المنتجـات الغذائية على نحو واسع كعامل مستحلب و مثبت .[3]
التأثير على صحة الجسم
يعتبر مادة غير سامة و غير مهيجة على الرغم من أن الاستهلاك الفموي المفرط لها قد يكون ضاراً . و ربما يكون استنشاق غبار الألجينات مخرشاً يؤدي إلى حالات ربو عند عمال المصانع التي تقوم بإنتاجه . و على ما يبدو أن هذه الحالة تنجم بشكل أكبر عندما يكون التعرض لغبار الأشنة نفسها أكثر من غبار الألجين النقي. حددت منظمة الصحة العالمية الحد اليومي المقبول لحمض الألجيني و أملاح الألجينات المستخدمة كمواد مضافة للأطعمة بـ 25ملغ/كغ من وزن الجسم مقدرة بالنسبة لحمض الألجيني .
LD50 (rat,IP) = 1.6 g/kg[3]
سلامة الاستعمال
تختلف الاحتياطات المتبعة أثناء التعامل مع المادة باختلاف الكمية و ظروف التعامل معها. و قد يكون حمض الألجيني مهيجاً للعين و جهاز التنفس إذا استنشق غباره و لذلك يُنصح بحماية العين و ارتداء القفازات و القناع الواقي من الغبار و يُفضل التعامل مع هذه المادة في بيئة جيدة التهوية .[3]
التنافرات
يتفاعل مع المؤكسدات القوية ، و المعادن القلوية الترابية و مجموعة Ш آخذين بعين الاعتبار أن نستثني المغنيزيوم .[3]
ألجينات الصوديوم
ألجينات صوديوم (طحلبات الصوديوم) مركب كيميائي له الصيغة المجملة NaC6H7O6. وهو ملح الصوديوم لحمض الألجينيك (حمض الطحالب)، ويكون على شكل صمغ يستخرج من جدر خلايا الطحالب البنية.
وهي صمغ لا طعم له وهذا ما دفع لاستخدامها في الصناعات الغذائية لزيادة اللزوجة وكعامل استحلاب. وتستخدم ألجينات الصوديوم أيضًا في أقراص عسر الهضم وتحضير الطبعات السنية.
التطبيق الأساسي لألجينات الصوديوم هي في الطباعة بالأصبغة التفاعلية [الإنجليزية] حيث تستخدم كمثخنات للأصبغة التفاعلية (مثل أصبغة بورسيون التفاعلية للقطن) في طباعة النسيج بالقوالب وفي طباعة السجاد بالنفث. لا تتفاعل الألجينات مع هذه الأصبغة ويمكن غسلها بسهولة على عكس المثخنات المصنعة من النشا.
تعد ألجينات الصوديوم مُستخلِب جيد لسحب المواد المشعة من الجسم، مثل اليود-131 والسترونتيوم-90، التي تنتج عن نظائرها غير المشعة.[4][5]
المصادر
- Raymond C. Rowe, Paul J. Sheskey, Marian E. Quinn, المحرر (2009), "Adipic Acid", Handbook of Pharmaceutical Excipients (Rowe, Handbook of Pharmaceutical Excipients) (الطبعة Sixth), Pharmaceutical Pr, صفحات 11–12, ISBN 0-85369-792-2 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المحررون (link) CS1 maint: ref=harv (link) - "Seaweed to tackle rising tide of obesity". Newcastle University. مؤرشف من الأصل في 25 مارس 2010. اطلع عليه بتاريخ 22 مارس 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Handbook of Pharmaceutical Excipients SIXTH EDITION Edited by Raymond C Rowe BPharm, PhD, DSC, FRPharmS, FRSC, CPhys, MInstP Chief Scientist Intelligensys Ltd, Stokesley, North Yorkshire, UK Paul J Sheskey BSc, RPh Application Development Leader The Dow Chemical Company, Midland, MI, USA Marian E Quinn BSc, MSc Development Editor Royal Pharmaceutical Society of Great Britain, London, UK
- Sutton, A., Harrison, G. E., Carr, T. E., and Barltrop, D. Reduction in the absorption of dietary strontium in children by an alginate derivative. Br.J.Radiol. 44[523], 567. 1971
- Sutton, A., Harrison, B. E., Carr, T. E., and Barltrop, D. Reduction in the absorption of dietary strontium in children by an alginate derivative. Int.J.Radiat.Biol.Relat Stud.Phys.Chem.Med. 19[1], 79-85. 1971
- بوابة الغابات
- بوابة الكيمياء
