تنقية البروتين
تنقية البروتين هو عبارة عن سلسلة من العمليات تهدف إلى عزل نوع واحد أو عدة أنواع من البروتين من خليط معقد، عادة الخلايا أو الأنسجة أو أعضاء كاملة. تنقية البروتين أمر حيوي جدا لتوصيف الهيكلية والوظيفة والتفاعلات بين البروتينات المراد فحصها أو دراستها. تفصل عملية التنقية الأجزاء البروتينية عن غير البروتينية، ثم تفصل البروتين المطلوب عن بقية البروتينات. وعادة ما يكون فصل البروتين المطلوب عن باقي البروتينات هو الوجه الأصعب في تنقية البروتينات. وتستغل خطوات الفصل عادة الفروق في حجم البروتين، وخواصه الفيزيائية الكيميائية وميلها للارتباط ونشاطها الحيوي.
يمكن تقسيم طرق تنقية البروتينات إلى طرق تحليلية وطرق تحضيرية. والفارق بينها ليس دقيقاً، لكن العامل المحدد هو كمية البروتين التي يمكن تنقيتها بتلك الطريقة. الطرق التحليلية تسعى إلى اكتشاف البروتين والتعرف عليه في مزيج، في حين تسعى الطرق التحضيرية إلى إنتاج كميات كبيرة من البروتين لأغراض أخرى، كالاستخدام الصناعي وعلم الأحياء البنيوي، ويمكن استخدام الطرق التحضيرية في التطبيقات التحليلية، ولكن ليس العكس.
الهدف
تنقية البروتين إما أن يكون تحضيرياً أو تحليلياً. التنقية التحضيرية تسعى إلى إنتاج كميات كبيرة نسبياً من البروتين من أجل استخدامه لاحقاً. تشمل الأمثلة تحضير المنتجات التجارية مثل الأنزيمات (مثلاً: لاكتوز)، بروتينات مغذية (فصل بروتين الصويا)، وبعض المواد الصيدلية (مثلاً الأنسولين). التنقية التحليلية والتي تنتج كمية قليلة نسبياً من البروتين لأغراض تحليلية وبحثية مختلفة، تتضمن اكتشافه وتحديد كميته ودراسة بنيته البروتينية وتعديلات ما بعد التحويل ووظيفته. أول البروتينات التي تم تنقيتها لدرجة يمكن من بلورتها هي الببسين واليورياز.[1]

خطوات تمهيدية
الاستخلاص
يجب وضع البروتين في محلول عن طريق تحطيم النسيج أو الخلايا الحاوية له، اعتماداً على مصدره. هناك عدة طرق لتحقيق ذلك: التجميد والتذويب المتكرر والصوتنة والمجانسة عن طريق الضغط العالي والترشيح وجعله نفوذا عن طريق المذيبات العضوية. تعتمد الطريقة المختارة على هشاشة البروتين ومدى تجلّد الخلايا. عادة وفي معظم الطرق المتعارف عليها، تستخدم كروماتوغرافيا العمود لتحقيق التنقية. بعد عملية الاستخلاص هذه تصبح البروتينات الذوابة في المذيب، ويمكن فصلها عن الغشاء الخلوي و دي إن أي إلخ. عن طريق الطرد المركزي. عملية الاستخلاص تستخلص أيضاً الببتيداز، والذي يبدأ بهضم البروتين في المحلول. عادة إن كان البروتين حساس للتحلل البروتيني، فمن المفضل العمل بسرعة وإبقاء المستخلص بارداً، لإبطاء التحلل البروتيني.
الترسيب والإذابة التفاضلية
يعتبر الترسيب باستخدام سلفات الأمونيوم خطوة أولى شائعة عند تنقية البروتين بكميات كبيرة. ويتم ذلك عن طريق إضافة كميات متزايدة من سلفات الأمونيوم وجمع الأجزاء المختلفة من البروتين المترسب. يمكن إزالة سلفات الأمونيوم فارز دياليز. تتعرض المجموعات الكارهة للماء من البروتينات إلى الجو وتجذب غيرها من البروتينات الكارهة للماء وتتجمع. البروتينات المترسبة ستكون كبيرة بما يكفي لرؤيتها. أحد مزايا هذه الطريقة هي إمكانية تنفيذها بكلف منخفضة على كميات كبيرة جداً.
أول البروتينات التي تذوب هي البروتينات الذوابة بالماء. تتطلب تنقية البروتين الغشائي تمزيق الغشاء الخلوي بهدف عزل بروتين محدد عن البقية الموجودة في نفس الحيز الغشائي. يمكن أحياناً عزل جزء غشائي محدد أولاً، مثل عزل الميتوكندريون عن الخلية قبل تنقية البروتين الموجود في غشاء الميتوكندريون. يمكن استخدام دوديسيل كبريتات صوديوم (SDS) كمنظف لإذابة الغشاء الخلوي والمحافظة على بروتينات الغشاء في المحلول أثناء التنقية؛ ولكن بالإمكان استخدام منظفات ألطف مثل Triton X-100 أو CHAPS للمحافظة على تكوين البروتين الأصلي خلال عملية التنقية، حيث أن SDS يسبب إفساد البروتين.
الطرد المركزي الفائق
 مقالة مفصلة: طرد مركزي
مقالة مفصلة: طرد مركزي
تستخدم عملية الطرد المركزي قوة الطرد المركزي لفصل مزيج من جسيمات معلقة في سائل وذات كتل أو كثافات مختلفة. عندما يدور وعاء (عادة أنبوب أو قنينة) يحوي مزيج من البروتين أو أي مادة جسيمية أخرى، كالخلايا البكتيرية، بسرعات عالية، تولد عطالة كل جسيم قوة متناسبة مع كتلتها. نزعة جسيم ما إلى الحركة في السائل بسبب هذه القوة يقابلها المقاومة التي يبديها السائل على الجسيم.
الأثر النهائي "لتدوير" العينة في طارد مركزي هو أن الجسيمات الثقيلة والصغيرة ذات الكثافة العالية تتحرك نحو الخارج بشكل أسرع من الجسيمات الأقل ثقلاً أو من الجشيمات التي "تحتك" مع السائل بشكل أكبر. عندما يدوّر معلّق من الجسيمات في طارد مركزي، قم يتشكل "حزام" في أسفل الوعاء غني بالجسيمات الأثقل والأقل احتكاكاً مع السائل.
تبقى الجسيمات التي لم تتجمع في السائل الطافي ويمكن إزالته من الوعاء وبذلك يفصل الحزام عن المادة الطافية. تعتمد درجة الطرد المركزي على التسارع الزاوي المطبق على العينة، والذي يقاس عادة بالقوة g. إذا تم تطبيق الطرد المركزي لفترة كافية، ستصل الجسيمات في الوعاء إلى توازن والتي تتراكم فيها الجسيمات في نقطة من الوعاء حيث تتوازن عندها كثافة الطفو مع قوة الطرد المركزي. يسمح هذا التوازن في الطرد المركزي بالتنقية المطولة لل\جسيم ما.
في الطرد المركزي باستخدام وسط سكروز متدرج — يتم توليد وسط متدرج من السكروز (عادة السكروز أو الغليسيرول أو وسط متدرج في الكثافة مثل بيركول) في أنبوب بحيث تصبح التركيز الأعلى في أسفله والأدنى في أعلاه. بيركول هي علامة مسجلة مملوكة من شركات GE للعناية بالصحة. بعدها توضع طبقة من عينة البروتين في أعلى الوسط المتدرج وتدور على سرعات عالية عن طريق طرد مركزي فائق. يؤدي هذا إلى هجرة الجزيئات الثقيلة إلى أسفل الأنبوب بشكل أسرع من المواد الخفيفة. خلال الطرد المركزي دون استخدام وسط سكروز متدرج، تتعرض الجسيمات لقوة أكبر كلما بعدة أكثر عن مركز الدوران، بسبب تعرضها لقوة طرد مركزي أكبر (كلما ابتعدت، لكما تحركت أسرع). المشكلة في ذلك أنه يضيق مجال الفصل المفيد إلى مجال مرئي صغير. تدوير العينة ضعف المدة لا يعني أن الجسيمات المطلوبة ستبتعد إلى ضعف المسافة، بل ستبتعد أكثر بكثير. أما عند استخدام وسط متدرج من السكروز، فستواجه سائل متزايد الكثافة واللزوجة. سيعاكس وسط سكروز مصمم جيداً أثر تزايد قوة الطرد المركزي، بحيث تتحرك الجسيمات بشكل متناسب مع الزمن الذي تمضيه في الطرد المركزي. بعد فصل جسيمات البروتين، يجزأ الوسط ويجمع.
استراتيجيات التنقية

مفتاح تصميم عملية تنقية هو اختيار مادة بادئة. عادة لا يتوزع البروتين في النبات أو الحيوان بشكل متجانس على كامل الجسم؛ حيث تملك أعضاء أو نسج مختلفة تراكيز أعلى أو أقل من البروتين. استخدام نسيج أو عضو ذو التركيز الأعلى يساهم في خفض الحجم المطلوب لإنتاج كمية محددة من البروتين المنقى. يمكن للعلماء استخدام تكنولوجيا الدنا المأشوب إن كان البروتين متوفر بشكل قليل، أو أن قيمته عالية، وذلك لتطوير خلايا تنتج كميت كبيرة من البروتين المطلوب (يعرف هذا بنظام تعبير جيني). يسمح التعبير المأشوب بوسم البروتين، مثلا وسم بولي- هيستيدين (His-tag)، لتسهيل التنقية، ما يعني أن التنقية يمكن أن تتم بخطوات أقل. إضافة لذلك فإن التعبير المأشوب يبدأ عادة بنسبة أكبر من البروتين المطلوب مقارنة بالموجود في المصادر الطبيعية.
عادة ما تستفيد التنقية التحليلية من ثلاث خواص لفصل البروتين. الأولى، يمكن تنقية البروتين اعتماداً على نقطة التساوي الكهربي وذلك بتمريره بعمود هلام pH مدرج (pH graded gel) أو عمود تبادل أيوني. ثانياً، يمكن فصل البروتينات اعتماداً على حجمها أو كتلتها الجزيئية عن طريق كروماتوغرافيا الإقصاء الحجمي أو تحليل إس دي إس بايج (SDS-PAGE - الفصل الكهربائي لهلام كبريتات دوديكل الصوديوم متعددالأكريلامايد). عادة ما تنقى البروتينات باستخدام 2D-PAGE (الفصل الكهربائي لهلام ثنائي الأبعاد) وبعدها يحلل عن طريق بصمة كتلة الببتيد (Peptide mass fingerprinting) لإثبات هوية البروتين. وهذا مفيد جداً للأغراض العلمية إذ يكفي في هذه الأيام بعض النانو-غرامات من البروتين لتحليلها. ثالثاً، يمكن فصل البروتينات عن طريق القطبية/كراهية الماء باستخدام كروماتوغرافيا سائلة عالية الأداء أو كروماتوغرافيا الطور المعكوس.
تتضمن إجرائيات تنقية البروتين عادة خطوة كروماتوغرافية أو أكثر. الإجراء البسيط في الكروماتوغرافيا هي ضخ محلول يحوي البروتين في عمود محشو بمواد مختلفة. حيث تتأثر البروتينات المختلفة مع مواد العمود بشكل مختلف، وبذلك يمكن فصلها بالوقت اللازم للمرور بالعمود، أو الشروط المطلوبة لاستخلاص البروتين من العمود. عادة ما يكشف عن البروتينات أثناء خروجها من العمود بامتصاصها عند 280 نانو-متر. ويوجد عدة طرق كروماتوغرافية مختلفة:
كروماتوغرافيا الإقصاء الحجمي
 مقالة مفصلة: استشراب عبور الهلام
مقالة مفصلة: استشراب عبور الهلام
يمكن استخدام الكروموتوغرافيا لفصل بروتين في محلول أو ظروف افساد باستخدام هلام مسامي. تعرف هذه التقنية بكروموتوغرافيا الإقصاء الحجمي. مبدأها أن الجزيئات الأصغر عليها أن تعبر حجماً أكبر في النسيج المسامي. لذا ستحتاج البروتينات ذات القياسات المختلفة إلى كمية مختلفة من الشاطِف (المذيب) قبل أن تصل إلى الطرف الآخر من عمود الهلام وتجمع من هناك.
عند الحديث عن تنقية البروتينات، فعادة ما يجمّع الشاطف في أنابيب اختبار مختلفة. ويتم إهمال كل أنابيب الاختبار التي لا يوجد فيها أثر قابل للقياس من البروتين المطلوب. المحلول المتبقي يحوي البروتين المطلوب تنقيته، إضافة إلى بروتينات أخرى ذات حجم مشابه.
الفصل اعتماداً على الشحنة أو كراهية الماء
كروماتوغرافيا التفاعل الكاره للماء
يحوي وسط كروموتوغرافيا التفاعل الكاره للماء (HIC) أجزاء كارهة وأجزاء محبة للماء معاً (amphiphilic)، مما يسمح بفصل البروتينات اعتماداً على كرهها السطحي للماء. التفاعلات بين الراتنج والأجزاء الكارهة للماء من البروتين تكون ضعيفة جداً، لكن يتم تحسين هذا التفاعل بوضع عينة البروتين في وسط HIC راتنجي في صاد (buffer) ذو قوة أيونية كبيرة. بعدها يتم تخفيف القوة الأيونية للصاد من أجل تخفيف الكراهية للماء لاستخراج البروتينات.[2]
كروماتوغرافيا التبادل الأيوني
 مقالة مفصلة: كروماتوغرافيا التبادل الأيوني
مقالة مفصلة: كروماتوغرافيا التبادل الأيوني
تفصل كروماتوغرافيا التبادل الأيوني المكونات اعتماداً طبيعة وردجة شحنتها الأيونية. يتم اختيار العمود الذي سيستخدم اعتماداً على نوع وقوة الشحنة. تملك راتنجات التبادل الأنيوني شحنة موجبة وتستخدم لإبقاء وفصل المركبات المشحونة سلبياً، في حين تملك راتنجات التبادل الكاتيوني شحنة سالبة وتستخدم في فصل الجزيئات المشحونة إيجابياً.
قبل بدء الفصل يتم ضخ الصاد (buffer) عبر العمود لموازنة الأيونات المشحونة عكسياً. عند حقن العينة تتبادل الجزيئات الذائبة مع أيونات الصاد حيث أن كل منها يتنافس على أماكن الارتباط في الراتنج. مدة إبقاء كل محلول يعتمد على قوة شحنته. ستستخلص المكونات المشحونة بشكل ضعيف أولاً، يتبعها تلك المشحونة بشكل أكبر. وبسبب طبيعة آلية الفصل هذه، تلعب كل من درجة الحرارة وتركيز الصاد ونوعه ودرجة pH أدواراً مهمة في التحكم بالفصل.
إن كروماتوغرافيا التبادل الأيوني أداة قوية جداً تستخدم في تنقية البروتين وتستخدم عادة في كل من الفصل التحضيري والتحليلي.

كروماتوغرافيا انجذابية
 مقالة مفصلة: كروماتوغرافيا انجذابية
مقالة مفصلة: كروماتوغرافيا انجذابية
إن الكروماتوغرافيا الانجذابية هي تقنية فصل اعتماداً على التعديل الجزيئي، والذي كثيراً ما يستخدم راتنجات حسب التطبيق. تملك هذه الراتنجات ربائط (ligands) موجودة على سطحها وخاصة بالمركب المراد فصله. غالباً ما تعمل بطريقة مشابهة لتفاعلات جسم مضاد-مستضد. يناسب هذا "المفتاح والقفل" بين الربيطة والهدف مما يجعلها خصوصيتها بالارتباط بالمركب المطلوب عالية، وعادة ما تكون على شكل قمة واحدة، في حيث لا يتم تخزين كل شيء متبقي في العينة.
العديد من الأغشية البروتينية هي بروتين سكري ويمكن تنقيتها بكروماتوغرافيا انجذابية للليكتين (lectin). يمسح للبروتينات المنحلة في المنظف بالارتباط بالراتنج الكروماتوغرافي الذي تم تعديله ليملك ليكتين مرتبط تشاركياً. في حين تغسل البروتينات التي لم ترتبط بالليكتين ثم يتم استخلاص البروتينات السكرية المرتبطة بإضافة تركيز عالي من سكر ينافس البروتينات السكرية المرتبطة في موقع ارتباط الليكتين. تملك بعض الليكتينات انجذابية عالية للسكريات قليلة التعدد (oligosaccharides) للبروتينات السكرية مما يجعل من الصعب تنافسها مع السكريات، ويجب تحرير البروتينات السكرية المرتبطة عن طريق إفساد الليكتين.
الارتباط بمعدن
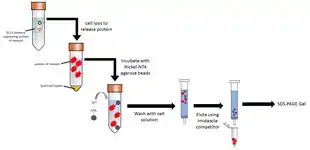
تتضمن التقنية الشائعة هندسة سلسلة من 6 إلى 8 هيستيدينات (histidines) إلى البوابة N- أو C- من البروتين. يرتبط البولي-هيستيدين بقوة مع أيونات المعادن ثنائية التكافؤ كالنيكل والكوبالت. يمكن تمرير البروتين خلال عمود يحوي أيونات نيكل غير متحركة والتي ترتبط بوسم البولي-هيستيدين. تمر كل البروتينات غير الموسومة خلال العمود. يمكن استخلاص البروتين باستخدام الإِيميدازول، والذي ينافس وسم البولي-هيستيدين بالارتباط بالعمود، أو عن طريق إنقاص pH (عادة إلى 4.5)، مما يقلل من انجذابية الوسم للراتنج. تستخدم هذه الإجرائية لتنقية البروتينات المأشوبة مع وسم انجذاب مُهندَس (مثل 6xHis أو Clontech's HAT)، كما يمكن أن تستخدم للبروتينات الطبيعية ذات الانجذاب الطبيعي إلى الكاتيونات ثنائية التكافؤ.
كروماتوغرافيا الانجذاب المناعي

تستخدم كروماتوغرافيا الانجذاب المناعي الارتباط النوعي للجسم المضاد مع البروتين الهدف لتنقية البروتين بشكل انتقائي. يتضمن الإجراء تثبيت الجسم المضاد في مادة العمود، والتي ترتبط فيما بعد بالبروتين بانتقائية، فيما يمر كلما تبقى خلال العمود. يمكن استخلاص البروتين عن طريق تغيير درجة pH أو الملوحة. يمكن استخدام هذه الطريقة مع البروتينات من المصادر الطبيعية لأنها لا تتضمن هندسة وسم.[3]
فصل بروتين موسوم
طريقة أخرى في فصل البروتين تقوم على هندسة وسم ببتيد مستضد هلى البروتين، ثم تنقية البروتين على عمود أو عن طريق حضن راتنج مهلهل مغطى بمادة مستضدة غير متحركة/ثابتة. يعرف هذا الإجراء بالترسيب المناعي. يمكن للترسيب المناعي توليد تفاعل انتقائي جداً والذي عادة ما ينتج البروتين المطلوب فقط. بعدها يمكن بسهولة فقل البروتينات الموسومة والمنقاة عن البروتينات الأخرى في المحلول واستخراجها مرة أخرى في محلول نظيف.
عندما لا نعود بحاجة للوسوم، يمكن التخلص منها عن طريق ببتيداز. وهذا عادة ما يتضمن هندسة مكان إزالة الببتيداز بين الوسم والبروتين.
كروماتوغرافيا سائلة عالية الأداء
 مقالة مفصلة: كروماتوغرافيا سائلة عالية الأداء
مقالة مفصلة: كروماتوغرافيا سائلة عالية الأداء
الكروماتوغرافيا السائلة عالية الأداء أو الكروماتو غرافيا السائلة عالية الضغط هي نوع من الكروماتوغرافيا الذي يطبق ضغط عالي لدفع المحاليل خلال العمود بشكل أسرع. مما يعني اختصار الانتشار وتحسيد الدقة. أكثر الأنواع شيوعاً هو "الطور المعكوس"، حيث تكون مادة العمود كارهة للماء. يتم استخراج البروتينات عن طريق تدرج من كميات متزايدة من مذيب عضوي، مثل الأسيتونتريل. يستخلص هذا البروتينات حسب كراهيتها للماء. بعد التنقية باستخدام HPLC يصبح البروتين في محلول يحوي فقط على مركبات تطايرية، يمكن تجفيدها بسهولة.[4] تؤدي التنقية باستخدام HPLC إلى إفساد البروتينات المنقاة وذلا فلا يمكن تطبيقها إن على البروتينات التي لا تنطوي مجدداً بشكل تلقائي.
تركيز البروتين المنقى

غالباً يجب تركيز البروتين، بعد انتهاء عملية التنقية. وهناك عدة طرق للقيام بذلك.
التجفيد
يمكن تجفيد (تجفيف) المحلول إن لم يكن يحوي على أي مكونات ذائبة غير البروتين المطلوب. يتم هذا عادة بعد استخدام HPLC. مما يؤدي إلى تطاير المواد الطيارة، تاركة البروتين خلفها.
الترشيح الفائق
وذلك بترشيح المحلول البروتيني باستخدام أغشية نفوذة بشكل انتقائي. وظيفة الغشاء هو السماح للماء والجزيئات الصغيرة بالعبور وإبقاء البروتين. يتم ضغط المحلول عبر الغشاء باستخدام مضخة ميكانيكية، أو ضغط هواء، أو طرد مركزي.
تقدير ناتج التنقية
أبسط طريقة عامة لمراقبة عملية التنقية هي عن طريق إس دي إس بايج (SDS-PAGE - الفصل الكهربائي لهلام كبريتات دوديكل الصوديوم متعددالأكريلامايد) من بين الخطوات المختلفة. تعطي هذه الطريقة قياساً تقريبياً لكميات البروتينات المختلفة في المزيج، ولا يمكنها التفريق بين البروتينات التي تملك نفس الوزن الجزيئي الظاهر.
إن كان للبروتين خواص طيفية مميزة أو نشاط أنزيمي، يمكن استخدام هذه الخاصة لكشف وحساب كمية بروتين محدد، وأيضاً لانتقاء أجزاء الفصل التي تحوي البروتين. إن توافرت أجسام مضادة للبروتين فيمكن عندها استخدام لطخة ويسترن أو أليزا لكشف وحساب كمية البروتين المطلوب. تعمل بعض البروتينات كمستقبلات ويمكن الكشف عنها أثناء التنقية عن طريق فحص ارتباط الربيطة، عادة عن طريق ربيطة مشعة (radioactive ligand).
بغرض تقييم عملية التنقية متعددة الخطوات، يجب مقارنة كمية البروتين المطلوب مع الكمية الكلية من البروتين. والتي يمكن تحديدها عن طريق فحص برادفورد للبروتين أو عن طريق امتصاص الضوء عند 280 نانو-متر. لكن قد تؤثر بعض المركبات المستخدمة أثناء التنقية على حساب الكمية. كمثال، فإن إيميدازول (المستخدم عادة لتنقية البروتينات المأشوبة والموسومة باستخدام بولي-هيستيدين) هو نظير لحمض أميني وفي التراكيز الخفيفة سيؤثر على فحص حمض بيسنكروننيك (bicinchoninic acid - BCA) لقياس كمية البروتين الكلية. شوائب الإيميدازول ذو الجودة المنخفضة ستمتص أيضاً عند 280 نانو-متر، مما يؤدي إلى قراءة غير دقيقة لتركيز البروتين من امتصاص الأشعة فوق البنفسجية.
من الطرق الأخرى المعتبرة هي رنين سطح البلاسمون (Surface Plasmon Resonance - SPR) ويمكن لهذه الطريقة الكشف عن الجزيئات غير الموسومة على سطح شريحة. إن كان البروتين المطلوب هو جسم مضاد، فسيتحول الارتباط مباشرة إلى نشاط للبروتين. يمكن عندها التعبير عن تركيز البروتين النشط كنسبة من البروتين الكلي. وهذه الطريقة قوية وسريعة لتحديد نشاط البروتين والناتج الكلي. وهي تقنية قوية تحتاج إلى معدات للقيام بها.
تحليلي
فصل كهربي في ظروف إفساد
الفصل الكهربائي للهلام هو تقنية مخبرية شائعة يمكن استخدامها بالطرق التحليلية والتحضيرية معاً. يقوم مبدأ الفصل على تحرك الأيونات المشحونة في حقل كهربائي. عملياً، يتم إفساد البروتينات في محلول يحوي منظف (دوديسيل كبريتات صوديوم). وفي هذه الظروف، تنفرد البروتينات وتغطى بجزيئات المنظف المشحونة سلبياً. يتم فصل البروتينا في إس دي إس بايج اعتماداً فقط على حجمها.
في الطرق التحليلية، يرحل البروتين على شكل حلقات اعتماداً على حجمه. كل حقلة يمكن الكشف عنها باستعمال صبغة مثل صبغة كوماسي الزرقاء (Coomassie Brilliant Blue) أو الصبغة الفضية. تتطلب الطرق التحضيرية المستخدمة في تحضير كميات كبيرة من البروتين استخلاص البروتين من هلام الفصل الكهربائي. قد تتضمن عملية الاستخلاص هذه استئصال الجل الحاوي على حلقة، أو استخلاص الحلقة مباشرة عند خروجها من الهلام.
في سياق استراتيجيات التنقية، فإن الفصل الكهربائي بظروف إفساد يوفر دقة أفضل من كروماتوغرافيا الإقصاء الحجمي، لكن لا يمكن توسيعها لتشمل كميات كبيرة من البروتين في العينة كما في كروماتوغرافيا العمود.
فصل كهربي دون ظروف إفساد
من إجراءات الفصل الكهربي الهمة والذي يتم دون ظروف إفساد بهدف فصل البروتينات المعدنية النشطة حيوياً (bioactive metalloproteins) في خلائط بروتينية معقدة وتدعى 'الفصل الكهربائي المستمر الأصلي التحضيري الكمي لهلام متعددالأكريلامايد' (بالإنجليزية: quantitative preparative native continuous polyacrylamide gel electrophoresis - QPNC-PAGE).
المراجع
- "جائزة نوبل في الكيمياء 1946". مؤرشف من الأصل في 04 أغسطس 2018. اطلع عليه بتاريخ 26 كانون الثاني 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=, |تاريخ أرشيف=(مساعدة) - Kennedy, RM (1990). "Hydrophobic chromatography". Methods in enzymology. 182: 339–43. PMID 2314246. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ehle H, Horn A (1990). "Immunoaffinity chromatography of enzymes". Bioseparation. 1 (2): 97–110. PMID 1368167. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Regnier FE (October 1983). "High-performance liquid chromatography of biopolymers". Science. 222 (4621): 245–52. doi:10.1126/science.6353575. PMID 6353575. مؤرشف من الأصل في 15 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
روابط خارجية
- Protein purification in one day
- Protein purification facility
- Strategies for Protein Purification Handbook
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
