بنية ثانوية للبروتين
بروتين ثانوي البنية (بالإنجليزية: protein secondary structure ) في الكيمياء الحيوية والبيولوجيا البنائية هو البروتين في شكله العام الثلاثي الأبعاد المكون من قطاعات موضعية Local segments.[1][2][3] وتعرف البنية الثانوية بأنها نسق من الروابط الهيدروجينية في بروتين، مثل لولب ألفا وصحيفة بيتا التي تشاهد في تشكيل ذري بنائي.
.png.webp)
بمعنى آخر البنية الثانوية تتمثل في نسق من الرابطات الهيدروجينية التي تربط بين ذرة هيدروجين في جزيء أمين وذرة أكسجين في جزيءكربونيل وتكون موجودة في رابطة ببتيدية لأحد البروتينات.
يمكن لأخصائيي النظم البلورية تعيين البنية الثانوية للمواد وتسجيلها في بنك بيانات البروتين. العنصران الثانويان الأكثر شيوعا هما لوالب ألفا وصفائح بيتا، على الرغم من أن دوران بيتا وحلقات أوميغا تحدث أيضا.
وعادة ما تشكل عناصر الهيكل الثانوي بشكل عفوي كوسيط قبل طي البروتين في هيكله ثلاثي الأبعاد ثلاثي الأبعاد. ويعرف الهيكل الثانوي رسميا بنمط الروابط الهيدروجينية بين ذرات الهيدروجين الأميني وأكسجين الكربوكسيل في العمود الفقري للببتيد. ويمكن بدلا من ذلك تحديد الهيكل الثانوي على أساس النمط العادي من زوايا ثنائي السطوح العمود الفقري في منطقة معينة من مؤامرة راماشاندران بغض النظر عما إذا كان له روابط الهيدروجين الصحيحة.
وقدم مفهوم الهيكل الثانوي لأول مرة من قبل كاج ألريك ليندرستروم لانج في ستانفورد في عام 1952. وهناك أنواع أخرى من البوليمرات الحيوية مثل الأحماض النووية تمتلك أيضا هياكل ثانوية مميزة.
الأنواع
أكثر الهياكل الثانوية شيوعا هي خلاطات ألفا وصفحات بيتا.
واللوالب الأخرى، مثل لولب 310 ولولب π تكون لها أنماط مواتية هيدروجين مواتية، ولكنها نادرا ما تلاحظ في البروتينات الطبيعية إلا في نهايات لولب α بسبب التعبئة العمود الفقري غير المواتية في وسط اللولب.إن المنعطفات الضيقة والحلقات الفضفاضة والمرنة تربط عناصر الهيكل الثانوي "العادية". لفائف عشوائية ليست بنية ثانوية حقيقية، ولكن هو فئة من المطابقة التي تشير إلى غياب الهيكل الثانوي العادية. الأحماض الأمينية تختلف في قدرتها على تشكيل مختلف عناصر الهيكل الثانوي. البرولين والجليكاين تعرف أحيانا باسم "قواطع الحلزون" لأنها تعطل انتظام التشكيل الفقري لولب α. ومع ذلك، على حد سواء لديهم قدرات التوافق غير عادية وتوجد عادة في المنعطفات. الأحماض الأمينية التي تفضل اعتماد التوافق حلزونية في البروتينات تشمل الميثيونين، ألانين، ليوسين، الغلوتامات وليسين ("مالك" في الأحماض الأمينية الأحرف حرف واحد)؛ وعلى النقيض من ذلك، فإن المخلفات العطرية الكبيرة (التربتوفان، التيروزين والفينيل ألانين) والأحماض الأمينية المتفرعة من C (إيزولوسين، فالين، وثريونين) تفضل اعتماد توافق β-ستراند.
ومع ذلك، هذه التفضيلات ليست قوية بما فيه الكفاية لإنتاج طريقة موثوق بها للتنبؤ بنية ثانوية من تسلسل وحده. ويعتقد أن الاهتزازات الجماعية ذات التردد المنخفض تكون حساسة للصلابة المحلية داخل البروتينات، وكشف عن هياكل بيتا لتكون أكثر جمودا من البروتينات ألفا أو مختلطة بشكل عام. قياسات نثر النيوترون قد ربطت مباشرة السمة الطيفية في ~ ثز ~ إلى الاقتراحات الجماعية للهيكل الثانوي للبروتين بيتا غفب. قد تكون أنماط الترابط الهيدروجيني في الهياكل الثانوية مشوهة بشكل كبير، مما يجعل التحديد التلقائي للهيكل الثانوي صعبا. هناك عدة طرق لتحديد بنية البروتين بشكل رسمي
التحديد التجريبي
يمكن تقدير محتوى البنية الثانوية الخام للبوليمر الحيوي (على سبيل المثال، "هذا البروتين هو 40٪ α-هيليكس و20% β-شيت.") مطيافيا. وبالنسبة للبروتينات، فإن الطريقة الشائعة هي الأشعة فوق البنفسجية البعيدة المدى (الأشعة فوق البنفسجية فوق البنفسجية، 170-250 نانومتر). يشير الحد الأدنى المزدوج وضوحا في 208 و222 نانومتر هيكل لولب α، في حين أن الحد الأدنى واحد في 204 نانومتر أو 217 نانومتر يعكس هيكل عشوائي لفائف أو β ورقة، على التوالي.
وهناك طريقة أقل شيوعا هي الطيف بالأشعة تحت الحمراء، الذي يكشف الاختلافات في التذبذبات السندات من مجموعات أميد بسبب الهيدروجين الرابطة. وأخيرا، يمكن تقدير محتويات هيكل الثانوي بدقة باستخدام التحولات الكيميائية لطيف NMR غير مخصص في البداية.
تنبؤ الهيكل
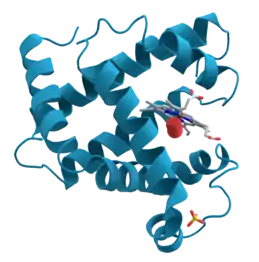
(كان هذا البروتين أول بروتين يكشف عن بنيته بطريقة التعيين البلوري بالأشعة السينية، وقام بها العالمان ماكس بيروتس وجون كندرو في عام 1958، وحصلا بسبب هذا السبق العلمي على جائزة نوبل في الكيمياء في عام 1962).
إن التنبؤ بالهيكل الثالث للبروتين من تسلسل الأحماض الأمينية هو مشكلة صعبة للغاية (انظر التنبؤ ببروتين البروتين)، ولكن استخدام تعريفات البنية الثانوية البسيطة هي أكثر قابلية للمسار. كانت الطرق المبكرة للتنبؤ بالهيكل الثانوي تقتصر على التنبؤ بالدول الثلاث السائدة: الحلزون، أو الورقة، أو الملف العشوائي. واستندت هذه الأساليب على بروتينات الحلزون أو صفائح تشكيل الأحماض الأمينية الفردية، وأحيانا إلى جانب قواعد لتقدير الطاقة الحرة لتشكيل عناصر الهيكل الثانوي. وكانت هذه الأساليب دقيقة ~ 60٪ عادة في التنبؤ أي من الدول الثلاث (هيليكس / ورقة / لفائف) تتبنى بقايا. كانت الطريقة الأولى المستخدمة على نطاق واسع للتنبؤ بنية البروتين الثانوي من تسلسل الأحماض الأمينية طريقة شو-فسمان.
وقد أجريت زيادة كبيرة في الدقة (إلى ما يقرب من 80% تقريبا) من خلال استغلال محاذاة تسلسل متعددة. مع العلم أن التوزيع الكامل للأحماض الأمينية التي تحدث في موقع (وفي جوارها، وعادة ما تكون 7 بقايا على كلا الجانبين) طوال التطور يوفر صورة أفضل بكثير للميول الهيكلية بالقرب من هذا الموضع. للتوضيح، بروتين معين قد يكون الجلايسين في موقف معين، والتي في حد ذاتها قد تشير إلى ملف عشوائي هناك. ومع ذلك، قد تكشف محاذاة تسلسل متعددة أن الأحماض الأمينية تفضل الحلزون تحدث في هذا الموقف (والمواقف القريبة) في 95٪ من البروتينات متماثلة التي تمتد ما يقرب من مليار سنة من التطور. وعلاوة على ذلك، من خلال فحص متوسط هدروفوبيسيتي في ذلك والمواقف القريبة، نفس المحاذاة قد تشير أيضا إلى نمط من بقايا المذيبات إمكانية الوصول يتفق مع لولب α. مجتمعة، وهذه العوامل تشير إلى أن الجلايسين من البروتين الأصلي يعتمد هيكل لولب α، بدلا من لفائف عشوائية. وتستخدم عدة أنواع من الطرق للجمع بين جميع البيانات المتاحة لتشكيل التنبؤ حالة 3، بما في ذلك الشبكات العصبية، ونماذج ماركوف خفية وآلات ناقلات الدعم.
توفر أساليب التنبؤ الحديثة أيضا درجة الثقة لتنبؤاتها في كل موقف. وقد تم قياس أساليب التنبؤ بالهيكل الثانوي بشكل مستمر، على سبيل المثال، إيفا (معيار). وبناء على هذه الاختبارات، كانت الأساليب الأكثر دقة هي بسيبريد، سام، بورتر، بروف، وسابل. ويبدو أن المجال الرئيسي للتحسين هو التنبؤ بالخطوط β؛ وتوقعت بقايا بثقة كما β حبلا من المرجح أن يكون ذلك، ولكن الطرق هي عرضة للتغاضي عن بعض شرائح β حبلا (السلبيات كاذبة).
ومن المرجح أن يكون الحد الأعلى لدقة التنبؤ بنسبة 90٪ عموما، وذلك بسبب الخصوصيات الخاصة بالطريقة المعيارية (دسب) لتخصيص فئات الهيكل الثانوي (هيليكس / ستراند / سويل) إلى هياكل بدب، والتي تقاس عليها التنبؤات.
التنبؤ الدقيق للهيكل الثانوي هو عنصر أساسي في التنبؤ بالهيكل الثالث، في جميع الحالات أبسط (نمذجة التناظر). على سبيل المثال، نمط التنبؤ بثقة من ستة عناصر هيكل ثانوي βαββαβ هو توقيع أضعاف فيريدوكسين.
تطبيقات
ويمكن استخدام كل من البروتين والهياكل الثانوية الحمض النووي للمساعدة في محاذاة تسلسل متعددة. ويمكن جعل هذه المحاذاة أكثر دقة من خلال إدراج معلومات الهيكل الثانوي بالإضافة إلى معلومات تسلسل بسيطة.
هذا هو في بعض الأحيان أقل فائدة في الحمض النووي الريبي لأن الاقتران قاعدة هو أكثر تحفظا بكثير من تسلسل. ويمكن في بعض الأحيان العثور على علاقات بعيدة بين البروتينات التي تكون هياكلها الأولية غير قابلة للتخليق عن طريق الهيكل الثانوي.
وقد تبين أن لولب- α هي أكثر استقرارا وقوية للطفرات وديسيغنيبل من β فروع في البروتينات الطبيعية، وبالتالي تصميم وظيفية جميع البروتينات α من المرجح أن يكون أسهل أن تصميم البروتينات مع كل من الحلزون والخيوط. وقد تم تأكيد هذا مؤخرا تجريبيا.
انظر أيضاً
مراجع
- Steven Bottomley (2004). "Interactive Protein Structure Tutorial". مؤرشف من الأصل في 01 مارس 2011. اطلع عليه بتاريخ January 9, 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Calligari, Paolo A.; Kneller, Gerald R. (2012-12-01). "ScrewFit: combining localization and description of protein secondary structure". Acta Crystallographica Section D (باللغة الإنجليزية). 68 (12): 1690–1693. doi:10.1107/s0907444912039029. ISSN 0907-4449. مؤرشف من الأصل في 13 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richards FM, Kundrot CE (1988). "Identification of structural motifs from protein coordinate data: secondary structure and first-level supersecondary structure". Proteins. 3 (2): 71–84. doi:10.1002/prot.340030202. PMID 3399495. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
