أكسيد القصدير الرباعي
أكسيد القصدير الرباعي (أو ثنائي أكسيد القصدير أو ثاني أكسيد القصدير) هو مركب كيميائي له الصيغة SnO2 ويكون على شكل مسحوق أبيض إلى رمادي اللون.
| أكسيد القصدير الرباعي | |
|---|---|
 أكسيد القصدير الرباعي | |
 أكسيد القصدير الرباعي | |
| الاسم النظامي (IUPAC) | |
Tin (IV) Oxide | |
| المعرفات | |
| رقم CAS | 18282-10-5 |
| بوب كيم (PubChem) | 29011 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | SnO2 |
| الكتلة المولية | 150.71 غ/مول |
| المظهر | مسحوق أبيض إلى رمادي |
| الكثافة | 6.95 غ/سم3 |
| نقطة الانصهار | 1630 °س |
| نقطة الغليان | 2500 درجة حرارة مئوية |
| الذوبانية في الماء | غير منحل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يعد هذا المركب من أحد أكاسيد القصدير، ويسمى الشكل المعدني منه كاسيتريت، والذي يمثل الخامة الرئيسية للقصدير.[3]
التحضير
يحضر المركب مخبرياً من تفاعل احتراق القصدير بأكسجين الهواء؛[4] أو من تفاعل كلوريد القصدير الرباعي مع بخار الماء عند درجات حرارة مرتفعة.
كما يمكن أن يتم تفاعل التحضير من أثر حمض الكبريتيك على القصدير ثم بالمعالجة بملح قاعدي من الهيدروكسيدات.
الخواص

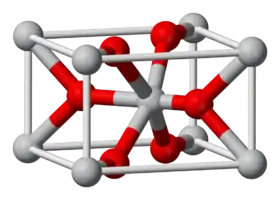
يتبلور أكسيد القصدير الرباعي وفق بنية مشابهة لبنية الروتايل، حيث تحيط كل ذرة قصدير ست ذرات أكسجين، وكل ذرة أكسجين تكون محاطة بثلاث ذرات قصدير.[3] غالباً ما يعتبر SnO2 أنه من أشباه الموصلات ذات النمط N والفقيرة بالأكسجين.[5]
لا ينحل أكسيد القصدير الرباعي في الماء، بالمقابل يمكن أن ترتبط جزيئات الماء بالبنية ويسمى الشكل المائي حينئذ من SnO2 باسم حمض القصديريك؛[4] (أو هيدروكسيد القصدير الرباعي). ينحل أكسيد القصدير الرباعي في الأحماض والقواعد، لذلك يوصف بأن له خواص مذبذبة.[6] فالمركب على سبيل المثال ينحل في الأحماض القوية مثل حمض الهيدروكلوريك وحمض الهيدرويوديك حيث تتشكل أملاح قصديرات سداسي الهالوجين الموافقة.[7][8]
بشكل مشابه ينحل أكسيد القصدير الرباعي في حمض الكبريتيك ليعطي أملاح الكبريتات الموافقة:
من جهة أخرى ينحل SnO2 في القواعد القوية ليعطي أملاح القصديرات الموافقة، كما هو الحال عند التفاعل مع هيدروكسيد الصوديوم، حيث يستحصل على ملح قصديرات الصوديوم، الذي له الصيغة Na2SnO3 بالشكل اللامائي، إلا أن الشكل الشائع منه هو اللشكل المائي الذي يكتب على الصيغة Na2[Sn(OH)6]2.
الاستخدامات
يستخدم أكسيد القصدير الرباعي على هيئة معدن كاسيتريت بشكل أساسي في استحصال القصدير، حيث يختزل صناعياً إلى الفلز باستخدام الكربون في فرن عاكس عند درجات حرارة بين 1200–1300 °C.[9]
كما يستخدم أكسيد القصدير الرباعي أيضاً مع أكسيد الفاناديوم كحفاز في أكسدة المركبات العطرية في اصطناع الأحماض الكربوكسيلية والأنهيدريدات.[3] ويستخدم أكسيد القصدير الرباعي كمتحسس غازي.[10]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/29011 — تاريخ الاطلاع: 6 أكتوبر 2016 — العنوان : Stannic oxide — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/29011
- Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. صفحات 447–48. ISBN 0-08-022057-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (المحرر), Inorganic Chemistry, تُرجم بواسطة Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Solid State Chemistry: An Introduction Lesley Smart, Elaine A. Moore (2005) CRC Press (ردمك 0-7487-7516-1)
- Inorganic & Theoretical chemistry, F. Sherwood Taylor, Heineman, 6th Edition (1942)
- Donaldson & Grimes: Chemistry of tin ed. P. G. Harrison Blackie (1989).
- Earle R. Caley: The Action Of Hydriodic Acid On Stannic Oxide. In: J. Am. Chem. Soc., 1932, 54, 8, S. 3240–3243, doi:10.1021/ja01347a028.
- Tin: Inorganic chemistry,J L Wardell, Encyclopedia of Inorganic Chemistry ed R. Bruce King, John Wiley & Son Ltd., (1995) (ردمك 0-471-93620-0)
- Abdulsattar, Mudar Ahmed; Resne, Adeebh L.; Abdullah, Shrok; Mohammed, Riyadh J.; Alared, Noon Kadhum; Naser, Elham Hanie (2019-05). "CHLORINE GAS SENSING OF SnO 2 NANOCLUSTERS AS A FUNCTION OF TEMPERATURE: A DFT STUDY". Surface Review and Letters (باللغة الإنجليزية). 26 (04): 1850172. doi:10.1142/S0218625X1850172X. ISSN 0218-625X. مؤرشف من الأصل في 6 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|date=(مساعدة)
- بوابة الكيمياء