يوبيكويتين
اليوبيكويتين بروتين تنظيمي صغير الحجم (8.5 كيلو دالتون)، وموجود تقريبًا في جميع أنسجة حقيقيات النوى، اكتشفه جدعون غولدشتاين عام 1975[1] وصفاته الأخرى اكتشفت خلال السبعينيات والثمانينات.[2] هناك أربع جينات في الجينوم البشري التي تنتج اليوبيكويتين: B، UBC، UBA52 وRPS27A .[3]
| عائلة اليوبيكويتين | |
|---|---|
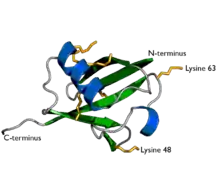 | |
| مبيان لليوبيكويتين. عرض السلاسل الجانبية السبعة للايسين باللون الأصفر البرتقالي. | |
| معرف | |
| رمز | يوبيكويتين |
| قاعدة بيانات عوائل البروتينات | PF00240 |
| إنتربرو | IPR000626 |
| بروسايت | PDOC00271 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1aar |
اليوبيكويتين عبارة عن مركب تحليلي يتواجد في الخلايا الحية ويلعب دورًا مهمًا في تحليل البروتينات المعيبة (الفاسدة) وغير الضرورية، وهو عبارة عن سلسلة بيبتيدية واحدة. إن التعديلات البروتينية يمكن أن تكون إما بروتين يوبيكيتين مفرد أو سلاسل من اليوبيكيتين .يوجد عدة أشكال من السلاسل تسمى بحسب أي من السبعة حموض أمينية من الليزين مستخدمة لربط السلاسل مع بعضها . وقد أجريت دراسات مكثفة للسلاسل( 48) المرتبطة بالحمض الأميني (الليزين ) الرابع والثمانين.. وقد نال هذا الاكتشاف جائزة نوبل للكيمياء لعام 2004.[4][5] إن السلاسل المرتبطة بالليزين (63) المرتبطة بالحمض الأميني الثالث والستين لليوبيكيتين ( ليزين ) تنظم عمليات مثل النقل الالتقامي والالتهاب والترجمة وترميم الدنا.[6]
الاستعراف

إن التمثيل السطحي لليوبيكويتين (الأصل عديد الببتيد المناعي الظاهري لليوبيكيتين) تم وصفه لأول مرة عام 1975 كبروتين بوزن 8,5 كيلودالتون غير معروف الوظيفة منتشر في كل الخلايا حقيقية النواة تم توضيح الوظائف الأساسية لليوبيكيتين ومكونات الطريق اليوبيكيتيني في أوائل الثمانينات من القرن العشرين من قبل المؤسسة الإسرائيلية للتكنولوجيا (technion) من قبل Agron Ciechanover و Avram Hershko و Irwin Rose ولأجلها تم اكتساب جائزة نوبل لعام 2004
تم التوصيف الأولي للنظام اليوبيكيتيني كنظام تحلل بروتيني معتمد على ATP وموجود في الحيزات الخلالية (extracts) .
في هذه الحيزات وجد عديد ببتيد ثابت بالحرارة وهو العامل 1الحال البروتيني اعتمادا على (ATP) وهو ( APF-1) كعامل مساهم مرتبط بنموذج ركيزة الليزوزيم البروتينية في العملية المعتمدة على (ATP) وشوارد Mg يرتبط ( APF-1) متعدد الجزيئات بمادة جزيئية مفردة عبر روابط ايزوببتيدية وقد وجد أن هذه الارتباطات تتحطم سريعا مع تحرر (APF-1) الحر وحالما تم توصيف الاقتران البروتيني ل (APF-1) تم تحديد (APF-1) كيوبيكيتين . وتم تحديد مجموعة الكاربوكسيل للنهاية C في بقايا الغليسين 1من اليوبيكيتين (Gly 76) كالجزء الرابط لركيزة بقايا الليزين .
البروتين
| Number of residues | 76 |
| كتلة جزيئية | 8564.8448 وحدة كتل ذرية |
| نقطة تساوي الكهربائية (pI) | 6.79 |
| Gene names | RPS27A (UBA80, UBCEP1), UBA52 (UBCEP2), UBB, UBC |
| Sequence in حمض أميني | MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPD
QQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG |
- اليوبيكويتين هو بروتين صغير موجود في جميع الخلايا حقيقية النواة. وهي تؤدي وظائف لا تعد ولا تحصى من خلال اقترانها بمجموعة كبيرة من البروتينات الهدف. يمكن أن تحدث مجموعة متنوعة من التعديلات المختلفة. يتكون بروتين اليوبيكويتين من 76 حمضا أمينيا وكتلته الجزيئية حوالي 8.5 كيلو دالتون. وتشمل الملامح الرئيسية النهاية الذيلية-C وبقايا ياللايسين 7.
يتم حفظها بدرجة كبيرة بين الأنواع حقيقية النواة، يساهم اليوبيكويتين البشري واليوبيكويتين الخميرة ب 96٪ من تسلسل الهوية.
الجينات
يتم ترميز اليوبيكويتين في الثدييات لأربعة جينات مختلفة. الجينات UBA52 و RPS27A رمز لنسخة واحدة من اليوبيكويتين وهي تنصهرللبروتينات الريبوزومية L40 وS27a، على التوالي. وUBB وUBC الجينات رمز البروتينات السلائف متعددة اليوبيكويتين polyubiquitin
المنشأ
لا يعرف وجود مصنع لليوكوبينubiquin و ال ubiquitination في بدائيات النوى، ومع ذلك، يعتقد أن اليوبيكويتين قد ينحدر من بروتينات بدائية مشابهة ل (ThiS) أو (MoaD ). هذه البروتينات البدائية، رغم امتلاكها هوية تسلسل قليلة (ThiS يمتلك 14% من هوية اليوبيكويتين )، تشارك نفس جماعة البروتين، هذه البروتينات أيضاً تشارك نفس البنية الكيميائية ذات الكبريت مع اليوبيكويتين .MoaD,الذي هو متضمن في التشكيل الحيوي للعامل المساعد للمولبيدينيوم، يتداخل مع" MoeB"، الذي يعمل كأنزيم مفعل لليوبيكويتين E1 من أجل MoaD ، يقوي .الرابط بين هذه البروتينات البدائية ونظام اليوبيكويتين. يوجد نظام مشابه ل ThiS,مع E1 الخاص فيه والمشابه لأنزيم ThiF.يعتقد أيضاً أن بروتين خميرة الخباز URM-1 ، المعدل المتصل باليوبيكويتين، هو "المستحاث الجزيئي" الذي يربط العلاقة التطورية مع الجزيئات شبيهة اليوبيكويتين البدائية واليوبيكويتين.
تعديل اليوبيكوتين (Ubiquitination)
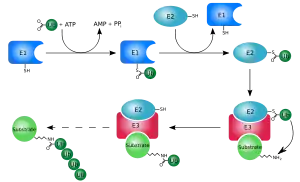
المعروف أيضاً بعملية الوبكنة (ubiquitylation) هو عملية تعديل أنزيمية ما بعد الترجمة(PTM)، يوصل فيها بروتين اليوبيكويتين إلى البروتين الركيزة. هذه العملية تربط -بشكل أكثر شيوعا - الحمض الأميني الأخير من اليوبيكويتين (الجلايسينglycine 76) إلى الليسين lycine المتبقي على الركيزة.الرابط الايزوببتيدي isopeptide يتشكل بين المجموعة الكربوكسيلية من حمض جلايسين اليوبيكويتين والمجموعة epsilon amino من ليسين الركيزة .الحالات المعروفة التي يتم فيها استخدام مجموعة أمين من النهايةN للبروتين من أجل ubiquitination، بدلا من الليسين المتبقي، في حالات قليلة نادرة تم التعرف فيها على بقايا (حمض غير الليسين )nonlysine كأهداف ل ubiquitination، مثل السيستين، وثريونين سيرين. النتيجة النهائية لهذه العملية هي إضافة جزيء واحد من اليوبيكويتين (monoubiquitination) أو سلسلة من جزيئات اليوبيكويتين (polyubiquitination) إلى البروتين الركيزة.
يتطلب تشكيل اليوبيكوتين ثلاثة انواع من الاتزيمات :الانزيم المفعل اليوبيكوتين الانزيم المقترن مع اليوبيكويتين والانزيم الرابط لليوبيكوتين والمعروفة على الترتيب بالانزيمات E1,E2,E3 .
تتالف العملية من ثلاث خطوات رئيسية :
- التفعيل : حيث يتفعل اليوبيكوتين بخطوتين انزيم E1 المفعل والمعتمد على ادينوزين ثلاثي فوسفات ATP. حيث تتضمن الخطوة البدئية إنتاج ادنيل اليوبكيتين
حيث يربط كل من ادينوزين ثلاثي فوسفات واليوبيكتين ويحفز استلة الجزء C النهائي من جزئ اليوبيكتين الخطوة الثانية: نقل اليوبكتين إلى الموقع الفعال في ثمالة السيستئين واطلاق الادينوزين احادي فوسفات. تنتج هذه الخطوة رابط كبريتي بين المجموعة الكربوكسيلية للجزء C النهائي لليوبكتين وبين مجموعة E1 لسلفيدريل السيستئين . يحتوي الجينوم البشري جينين يمتلكان القدرة على إنتاج انزيمات مفعلة لليوبكتين وهما : UBA1 و UBA6 .
- الاقتران : ان الانزيمات القارنة لليوبيكوتين E2 تحفز نقل اليوبيكوتين من الانزيم E1 إلى الموقع الفعال للسيستئين للانزيم E2 وذلك بواسطة تفاعل نقل الاسترة.
ولانجاز هذا التفاعل يرتبط الانزيم E2 مع كل من اليوبيكوتين المفعل و الانزيمE1. يمتلك البشر 35 نوع مختلف للانزيم E2 بينما تمتلك بقية المتعضيات حقيقية النواة بين 16 - 35.
حيث تتميز ببنيتها المحفوظة بشكل كبير، والمعروفة بالثنية ( الرتج ) المحفز لاقتران اليوبيكوتين. (UBC) .[7]
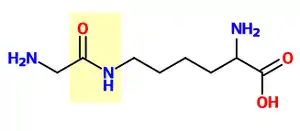
- الربط : يحفز انزيم E3 الرابط لليوبيكوتين الخطوة الاخيرة من شلال تشكيل اليوبيكتين، وذلك بتشكيل رابطة ببتيدية احادية بين a الليزين للبروتين الهدف والنهاية c لغلايسين اليوبيكتين .
عادة تتطلب هذه المرحلة فعالية واحد من مئات الانزيمات E3. ان عمل انزيمات E3 كوحدات تمييز الركازة في النظام والقادرة على التفاعل مع كل من انزيم E2 والركازة . وكذلك بعض انزيمات E3 تفعل انزيمات E2 . تمتلك انزيمات E3 واحد أو اتنين من المجالات : المجال.( HECT )المماثل للنهاية الكربوكسيلية للانزيم E6-AP . والمجال ( RING ) الجين الجديد الحقيقي ( أو المجال التابع بشكل مباشر لل U-box ). المجال HECT لانزيمات E3 تربط اليوبيكوتين بشكل عابر في هذه العملية، بينما المجال RING للانزيمات E3 تحفز الانتقال المباشر من انزيمات E2 إلى الركازة . معقد طور الصعود التحفيزي (APC) ومعقد SCF ( معقد بروتين cullin -F- box ) هما مثالان لتحت وحدات الانزيم E3 المتعددة والمشاركة في تاثير اليوبيكتين على تحطيم بروتينات هدفية خاصة بتاثير البروتياز . في شلال اليوبكتين يستطيع الانزيم E1 ان يرتبط مع العديد من انزيمات E2 والقادرة بدورها على الارتباط مع المئات من الانزيمات E3 بطريقة هرمية . يسمح وجود مستويات ضمن الشلال تنظيم كبير لالية تشكيل اليوبيكتين. كذلك تعدل البروتينات المشابهة لليوبيكتين (UBLs) بواسطة شلال الانزيمات E1-E2-E3 , بالرغم من وجود اختلافات في هذه الانظمة .
التعديلات المتنوعة لليوبيكويتين
يؤثر عملية إضافة جزيئات اليوبيكويتين Ubiquitination على العمليات الخلوية من خلال تنظيم تدرك البروتينات (بواسطة انحلال وإعادة تشكيل البروتينات)، تنسيق التوضع الخلوي للبروتينات، تفعيل وتثبيط البروتينات، وتعديل التفاعلات البروتين- البروتين. هذه التأثيرات المتنوعة تحدث بواسطة أنواع مختلفة من ركيزة اليوبيكويتين، على سبيل المثال إضافة جزيء واحد اليوبيكويتين (monoubiquitination) أو إضافة أنواع مختلفة من السلاسل اليوبيكويتين (polyubiquitination).
monoubiquitination
هو إضافة جزيء واحد من اليوبيكويتين إلى بقايا ركيزة بروتينية واحدة Multi-monoubiquitination هو إضافة جزيئ واحد من اليوبيكويتين إلى بقايا ركائز بروتينية متنوعة
وmonoubiquitination لبروتين يمكن أن يكون لها تأثيرات مختلفة على polyubiquitination لنفس البروتين. إن إضافة جزيء واحد من اليوبيكويتين أمر ضروري من أجل تشكيل سلاسل اليوبيكويتين المتعددة polyubiquitin. الMonoubiquitination يؤثر على العمليات الخلوية مثل حركة العبور عبر الأغشية الخلوية، البلعمة الخلوية والتبرعم الفيروسي.
سلاسل متعددة اليوبيكويتين "Polyubiquitin"
الرسم التخطيطي لثنائي اليوبيكويتين diubiquitin المرتبط بالنهاية 48لليسين يظهر الرابط بين اثنين من سلاسل اليوبيكويتين باللون البرتقالي. الرسم التخطيطي لثنائي اليوبيكويتين diubiquitin المرتبط بالنهاية _63 لليسين يظهر الربط بين اثنين من سلاسل اليوبيكويتين باللون البرتقالي.
Polyubiquitinat هو تشكيل سلسلة اليوبيكويتين على بقايا ليسين مفردة على البروتين الركيزة. يتبعه إضافة شاردة يوبيكويتين مفردة لركيزة البروتين، المزيد من جزيئات اليوبيكويتين يمكن أن تضاف إلى الأولى، مما أسفر عن سلسلة متعددة اليوبيكويتين polyubiquitin. هذه السلاسل تتشكل بربط بقايا الجلايسين من جزيء اليوبيكويتين إلى ليسين من اليوبيكويتين المرتبط إلى الركيزة. اليوبيكويتين يتكون من سبعة بقايا ليسين ونهاية _N التي قد تكون بمثابة نقطة تشكيل اليوبيكويتين ubiquitination. هم K6، K11، K27، K29، K33، K48، K63 و. سلاسل الليسين 48 مرتبطة أول من تم التعرف عليه وهي نوع ذو أفضل صفات لسلسلة اليوبيكويتين. وسلاسل K63 أيضا حددت صفاتها بشكل جيد، في حين أن وظيفة سلاسل الليسين أخرى، والسلاسل المختلطة، والسلاسل المتشعبة، السلاسل الخطية المنتهية بطرفN، والسلاسل الغير متجانسة (خليط من اليوبيكويتين وغيرها من البروتينات مثل اليوبيكويتين) لا تزال غير واضحة أكثر.
روابط خارجية
- GeneReviews/NCBI/NIH/UW entry on Angelman syndrome
- OMIM entries on Angelman syndrome
- UniProt entry for ubiquitin
- "7.340 Ubiquitination: The Proteasome and Human Disease". MIT OpenCourseWare. 2004. مؤرشف من الأصل في 30 سبتمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) Notes from MIT course. - Ubiquitin في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
المصادر
- Goldstein G, Scheid M, Hammerling U, Schlesinger DH, Niall HD, Boyse EA (January 1975). "Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells". Proceedings of the National Academy of Sciences of the United States of America. 72 (1): 11–5. doi:10.1073/pnas.72.1.11. PMC 432229. PMID 1078892. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wilkinson KD (October 2005). "The discovery of ubiquitin-dependent proteolysis". Proc. Natl. Acad. Sci. U.S.A. 102 (43): 15280–2. doi:10.1073/pnas.0504842102. PMC 1266097. PMID 16230621. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kimura Y, Tanaka K (June 2010). "Regulatory mechanisms involved in the control of ubiquitin homeostasis". Journal of Biochemistry. 147 (6): 793–8. doi:10.1093/jb/mvq044. PMID 20418328. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The Nobel Prize in Chemistry 2004". Nobelprize.org. مؤرشف من الأصل في 13 أغسطس 2018. اطلع عليه بتاريخ 16 أكتوبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The Nobel Prize in Chemistry 2004: Popular Information". Nobelprize.org. مؤرشف من الأصل في 30 أغسطس 2017. اطلع عليه بتاريخ 14 ديسمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Miranda M, Sorkin A (June 2007). "Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms". Molecular Interventions. 7 (3): 157–67. doi:10.1124/mi.7.3.7. PMID 17609522. الوسيط
|CitationClass=تم تجاهله (مساعدة) - van Wijk SJ, Timmers HT (April 2010). "The family of ubiquitin-conjugating enzymes (E2s): deciding between life and death of proteins". FASEB J. 24 (4): 981–93. doi:10.1096/fj.09-136259. PMID 19940261. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية
