هجرة فرع
هجرة فرع (بالإنجليزية: Branch migration) هي العملية التي يتم بواسطتها تبادل أزواج قواعد تباعًا بين سلاسل دنا متماثلة في موصل هوليداي، وذلك يحرك نقطة التفرع على طول التسلسل إلى الأمام أو إلى الخلف.[1] هجرة الفرع هي المرحلة الثانية في عملية التأشيب الجيني وتتبع تبادل قطعتي دنا منفردتين بين كروموسومين متماثلين.[2] العملية عشوائية الحدوث، ومن الممكن أن يتغير مكان نقطة التفرع في كلا اتجاهي السلسلة، وهذا يؤثر على درجة المادة الجينية التي يتم تبادلها.[1] يمكن رؤية هجرة الفرع كذلك في ترميم وتضاعف الدنا أثناء ملء الفراغات في التسلسل. كما يمكن رؤيتها حين تجتاح قطعة دنا أجنبية سلسلة دنا.[2]
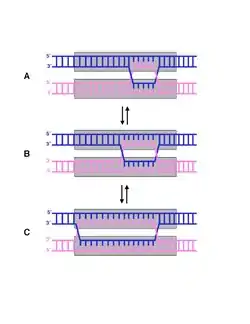
الآلية
تختلف آلية هجرة الفرع بين حقيقيات وبدائيات النوى.[2]
بدائيات النوى

تمت دراسة آلية هجرة الفرع لدى بدائيات النوى مرات عديدة في بكتيريا الإشريكية القولونية.[2] لدى إيكولاي يشكل البروتينين RuvA وRuvB مركبا يسهِّل العملية على أوجه عديدة. RuvA هو رباعي القسيمات ويرتبط بالدنا في موصل هوليداي حين يكون في الهيئة المفتوحة X. يرتبط البروتين بطريقة يبقى فيها موضع دخول/خروج سلسلة الدنا (نقطة التفرع) من موصل هوليداي حرا للدوران والانزياح عبر التسلسل. لدى RuvA نطاق ذو أحماض آمينية حمضية تتداخل مع أزواج القواعد في مركز الموصل. وهذا يفصل أزواج القواعد عن بعض لكي تتمكن من إعادة الترابط مع أزواج القواعد في السلاسل المتماثلة.[3]
من أجل حدوث الهجرة، يجب على RuvA الارتباط مع RuvB و الـATP. لدى RuvB القابلية لحلمأة الـATP وهذا يُحدث تحرك نقطة التفرع. RuvB سداسي القسيمات ووظيفته مماثلة للهيليكاز ويرتبط بالدنا كذلك. حين تتم حلمأة الـATP بقوم RuvB بتدوير السلاسل المؤشبة أثناء سحبها بعيدا عن الموصل، لكن لا يفصل القواعد كما يفعل الهيليكاز.[3]
تسمى المرحلة الأخيرة في هجرة الفرع الحل وتتطلب بروتين RuvC، وهذا البروتين ثنائي القسيمات ويرتبط بموصل هوليداي حين يتخذ هيئة التحزيم X. وظيفة هذا البروتين تماثل وظيفة النوكلياز الداخلي ويقص السلاسل في نفس الوقت تماما. يكون القص متناظرا وينتج عنه جزيئتي دنا مؤشبتين تحويان شروخا على سلسلة واحدة.[4] بعدها يتم ربط هذه الشروخ لإكمال العملية.[2]
تنظيم
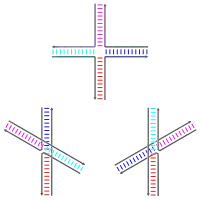
معدل هجرة الفرع متعلق بكمية الآيونات ثنائية التكافؤ، وبشكل خاص آيونات المغنزيوم (Mg2+) الموجودة أثناء عملية التأشيب.[1] تحدد الآيونات بنية موصل هوليداي التي سيتخذها، حيث أنها تلعب دورا في استقرارها. في غياب الآيونات تتشكل قوة طرد بين الأعمدة الفقرية ويتخذ الموصل بنية مفتوحة على شكل X.[6] في هذا الظرف تكون الهجرة في الحد الأمثل ويكون للموصل الحرية في التحرك على طول السلاسل.[3] حين تتواجد الآيونات فإنها تعمل على تحييد الشحنات السالبة للعمود الفقري، وهذا يسمح للسلاسل بالتحرك مقتربة من بعضها ويتخذ الموصل هيئة X المحزمة.[6] وأثناء هذه الحالة يكون الحل في الحد الأمثل، ما يسمح للبروتين RuvC بالارتباط بالموصل.[3]
مراجع
- Lilley, David M. J. (2000-05-01). "Structures of helical junctions in nucleic acids". Quarterly Reviews of Biophysics. 33 (02): 109–159. doi:10.1017/s0033583500003590. ISSN 1469-8994. PMID 11131562. مؤرشف من الأصل في 15 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Genetic Recombination | Learn Science at Scitable". www.nature.com. مؤرشف من الأصل في 31 مارس 2019. اطلع عليه بتاريخ 13 نوفمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yamada, Kazuhiro; Ariyoshi, Mariko; Morikawa, Kosuke (2004-04-01). "Three-dimensional structural views of branch migration and resolution in DNA homologous recombination". Current Opinion in Structural Biology. 14 (2): 130–137. doi:10.1016/j.sbi.2004.03.005. PMID 15093826. مؤرشف من الأصل في 15 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Górecka, Karolina M.; Komorowska, Weronika; Nowotny, Marcin (2013-11-01). "Crystal structure of RuvC resolvase in complex with Holliday junction substrate". Nucleic Acids Research (باللغة الإنجليزية). 41 (21): 9945–9955. doi:10.1093/nar/gkt769. ISSN 0305-1048. PMC 3834835. PMID 23980027. مؤرشف من الأصل في 27 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goyal N, Rossi MJ, Mazina OM, Chi Y, Moritz RL, Clurman BE, Mazin AV (2018). "RAD54 N-terminal domain is a DNA sensor that couples ATP hydrolysis with branch migration of Holliday junctions". Nat Commun. 9 (1): 34. doi:10.1038/s41467-017-02497-x. PMC 5750232. PMID 29295984. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clegg, R. M. (1993-01-01). "The Structure of the Four-Way Junction in DNA". Annual Review of Biophysics and Biomolecular Structure. 22 (1): 299–328. doi:10.1146/annurev.bb.22.060193.001503. PMID 8347993. مؤرشف من الأصل في 15 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الوراثة