نقطة حرجة (ديناميكا حرارية)
النقطة الحرجة حسب المفهوم العلمي في الكيمياء الفيزيائية والتحريك الحراري وفيزياء المواد المكثفة هي النقطة من الضغط ودرجة الحرارة التي لا يوجد فيها فواصل واضحة بين حالات المادة، (مثل فواصل بين الحالة السائلة، والحالة الصلبة، أو الحالة الغازية).
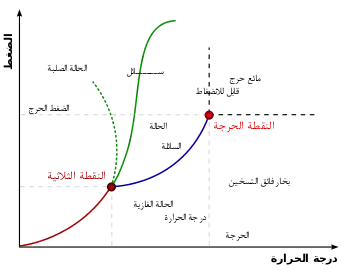
فعلى سبيل المثال تُعرف درجة الحرارة الحرجة بأنها درجة الحرارة التي فوقها لا يمكن التمييز بين الحالة الغازية والسائلة لمادة ما، مثل الماء والكحول وثاني أكسيد الكربون.
درجة الحرارة الحرجة التي فوقها لا يمكن أن توجد الحالة السائلة للمادة مهما كان الضغط المطبق عليها، وتكون المادة في حالة بين الحالة السائلة والحالة الغازية، بدون سطح فاصل بينهما.
مخطط الطور
 مقالة مفصلة: مخطط الطور
مقالة مفصلة: مخطط الطور
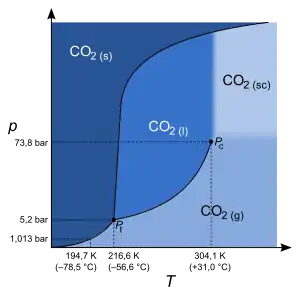
يبين الشكل رسما بيانيا للثلاثة حالات للماء : الحالة السائلة، والحالة الغازية (بخار)، والحالة الصلبة (ثلج). ويبين المخطط تحول تلك الحالات من واحدة إلى أخرى تحت تأثير درجة الحرارة (المحور السيني) والضغط (المحور الرأسي)، وذلك باعتبار أن الحجم ثابت لا يتغير.
يمثل الخط الأزرق غليان الماء وتحوله إلى بخار، حيث تكون الحالتان موجودتان كالمعتاد ومنفصلتان. بارتفاع الضغط ترتفع درجة حرارة الغليان وبالعكس عندما ينخفض الضغط تنخفض تبعا درجة حرارة الغليان. وطالما نتحرك على الخط الأزرق يكون لدينا حالتين (ماء وبخار) في توازن، أي ماء يغلى وفوقه بخار ساخن. ويمكننا الاستمرار في رفع الضغط ودرجة الحرارة حتي نصل إلى النقطة الحرجة (critical point). وعندها نصل إلى حالة لا يكون فيها الماء سائلا ولا بخارا، بل هي حالة تجمع بين الاثنين في مخلوط مشبع عالي الضغط والحرارة. وتبلغ النقطة الحرجة للماء عند درجة حرارة 647 كلفن أو 374 درجة مئوية. ويصل الضغط عند تلك النقطة إلى 218 ضغط جوي.في الرسم الخط الأخضر الصلب (غير المنقط)لا يمثل حالة الماءوقد يمثل مواد أخرى غير الماء.ولكن الخط الأخضر المنقط يمثل حالات الأتزان بين طور الماء وطور الثلج عند درجات حراره وضغوط مختلفة.
تعمل محطات القوي لاستغلال الماء وبخاره في تلك الحالة لتوليد الطاقة الكهربائية بوساطة التوربينات. وكما نعرف من دورة كارنو ترتفع كفاءة الإنتاج بارتفاع درجة حرارة البخار. لذلك تبذل محطات التوليد مجهودات لتسخين تلك الحالة المائية البخارية لدرجات أعلى من درجة النقطة الحرجة 374 درجة مئوية، لكي ترفع كفاءة تحويل الطاقة الحرارية إلى طاقة كهربائية.
المشاهدة العملية

2: Kritischer Punkt, Opaleszenz
3: Überkritisches Ethan, Fluid[1]
يمكن مشاهدة الانتقال من الحالة تحت الحرجة إلى الحالة فوق الحرجة معمليا، حيث يظهر اختلاف أطوار المادة بوضوح.
تحفط المادة في أنبوب من زجاج الكوارتز السميك لتحمل الضغوط العالية تحت ضغط معين عند درجة حرارة أقل من النقطة الحرجة. في تجربتنا هذه نجري التجربة على ثاني أكسيد الكربون الذي تبلغ درجته الحرجة 31 درجة مئوية. يكون الأنبوب ممتلئا في تلك الحالة بكمية من السائل وفوق سطحه يوجد بخاره. كلا الطورين يكون عديم اللون ويفصلهما سطح فاصل واضح ويمكن الرؤية خلالهما. وعند التسخين عند درجة حرارة أقل من الدرجة لحرجة يتمدد السائل بسبب التمدد الحراري بينما يقل حجم البخار نظرا لارتفاع الضغط. وعندما تصل درجة الحرارة إلى الدرجة الحرجة يتكون ضبابا أبيضا في كل الأنبوب لمدة قصيرة، ثم ينقشع ويختفي بزيادة ارتفاع درجة الحرارة.
إذا أجرينا التجربة على الإيثان فدرجته الحرجة 32درجة مئوية وضغطة الحرج 49 ضغط جوي (49 بار). وكلا من الميثان وثاني أكسيد الكربون ليس له لون، ويظهر لكل منهما ضباب أبيض عد النقطة الحرجة.
في تجربتنا على ثاني أكسيد الكربون ومع ارتفاع درجة الحرارة فوق النقطة الحرجة يكون الأنبوب ممتلئا بطور واحد شفاف، وتسمى تلك الحالة " سائل فوق حرج". ثم نترك الأنبوب ليبرد فيظهر الضباب الأبيض من جديد لمدة قصيرة (عند النقطة الحرجة) وسرعان ما ينفصل السائل عن بخاره مع استمرار التبريد ويصبح السطح الفاصل بينهما واضحا وتعود شفافيتهما.
تطبيقات
تتميز السوائل فوق الدرجة الحرجة بقدرة عالية على الإذابة ودرجة لزوجة منخفضة. كما تتبخر تلك السوائل في تلك الحالة لحظيا. ولذلك يمكن استخدامها كمذيبات تحت الضغط العالي. وتستغل تلك الحالة للسوائل لإنتاج المسحوقات ذات الحبيبات الدقيقة جدا.
يُستغل ثاني أكسيد الكربون - وله درجة حرجة - لاستخلاص الكافيين من القهوة والشاي، تلك الأنواع التي تباع في الأسواق لبعض مريديها من الجمهور.
ويمكن إذابة أكسيد السيليكون SiO2 في الماء فوق الدرجة الحرجة، ثم تُـجرى عملية لبلورته واستخلاص بلورات نقية للسيليكون أحادية التبلر Quarz تُستعمل بعد تقطيعها في صناعة الساعات.
كما يستخدم الماء فوق الدرجة الحرجة كمذيب في الصناعات الكيماوية وخاصة في صناعة الأدوية لاستخلاص بعض المواد الطبية من الدهون أو اللحوم التي يصعب استخلاصها بالطرق المعتادة.
النقطة الحرجة لسائل-بخار لبعض المواد
| المادة[2][3] | النقطة الحرجة (درجة مئوية) | الضغط الحرج(بار) |
|---|---|---|
| آرغون | -122.4 | 48.1 |
| الأمونيا[4] | 132.4 | 111.3 |
| بروم | 310.8 | 102 |
| سيزيوم | 1664.85 | 94 |
| كلور | 144 | 76 |
| إيثانول | 241 °C | 62 |
| فلور | -128 | 51 |
| الهيليوم | -268 | 24و2 |
| الهيدروجين | -239.95 | 12.8 |
| الكريبتون | -63.8 | 54.3 |
| الميثان | -82.3 | 45.79 |
| النيون | -228.75 | 27.2 |
| النيتروجين | -146.9 | 33.5 |
| الأكسجين | -118.6 | 49.8 |
| ثاني أكسيد الكربون | 31.04 | 72.8 |
| الزئبق | 1476.9 | 1720 |
| الكبريت | 1040 | 207 |
| الحديد | 8227 | |
| الذهب | 6977 | 5000 |
| الماء[5][6] | 373.946 | 217.7 |
سوائل فوق الحرجة لمحرك الاحتراق الداخلي
تجرى أبحاث بغرض تطبيق السوائل فوق الحرجة في تشغيل محرك احتراق داخلي. طبقا لتلك الفكرة أن تٌرفع درجة حرارة الوقود السائل فوق الدرجة الحرجة قبل حقنها في أسطوانة المحرك.[7] فيصبح الوقود قابلا للاشتعال الذاتي وبذلك يمكن الاستغناء عن شمعة الإشعال. وطبقا لما تورده بعض الوسائل الاعلامية فهناك أمل في خفض استهلاك الوقود إلى 3 لتر/ 100 كيلومتر.[8] كما تعلق آمال على أن تؤدي تلك التقنية إلى تحسين عمليات الاحتراق لأنواع أخرى من الوقود.
المراجع
- Sven Horstmann, "Theoretische und experimentelle Untersuchungen zum Hochdruckphasengleichgewichtsverhalten fluider Stoffgemische für die Erweiterung der PSRK-Gruppenbeitragszustandsgleichung", Doktorarbeit, C.-v.-O. Universität Oldenburg, 2000
- Emsley, John (1991). The Elements (الطبعة (Second Edition)). مطبعة جامعة أكسفورد. ISBN 0-19-855818-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thermodynamics: An Engineering Approach (الطبعة (Fourth Edition)). مكغرو هيل. 2002. صفحة 824. ISBN 0-07-238332-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ammonia - NH3 - Properties نسخة محفوظة 30 يونيو 2017 على موقع واي باك مشين.
- International Association for the Properties of Water and Steam, 2007.
- "Critical Temperature and Pressure". Purdue University. مؤرشف من الأصل في 22 سبتمبر 2018. اطلع عليه بتاريخ 19 ديسمبر 2006. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Non-Existent Domain نسخة محفوظة 09 نوفمبر 2018 على موقع واي باك مشين.
- Überkritische Verbesserung? | Technology Review نسخة محفوظة 07 يونيو 2016 على موقع واي باك مشين.
انظر أيضا
- بوابة الكيمياء
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
