نتريد الزنك
نتريد الزنك مركب كيميائي له الصيغة Zn3N2، ويكون على شكل مسحوق رمادي.
| نتريد الزنك | |
|---|---|
 نتريد الزنك | |
| الاسم النظامي (IUPAC) | |
نتريد الزنك | |
| المعرفات | |
| رقم CAS | 1313-49-1 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | Zn3N2 |
| الكتلة المولية | 244.15 غ/مول |
| المظهر | مسحوق رمادي |
| الكثافة | 6.22 غ/سم3 |
| الذوبانية في الماء | يتفكك |
| المخاطر | |
| ترميز المخاطر |  Xi Xi |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- عند التماس مع الماء يتفاعل نتريد الزنك بعنف (تفاعل حلمهة)، حيث يشكل الأمونياك وأكسيد الزنك:[3][4]
Zn3N2 + 3H2O → 3ZnO + 2NH3
ينحل نتريد الزنك في حمض الهيدروكلوريك [5]
- يتفاعل نتريد الزنك بشكل عكوس مع الليثيوم وذلك في التفاعلات الكهركيميائية في بطاريات الليثيوم.[6]
- مثل بافي النتريدات الأخرى مثل نتريد المغنسيوم ونتريد الليثيوم فإن لنتريد الزنك نقطة انصهار مرتفعة.[7]
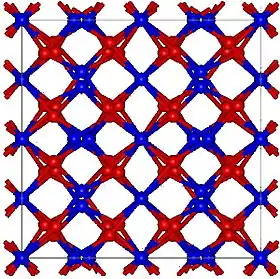
- للمركب بنية بلورية مكعبة.[8][9]
التحضير
يحضر نتريد الزنك من التفكك الحراري لمركب أميد الزنك (ثنائي أميد الزنك) في وسط خالي من الهواء عند درجات حرارة تتجاوز 200 °س، حيث يتشكل الأمونياك كناتج ثانوي:[4]
3Zn(NH2)2 → Zn3N2 + 4NH3
كما يمكن أن يحضر من تسخين فلز الزنك إلى درجة حرارة تبلغ 315°س وذلك في تيار من غاز الأمونياك، ويتشكل غاز الهيدروجين كناتج ثانوي [3][10] حسب التفاعل:
3Zn + 2NH3 → Zn3N2 + 3H2
المراجع
- معرف المكون الفريد: https://fdasis.nlm.nih.gov/srs/unii/7OOJ6UE14L — تاريخ الاطلاع: 20 نوفمبر 2016 — المحرر: إدارة الأغذية والأدوية — العنوان : zinc nitride
- صفحة البيانات الكيميائية من Alfa [وصلة مكسورة] نسخة محفوظة 26 يناير 2020 على موقع واي باك مشين.
-
Roscoe, Henry Enfield, and Carl Schorlemmer (1907) [1878]. A Treatise on Chemistry: Volume II, The Metals (الطبعة 4th). London: Macmillan. صفحات 650–51. مؤرشف من الأصل في 14 أبريل 2020. اطلع عليه بتاريخ 01 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Bloxam, Charles Loudon (1903). Chemistry, inorganic and organic (الطبعة 9th). Philadelphia: P. Blakiston's Son & Co. صفحة 380. مؤرشف من الأصل في 12 مارس 2020. اطلع عليه بتاريخ 31 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Comey, Arthur Messinger, Dorothy A. Hahn (1921). A Dictionary of Chemical Solubilities: Inorganic (الطبعة 2nd). New York: Macmillan. صفحة 1124. مؤرشف من الأصل في 12 مارس 2020. اطلع عليه بتاريخ 01 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Amatucci, G.G., and N. Pereira (2004). "Nitride and Silicide Negative Electrodes". In Gholam-Abbas Nazri and Gianfranco Pistoia (المحرر). Lithium Batteries: Science and Technology. Kluwer Academic Publishers. صفحة 256. ISBN 978-1-4020-7628-2. مؤرشف من الأصل في 26 مايو 2020. اطلع عليه بتاريخ 01 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Grolier Incorporated (1994). Academic American Encyclopedia. Danbury, Connecticut: Grolier Inc. صفحة 202. ISBN 0717220532. مؤرشف من الأصل في 12 مارس 2020. اطلع عليه بتاريخ 01 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) -
Sangeeta, D. (1997). Inorganic Materials Chemistry Desk Reference. CRC Press. صفحة 278. ISBN 978-0-8493-8900-3 تأكد من صحة
|isbn=القيمة: checksum (مساعدة). مؤرشف من الأصل في 26 مايو 2020. اطلع عليه بتاريخ 30 سبتمبر 2007. الوسيط|CitationClass=تم تجاهله (مساعدة) -
Partin, D.E., D.J. Williams, and M. O'Keeffe (1997). "The Crystal Structures of Mg3N2and Zn3N2". Journal of Solid State Chemistry. 132 (1): 56–59. doi:10.1006/jssc.1997.7407. مؤرشف من الأصل في 04 أكتوبر 2012. اطلع عليه بتاريخ 03 مايو 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Lowry, Martin Thomas (1922). Inorganic Chemistry. Macmillan. صفحة 872. مؤرشف من الأصل في 26 مايو 2020. اطلع عليه بتاريخ 01 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.