ميثيلين
الميثيلين هو مركب عضوي رمزه الكيميائي CH2 . وهو غاز عديم اللون له خاصية فلورية في نطاق الاشعة تحت الحمراء الوسطية . يمكن وجوده مستقرا في المحاليل المخففة .
| ميثيلين | |
|---|---|
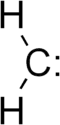 ميثيلين | |
 ميثيلين |
 ميثيلين |
| الاسم النظامي (IUPAC) | |
Dihydridocarbon(2•)[1] | |
| المعرفات | |
| رقم CAS | 2465-56-7 |
| بوب كيم (PubChem) | 123164 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| الصيغة الجزيئية | CH22• |
| الكتلة المولية | 14.0266 g mol−1 |
| المظهر | Colourless gas |
| الذوبانية في الماء | Reacts |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
386.39 kJ mol−1 |
| إنتروبيا مولية قياسية S |
193.93 J K−1 mol−1 |
| مركبات متعلقة | |
| مركبات ذات علاقة | Methyl (CH3) Methylidyne (CH) كربيد |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الميثيلين هو ابسط انوع الكربين .[2]:p.7[3] وفي العادة يمكن الكشف عنه تحت ضغط منخفض جدا , درجة حرارة منخفضة جدا أو كناتج وسطي خلال تفاعلات كيميائية.[4]
التسمية
اسم الكربين carbene هو المفضل من النظام الدولي IUPAC للميثيلين . كما يسمى احيانا "ميثيليدين " أو "ديهيدروكربون" (أي "كربون ثنائي الهيدروجين).

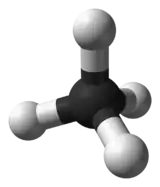
تتضح تسمية الميثيلين من قرابته لغاز الميثان المتكون من ذرة كربون مرتبط بها اربعة ذرات هيدروجين . وكما في الشكل : جزيء الميثلين هو عبارة عن جزيء ميثان منزوع منه ذرتي هيدروجين ، فهو يعتبر جذرا حرا.
اكتشافه وتحضيره
اكتشف المركب أول مرة نحو عام 1960 بواسطة مطيافية الأشعة تحت الحمراء في تجربة غاز مثلج يحمله.[5][6]
وكان أول استخدام له من "د. دك" في عام 1944 ، حيث كان يدرس حالات العزم المغزلي للكربين.[7][8]
ويمكن تحضير الميثيلين في ظروف مناسبة بواسطة تحلل مركبات بها مجموعة ميثيليدين أو مجموعة ميثانيديل ، مثل إيثينون [[(CH2=CO), و ديازوميثان خطي ( CH2=N2), و ديازيرين (حلقي) [[[-CH2-N=N-]]) و ثنائي يوديد الميثان diiodomethane (I-CH2-I).
وقد يتأثر تحلله بالضوء أو بعوامل الكيميائية ذات خواص ضوئية photosensitization مثل البنزوفينون أو يتحلل تحت فعل الحرارة .[4]
المراجع
- "methanediyl (CHEBI:29357)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 14 January 2009. IUPAC Names. مؤرشف من الأصل في 13 مايو 2019. اطلع عليه بتاريخ 02 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Roald Hoffman (2005), Molecular Orbitals of Transition Metal Complexes. Oxford. ISBN 0-19-853093-5
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "carbenes". Compendium of Chemical Terminology Internet edition.
- W. B. DeMore and S. W. Benson (1964), Preparation, properties, and reactivity of methylene. In Advances in Photochemistry, John Wiley & Sons, 453 pages. ISBN 0-470-13359-7 نسخة محفوظة 04 نوفمبر 2013 على موقع واي باك مشين.
- William B. DeMore, H. O. Pritchard, and Norman Davidson (1959), Photochemical experiments in rigid media at low temperatures. II. The reactions of methylene, cyclopentadienylene and diphenylmethylene. Journal of the American Chemical Society, volume 81, issue 22, pages 5874–5879. doi:10.1021/ja01531a008 [وصلة مكسورة] نسخة محفوظة 26 يناير 2020 على موقع واي باك مشين.
- Marilyn E. Jacox and Dolphus E. Milligan (1963), 'Infrared study of the reactions of CH2 and NH with C2H2 and C2H4 in solid argon.Journal of the American Chemical Society, volume 85, issue 3, pages 278–282. doi:10.1021/ja00886a006 [وصلة مكسورة]
- "The Spin States of Carbenes. (No. 3036)", P.P. Gaspar and G.S. Hammond, Chapter 12 in "Carbene Chemistry", Vol. 1. W. Kirmse, Editor, Academic Press, New York, pp 235-274 (1964)
- "If I mix CH2 with NH4 and boil the atoms in osmotic fog, I should get speckled nitrogen." Walt Disney's Comics and Stories, issue 44, 1944
- بوابة الكيمياء
- بوابة علم الفلك
