مسعر قنبلي
يستخدم المسعر القنبلي في الكيمياء (بالإنجليزية: Bomb calorimeter) لتعيين القيمة الحرارية لمادة تحترق في جو من الأكسجين تحت ضغط عال. يستخدم لذلك وعاء من الحديد الصلب مبرد بالماء، ويوضع به ما يسمى "قنبلة" (العينة). يملأ جو القنبلة بغاز الأكسجين عند ضغط بين 20-30 بار (ضغط جوي). وتوضع المادة المراد اختبارها في بوتقة ثم توضعان في القنبلة، وتُشعل بواسطة قوس كهربائي (شرارة كهربائية). وبتعيين الزيادة في درجة حرارة المسعر، وكتلته، وحرارته النوعية يمكن حساب القيمة الحرارية لمادة العينة.
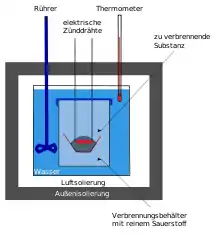

توجد عدة طرق للقياس، أغلب ما يستعمل منها الطريقة الأديباتية.
طريقة القياس
تستخدم كمية قدرها 1 - 1.5 جرام من مادة العينة المراد تعيين قيمتها الحرارية. وبوضعها في القنبلة من الفولاذ يتم التفاعل في جو الأكسجين دون تغير في الحجم.
ونظرا لأنه لا يحدث تبادل للحرارة بين المسعر والوسط المحيط Q = 0 (أديباتي) ; وبالتالي فلا شغل يؤدي W = 0.
فيكون التغير في الطاقة الداخلية :
- ΔU(total) = Q + W = 0
ويكون التغير في الطاقة الداخلية :
- ΔU(total) = ΔU(system) + ΔU(surroundings) = 0
ويكون عند حجم ثابت dV = 0 :
- ΔU(system) = - ΔU(surroundings) = -Cv ΔT
حيث Cv = الحرارة النوعية للقنبلة.
ولابد من معايرة القنبلة قبل استخدامها لتعيين حرارة احتراق العينة المجهولة. ويمكن تعيين الحرارة النوعية لها Cv من :
- (Cv (calorimeter) = m (water). Cv (water) + m (steel). Cv (steel
ويمكننا قياس كتلة الماء (m (water وكتلة الفولاذ ( m (steel :
وبمعرفة الحرارة النوعية لكل من الماء والفولاذ :
Cv(water)= 1 cal/g.K
Cv(steel)= 0.1 cal/g.K
وتستخدم للمعايرة مادة اشتعالية معروفة حرارتها النوعية :
- Cv = Hc/ΔT
مثل حمض البنزويك (Hc = 6318 cal/g) أو حمض بي-ميثيل البنزويك ( p-methyl benzoic acid (Hc = 6957 cal/g.
وتقاس درجة الحرارة (T) كل دقيقة ونعين :(ΔT = T(final) - T(initial
كما لابد من أخذ الحرارة الناتجة عن اشتعال السلك الكهربائي الرفيع المستخدم للإشعال في الحسبان، ويستخدم عادة سلك من رفيع من النيكل ، وتبلغ الحرارة الناتجة عن اشتعاله (لكل جرام) = 981.3 cal/g.
المعايرة :

لمعايرة القنبلة يؤخذ كمية صغيرة (~10 cm) ويوزن قبل وبعد الاشتعال.
- كتلة السلك المحترقة :(Δm = m(before) - m(after
يبلغ الحرارة الناتجة عن احتراق عينة حمض البنزويك في القنبلة :
- ΔHc = ΔHc (benzoic acid) x m (benzoic acid) + ΔHc (Ni fuse wire) x Δm (Ni fuse wire)
أي أن :
ΔHc = Cv. ΔT → Cv = ΔHc/ΔT:
وبتعيين Cv للقنبلة، تصبح القنبلة مستعدة لتعيين القيمة الحرارية لأي عينة أخرى مجهولة.
- ΔHc = Cv. ΔT
انظر أيضا
- مسعر
- حرارة
- طاقة حرارية
- ديناميكا حرارية
- مقاومة التلامس الحراري (Thermal contact resistance)
مراجع
- Polik, W. (1997). Bomb Calorimetery. Retrieved from http://www.chem. hope. edu/ ~polik/Chem345-1997/calorimetry/bombcalorimetry1.html
- Bozzelli, J. (2010). Heat of Combustion via Calorimetry: Detailed Procedures. Chem 339-Physical Chemistry Lab for Chemical Engineers –Lab Manual.
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
- بوابة الكيمياء
