مستقبل مستضد خيمري
مستقبلات المستضد الخيمرية[1] (بالإنجليزية: Chimeric antigen receptor) أو اختصارا كار (بالإنجليزية: CAR) أو أيضا المستقبلات الخيمرية للخلايا التائية هي عبارة عن مستقبلات اصطناعية تم إنشاءها خصيصا في المختبر بهدف تمكين الخلايا التائية من التعرف على بروتينات معينة على سطح الخلايا (الخلايا السرطانية مثلا) واستهدافها.[2] حيث تكتسب هذه المستقبلات في أغلب الأحيان خصوصية أحد الأجسام المضادة وحيدة النسيلة على خلية تائية. يطلق على هذه المستقبلات اسم "المستقبلات الخيمرية"، ذلك لأنها تتكون بالأساس من أجزاء منصهرة من مصادر مختلفة. بفضل هذه المستضادات يمكن لخلايا كارتي التعرف بسهولة على الخلايا السرطانية واستهدافها.
خلايا كارتي هي عبارة عن خلايا تائية تم استخلاصها من جسم المريض وتعديلها جينيا في المختبر لمهاجمة الخلايا السرطانية.[3] حيث إعادتهم عي وقت لاحق إلى جسم المريض لتعمل ك"دواء حي".[4] تخلق خلايا كارتي لجينا بين نطاق التعرف المتجند خارج الخلية وجزيء تأشير داخل الخلية يؤدي بدوره إلى تنشيط الخلايا التائية. حيث أنه وبمجرد تلامسها هذه مع المستضدات الموجودة على الأورام، يتم تنشيطها عبر الببتيد التأشيري، لتتكاثر وتصبح سامة للخلايا المستهدفة.[5] في حالات كهذه يعد التأكد من أن الخلايا السرطانية هي الوحيدة المستهدفة أمرا واجب لضمان سلامة العلاج باستخدام خلايا كارتي تجنبا لأي مضاعفات. حيث يتم تحديد خصوصية خلايا كارتي وفقا للجزيء المستهدف.[6]
تاريخ
أخصائيي علم المناعة الإسرائيليين جدعون جروس وزيليغ عشار [7][8] من معهد وايزمان للعلوم [9] كانا سباقين لتطوير أول جيل من مستقبلات المستضد الخيمرية في سنة 1989.
التطوير
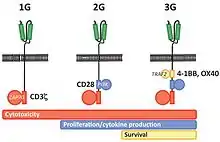
الجيل الأول
يتعرف مستقبل الخلية التائية (TCR) على المستضد المستهدف على أنه ببتيد قصير يتم استعراضه من طرف جزيئات معقدة التوافق النسيجي، في حين أن مستقبل الخلية البائية، كالأجسام المضادة تماما، يمكنه التعرف على المستضد الأصلي مباشرة. من الممكن إنتاج مستقبل هجين، يشتمل على الجزء خارج الخلوي لمستقبل الخلايا البائية ممزوجا وراثيا مع الجزء الخلوي لمستقبل الخلايا التائية. بشكل أكثر تحديدا، يتم دمج وحدة التعرف على الخلايا الليمفاوية البائية (بصفة عامة على شكل جزء متغير أحادي السلسلة (scFv)) مع مجال التنشيط للخلية الليمفاوية التائية، أي سلسلة "إس دي 3" (CD3). المستقبل المتحصل عليه هو كار من الجيل الأول، والذي بمجرد التعبير عنه في الخلية التائية، يتم توجيه هذه الأخيرة ضد الخلايا التي تعبر عن المستضد المستهدف بواسطة وحدة التعرف.
مع ذلك، فإن التعرف الوحيد على المستضد من قبل الخلايا اللمفاوية التائية لا يكفي لإنتاج التنشيط الكامل، بل قد يجعل الخلايا التائية تحسسية. على أرض الواقع، كانت التجارب السريرية الأولى للمستقبلات المستضادة الخيمرية من الجيل الأول مخيبة للآمال إلى حد ما.
الجيل الثاني
يعود الفضل لابتكار هذا الجيل الجديد إلى البروفيسور داريو كامبانا وزملاؤه، عندما قامو بإضافة وحدات محفزة مشتركة، مثل "إس دي 28" (CD28) و/أو "1-4 بي بي" (4-1BB) إلى الجيل الأول، فحصلو على الجيل الثاني للمستقبلات المستضادة الخيمري. استعمال مجالات التأشير هذه زاد من تعزيز انتشار الخلايا التائية وإفراز السيتوكين ومقاومة الاستماتة والاستمرار في الجسم الحي.[11] عندما تصادف الخلايا المناعية المعبرة عن الجيل الثاني لكار مستضد كار المستهدف على سطح خلية الورم، فإنها تستقبل في نفس الوقت إشارة المستضد وإشارة التحفيز. أثبتت هذه المستقبلات في وقت لاحق فعاليتها في علاج اللوكيميا اللمفاوية الحادة (ALL).
الجيل الثالث
احتوى الجيل الثالث من المستقبلات المستضادة الخيمرية بالإضافة إلى مجالات التحفيز المشترك على عدد من مجالات التأشير الأخرى، على غرار ال CD3z-CD28-41BB أو ال CD3z-CD28-OX40، بغرض زيادة نشاط الخلايا التائية. ارتباطا بذلك أظهرت البيانات ما قبل السريرية التي تم جمعها أن الجيل الثالث لهذه المستقبلات قام بتحسين وظائف المستجيب وزاد من مدة بقائها في الجسم الحي مقارنة بالجيل الثاني من نفس المستقبلات.[11]
الجيل الرابع
يجمع الجيل الرابع من كار الذي تم تطويره مؤخرا (المعروفة أيضا باسم "TRUCK") بين تعبير الجيل الثاني لكار والعوامل التي تعزز النشاط المضاد للورم (مثل السيتوكينات والحفزات المشتركة لللجينات).[12]
حدد موضع الترابط PI3K المستخدم في المستقبل المشترك CD28، [13] في حين تم تحديد مواضيع تنشيط المستقبلات المناعية القائمة على التيروزين (ITAM) كأهداف لمجموعتي CD4 و CD8-p56lck.[14]
العلاجات
يعد التطور الذي شهده مجال العلاج باستخدام مستقبلات كار هو اليوم واحد من الأمثلة الواضحة على التطبيقات المتعددة للبحوث الأساسية في الطب السريري. كنتيجة لذلك تم الحصول على أول نتائج سريرية إيجابية في مجال علاج سرطانات الدم أو سرطانات لمفوما الخلايا البائية من خلال استهداف مستضد CD19 الذي تعبر عنه جميع الخلايا البائية والخلايا الورمية. من بين العديد من المستضادات الأخرى التي تعبر عنها الخلايا السرطانية هناك بعض منها فقط تم اختبارها، وهي قيد التطوير. يسرد الجدولان أدناه بعضا من تلك المستضدات المستهدفة التي يجري حاليا اختبارها حاليا في الأبحاث المخبرية والسريرية والسرطانات المقابلة:[15]
| المستضد المستهدف | الورم المرتبط |
|---|---|
| CD19 | أمراض الدم المرتبطة بالخلايا البائية (ابيضاض الدم الليمفاوي المزمن مثلا) |
| BCMA | ورم نخاعي متعدد |
| CD123 | لوكيميا نخاعية حادة متلازمة خلل التنسج النخاعي |
| CD20 | أمراض الدم المرتبطة بالخلايا البائي |
| CD22 | أمراض الدم المرتبطة بالخلايا البائي |
| CD38 | الورم النخاعي متعدد |
| LeY | لوكيميا نخاعية حادة متلازمة خلل التنسج النخاعي |
| المستضد المستهدف | الورم المرتبط |
|---|---|
| c-MET | سرطان الخلايا الصبغية وسرطان الثدي |
| CD133 | الكبد والبنكرياس والدماغ |
| CD171 | الخلايا البدائية العصبية |
| CD70 | البنكرياس والكلى والثدي |
| CEA | الكبد والرئة والمستقيم القولوني والمعدة |
| EpCAM | الكبد، المعدة، الثدي، القولون والبنكرياس |
| EphA2 | الورم الأرومي الدبقي |
| FAP | ورم الظهارة المتوسطة |
| GD2 | الورم الأرومي العصبي، الورم الأرومي الدبقي، الساركوما، ساركوما العظام وسرطان الخلايا الصبغية |
| GPC3 | الكبد والرئة |
| HER2 | الثدي والمبيض والرئة |
| IL-13Ra2 | الورم الأرومي الدبقي |
| Mésothéline | عنق الرحم، المبيض، البنكرياس والرئة |
| MUC1 | الكبد، الرئة، البنكرياس، الثدي، المعدة والمستقيم |
| PSCA | البنكرياس |
| PSMA | البروستاتا والمثانة |
تمت الموافقة على أول علاج يعتمد على مستقبلات المستضد الخيمري (كار) من قِبل إدارة الغذاء والدواء الأمريكية بحلول أغسطس 2017 لعلاج اللوكيميا لدى الأطفال والشباب، [16] وفي وقت لاحق في أكتوبر من نفس السنة لعلاج بعض الأورام اللمفاوية اللاهودجكينية للخلايا البائية الكبيرة.[17] حيث أكدت هذه التقنية فعاليتها خلال مرحلة التجارب السريرية لعلاج سرطان الدم الليمفاوي الحاد، عندما نجحت في علاج قرابة ال79 في المائة من المرضى بعد 12 شهرا من العلاج. تبلغ تكلفة العلاج الذي يطلق عليه اسم كيمرايه" حوالي 475 ألف دولار أمريكي، يدفعها المريض فقط في حالة نجاح العلاج.[16]
انظر أيضا
مراجع
- "Al-Qamoos القاموس - English Arabic dictionary / قاموس إنجليزي عربي". www.alqamoos.org. مؤرشف من الأصل في 18 أغسطس 2018. اطلع عليه بتاريخ 18 أغسطس 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "CAR Récepteur antigénique chimérique | cellectis". اطلع عليه بتاريخ 08 أغسطس 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fox, Maggie (12 يوليو 2017). "New Gene Therapy for Cancer Offers Hope to Those With No Options Left". NBC News. مؤرشف من الأصل في 23 مايو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sadelain M, Brentjens R, Rivière I (أبريل 2013). "The basic principles of chimeric antigen receptor design". Cancer Discovery. 3 (4): 388–98. doi:10.1158/2159-8290.CD-12-0548. PMC 3667586. PMID 23550147. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hartmann J, Schüßler-Lenz M, Bondanza A, Buchholz CJ (سبتمبر 2017). "Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts". EMBO Molecular Medicine. 9 (9): 1183–1197. doi:10.15252/emmm.201607485. PMC 5582407. PMID 28765140. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Srivastava S, Riddell SR (أغسطس 2015). "Engineering CAR-T cells: Design concepts". Trends in Immunology. 36 (8): 494–502. doi:10.1016/j.it.2015.06.004. PMC 4746114. PMID 26169254. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gross G, Gorochov G, Waks T, Eshhar Z (February 1989). "Generation of effector T cells expressing chimeric T cell receptor with antibody type-specificity". Transplantation Proceedings. 21 (1 Pt 1): 127–30. PMID 2784887. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rosenbaum L (October 2017). "Tragedy, Perseverance, and Chance - The Story of CAR-T Therapy". The New England Journal of Medicine. 377 (14): 1313–1315. doi:10.1056/NEJMp1711886. PMID 28902570. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gross G, Waks T, Eshhar Z (December 1989). "Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity". Proceedings of the National Academy of Sciences of the United States of America. 86 (24): 10024–8. Bibcode:1989PNAS...8610024G. doi:10.1073/pnas.86.24.10024. JSTOR 34790. PMC 298636. PMID 2513569. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Casucci M, Bondanza A (2011). "Suicide gene therapy to increase the safety of chimeric antigen receptor-redirected T lymphocytes". Journal of Cancer. 2: 378–82. doi:10.7150/jca.2.378. PMC 3133962. PMID 21750689. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hartmann J, Schüßler-Lenz M, Bondanza A, Buchholz CJ (2017). "Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts". EMBO Molecular Medicine. 9 (9): 1183–1197. doi:10.15252/emmm.201607485. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chmielewski M, Abken H (2015). "TRUCKs: the fourth generation of CARs". Expert Opin Biol. 15 (8): 1145–1154. doi:10.1517/14712598.2015.1046430. الوسيط
|CitationClass=تم تجاهله (مساعدة); no-break space character في|vauthors=على وضع 23 (مساعدة) - Rudd CE, Schneider H (July 2003). "Unifying concepts in CD28, ICOS and CTLA4 co-receptor signalling". Nature Reviews. Immunology. 3 (7): 544–56. doi:10.1038/nri1131. PMID 12876557. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rudd CE (January 1999). "Adaptors and molecular scaffolds in immune cell signaling". Cell. 96 (1): 5–8. doi:10.1016/S0092-8674(00)80953-8. PMID 9989491. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sadelain M, Brentjens R, Rivière I (April 2009). "The promise and potential pitfalls of chimeric antigen receptors". Current Opinion in Immunology. 21 (2): 215–23. doi:10.1016/j.coi.2009.02.009. PMC 5548385. PMID 19327974. الوسيط
|CitationClass=تم تجاهله (مساعدة) - (بالإنجليزية) Emily Mullin, « A pioneering gene therapy for leukemia has arrived in the U.S. », في MIT Technology Review, août 2017 [النص الكامل (pages consultées le 2018-08-09)]
- "Press Announcements - FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma". اطلع عليه بتاريخ 09 أغسطس 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء
- بوابة طب
