قوى تشتت لندن
قوى لندن التشتتية(London Dispersion Forces) وتسمى قوى تشتت لندن (LDF، المعروف أيضا باسمقوى التشتت فاندرفالز(Van der waals) عبارة عن ارتباط الجزيئات غير القطبية مع بعضها البعض، [1] وهي جزء من قوة فان دير فالس . تم تسمية LDF من عقب الفيزيائي الألماني الأمريكي فريتز لندن.
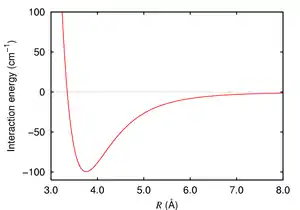
وLDF عبارة عن قوة بين جزيئات ضعيفة ناشئة عن الكم الناجم عن الاستقطاب اللحظي متعدد الأقطاب بين الجزيئات. وبالتالي يمكن أن تعمل بين الجزيئات بصورة مؤقتة متعددة الأقطاب اللحظية. ويتم عرض قوى لندن من قبل الجزيئات غير القطبية بسبب الحركات المترابطة الإلكترونات في التفاعل الجزيئات. لأن الإلكترونات في الجزيئات المجاورة "التنافر" لأنها تتنافر، الكثافة الالكترونية في جزيء يصبح توزيعها في القرب من جزيء آخر (انظر # نظرية الكم تشتت القوى الميكانيكية). وكثيرا ما وصف بأنه تكوين ثنائيات الاقطاب اللحظي التي تجذب كل منهما الآخر. قوى لندن موجودة بين كل المجموعات الكيميائية، وعادة ما تمثل الجزء الرئيسي من مجموع قوة التفاعل في المادة المكثفة، على الرغم من أنها عادة ما تكون أضعف من رابطة أيونية الرابطة الهيدروجينية مثل ترابط جزيء الميثان مع جزيء أخر، وترابط جسيمات اليود ( الهالوجينات ) مع بعضها البعض . والملاحظ في هذا النوع من الترابط أنّ قوّة الرابطة تتأثر بحجم الجزيئات والشكل الفراغي للجزيء، فنجد أنّ قوّة هذه الترابطات تزداد قوّةً كلما نزلنا إلى أسفل في مجموعة الهالوجينات F2, Cl2, Br2, I2). كما أنّ شكل الجزيء في الفراغ يلعب دوراً مهمّاً هو الأخر في قوّتها، فنجدها على سبيل المثال أقوى في البنتان العادي منها في النيوبنتان
نظرية الكم الميكانيكية للقوى التشتت
أعطيت التفسير الأول من التجاذب بين ذرات الغازات النبيلة لفريتز لندن في عام 1930.
| زوج الجزيء | % من مجموع الطاقة من التفاعل |
|---|---|
| نيون-Ne | 100 |
| ميثان-CH4 | 100 |
| كلوريد الهيدروجين-HCl | 86 |
| بروميد الهيدروجين-HBr | 96 |
| يوديد الهيدروجين-HI | 99 |
| كلورو الميثان-CH3Cl | 68 |
| أمونياك-NH3 | 57 |
| ماء-H2O | 24 |
| HCl-HI | 96 |
| H2O-CH4 | 87 |
المراجع
- "Chemguy Chemistry P5T8S9". YouTube. مؤرشف من الأصل في 10 مايو 2019. اطلع عليه بتاريخ 01 أبريل 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة كيمياء فيزيائية
