فلوريد الفوسفوريل
فلوريد الفوسفوريل (أو أوكسي فلوريد الفوسفور) هو مركب كيميائي من الفلور والأكسجين والفوسفور ينتمي إلى هاليدات الفوسفوريل، صيغته POF3، ويوجد على شكل غاز عديم اللون.
| فلوريد الفوسفوريل | |
|---|---|
 فلوريد الفوسفوريل |
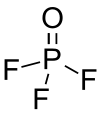 فلوريد الفوسفوريل |
| الاسم النظامي (IUPAC) | |
Phosphoryl trifluoride | |
| المعرفات | |
| CAS | 13478-20-1 |
| بوب كيم | 83516 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | POF3 |
| الكتلة المولية | 103.97 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 4.56 كغ/م3 |
| نقطة الغليان | −39.7 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضر المركب انطلاقاً من كلوريد الفوسفوريل بالتفاعل مع فلوريد الهيدروجين عند درجة حرارة مقدارها 65 °س باستخدام خماسي كلوريد الإثمد حفازاً للتفاعل.[2]
يمكن استخدام فلوريدات فلزية كعوامل فلورة، مثل فلوريد الزنك أو فلوريد الرصاص الثنائي أو فلوريد الفضة الأحادية.[3]
الخواص
يوجد المركب في الشروط القياسية على شكل غاز عديم اللون، وهو يتفاعل مع الماء عبر سلسلة من التفاعلات التي تعطي مشتقات فلورية لحمض الفوسفوريك، قبل الحصول على حمض الفوسفوريك في النهاية.
كما يتفاعل مع ثنائي ميثيل الأمين للحصول على مشتقات فلورية لمركبات فوسفور عضوية مثل CH3)2NPOF2).[4]
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/83516 — تاريخ الاطلاع: 14 أكتوبر 2016 — العنوان : Phosphoryl fluoride — الرخصة: محتوى حر
- Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 211.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 777.
- Cavell, R. G. (1968). "Chemistry of phosphorus fluorides. Part III. The reaction of thiophosphoryl-fluoride with dimethylamine and some properties of the dimethylaminothio- phosphoryl fluorides". Canadian Journal of Chemistry. 46 (4): 613. doi:10.1139/v68-100. مؤرشف من الأصل في 13 يناير 2020. اطلع عليه بتاريخ 02 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة)
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة الكيمياء
