فلوريد السيزيوم
فلوريد السيزيوم مركب كيميائي له الصيغة CsF، ويكون على شكل بلورات بيضاء.
| فلوريد السيزيوم | |
|---|---|
 فلوريد السيزيوم | |
 فلوريد السيزيوم | |
| الاسم النظامي (IUPAC) | |
فلوريد السيزيوم | |
| المعرفات | |
| رقم CAS | 13400-13-0 |
| بوب كيم | 25953 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | CsF |
| الكتلة المولية | 151.904 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 4.12 غ/سم3 |
| نقطة الانصهار | 682 °س |
| نقطة الغليان | 1251 °س |
| الذوبانية في الماء | 367 غ/100 مل ماء عند 18 °س |
| المخاطر | |
| ترميز المخاطر |  T T |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
نظراً لوجود فرق كبير في الكهرسلبية بين عنصري الفلور والسيزيوم، فإن مركب فلوريد السيزيوم يعد من أكثر المركبات الكيميائية التي تتميز بوجود صفة أيونية فيها.
- يكون لفلوريد السيزيوم انحلالية جيدة في الماء، وفي المحلات القطبية الأخرى، وذلك بشكل أكبر من فلوريد الصوديوم أو فلوريد البوتاسيوم. تتسيل بلوراته عند التماس مع الهواء الرطب، ويمكن نزع الماء منها بالتجفيف (لمدة ساعتين تحت الفراغ عند 100°س).[3]
- يتميز فلوريد السيزيوم بتفاعلاته التي تتضمن منح الفلوريد بشكل سهل، حيث تتشكل فلوريدات المركبات الموافقة، [4]
فهو على سبيل المثال يشكل فلوريد الكالسيوم عند تفاعله مع كلوريد الكالسيوم:
2 CsF (aq) + CaCl2 (aq) → 2 CsCl (aq) + CaF2 (s)
كما يتفاعل مع مركبات كلوريدات الأريل الفقيرة بالإلكترونات، ليشكل فلوريدات الأريل الموافقة.
- كما في الفلوريدات الأخرى فإن فلوريد السيزيوم له صفة قاعدية ضعيفة وذلك نظراً لضعف حمض هيدروفلوريك HF. وبما أن إلفة النواة لأيونات الفلوريد ضعيفة، لذلك يستخدم كقاعدة في الكيمياء العضوية.[4]
البنية
تكون لبلورات فلوريد السيزيوم بنية مكعبة تكون معاكسة لبنية الهاليت، لأن أيونات السيزيوم أكبر من أيونات الفلوريد، وذلك على عكس أغلب أملاح هاليدات الفلزات القلوية. تتكدس أيونات السيزيوم بشكل مكعبي متراص، وتتوضع أيونات الفلوريد في الفجوات ثمانية الوجوه.[4][5]
التحضير
يحضر فلوريد السيزيوم من أثر حمض هيدروفلوريك على هيدروكسيد أو كربونات السيزيوم تتبعها إجرلء عملية تجفيف للتخلص من الماء.
الاستخدامات
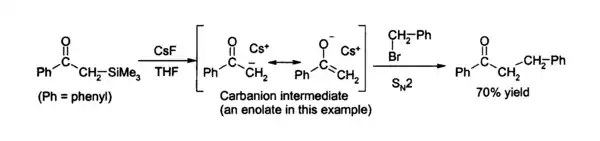
- يستخدم فلوريد السيزيوم في التفاعلات العضوية من أجل تفاعل إزالة السيليسيوم (أو السيليكون) desilylation من المركبات العضوية، وذلك نظرا لقوة الرابطة Si-F. فيمكن لفلوريد السيزيوم في رباعي هيدرو الفوران THF، أو ثنائي ميثيل فورماميد DMF أن يهاجم مركبات السيليكون العضوية مما يتيح في النهاية تشكيل مركبات كربانيون الموافقة، والتي يمكن أن تتفاعل لاحقاً مع كواشف محبة للإلكترون [5] فعلى سبيل المثال يمكن استخدام هذه الخاصة من أجل إزالة مجموعات حماية السيليل:[6]
- وجد أن فلوريد السيزيوم يعطي مردوداً أعلى في تكاثف كنوفيناغل من فلوريد الصوديوم أو فلوريد البوتاسيوم.[6]
- يعد فلوريد السيزيوم من أحد مصادر الفلور في تشكيل مركبات الفلور العضوية، فهو على سبيل المثال يتفاعل مع سداسي فلور الأسيتون ليشكل ملح بيرفلورو ألكوكسيد السيزيوم caesium perfluoroalkoxide، والذي يكون ثابتاً إلى درجة حرارة 60°س، على عكس من أملاح الصوديوم أو البوتاسيوم الموافقة.[7]
السلامة
إن فلوريد السيزيوم مركب سام مثله مثل أملاح الفلوريدات الأخرى. لذا يجب أخذ الحيطة والحذر عند التعامل به.
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/25953 — تاريخ الاطلاع: 14 أكتوبر 2016 — العنوان : CESIUM FLUORIDE — الرخصة: محتوى حر
- Cesium fluoride purum p.a., ≥98.0% | Sigma-Aldrich
- Friestad, G. K.; Branchaud, B. P. (1999). Reich, H. J.; Rigby, J. H. (المحرر). Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents. New York: Wiley. صفحات 99–103. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, Pergamon Press, Oxford, UK, 1984.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- Fiorenza, M; Mordini, A; Papaleo, S; Pastorelli, S; Ricci, A (1985). "Fluoride ion induced reactions of organosilanes: the preparation of mono and dicarbonyl compounds from β-ketosilanes". Tetrahedron Letters. 26: 787. doi:10.1016/S0040-4039(00)89137-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - F. W. Evans, M. H. Litt, A. M. Weidler-Kubanek, F. P. Avonda (1968). "Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction". Journal of Organic Chemistry. 33: 1837–1839. doi:10.1021/jo01269a028. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة الكيمياء