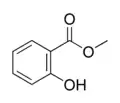
ساليسيلات الميثيل
ساليسيلات الميثيل (زيت الغلطيرية الكندية) هو منتج طبيعي للعديد من أنواع النباتات. ومن النباتات التي تنتجه نبات الغلطيرية الكندية والذي أعطى المركب اسمه.
| ساليسيلات الميثيل | |
|---|---|
 ساليسيلات الميثيل |
 ساليسيلات الميثيل |
| الاسم النظامي (IUPAC) | |
2-هيدروكسي بنزوات الميثيل | |
| المعرفات | |
| رقم CAS | 119-36-8? |
| بوب كيم | 4133 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C8H8O3 |
| الكتلة المولية | 152.1494 غ/مول |
| المظهر | سائل عديم اللون أو أصفر محمر، زيتي القوام، ذو رائحة مميزة.[3] |
| الكثافة | 1.174 غ/سم³ |
| نقطة الانصهار | -9 °س، 264 °ك، 16 °ف |
| نقطة الغليان | 220 - 224 °م |
| الذوبانية في الماء | في الماء عند 20 °م:0,07 غ/100 مل[3] |
| المخاطر | |
| NFPA 704 |
1
2
0
|
| نقطة الوميض | 101 °م |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الإنتاج التجاري
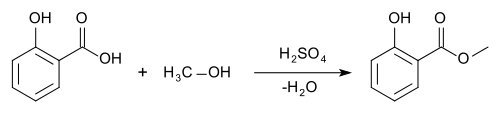
يمكن إنتاج ساليسيلات الميثيل من أسترة حمض الساليسيليك مع الميثانول. يصنع ساليسيلات الميثيل التجاري حاليا، في حين أنه كان يقطر قبلا من غصينات التامور الأسود (Betula lenta) و الغلطيرية (Gaultheria procumbens).
الاستخدامات

يستخدم كمحمر (Rubefacient) في المروخ (Liniment) عالي التسخين، وبكميات صغيرة كمادة منكهة لا تتجاوز 0.04%.[4] ويستخدم ليعطي شذى خاصا لمركبات متنوعة وكعامل حابس للرائحة في بعض مبيدات الآفات الفسفورية العضوية (مبيد آفات). وإذا استخدم بكميات كبيرة فقد يسبب مشاكل معدية وكلوية.
وهو من المركبات العديدة التي تجذب ذكور أنواع متنوعة من (orchid bees) التي تجمع المادة الكيميائية لتصنع الفيرومونات، ولذلك تستخدم هذه المادة كطعم لجذب هذه الحشرات من أجل دراستها.[5]
وتستخدم ساليسيلات الميثيل في إظهار لون النسيج الحيوي في الحيوانات والنباتات، فهي مفيدة في الدراسات المجهرية والكيمياء الهيستولوجية المناعية عندما تحجب الخضب الزائدة البنية أو تحجب الضوء من المرور في النسيج المدروس. يأخذ التظهير بضعة دقائق ولكن يجب أولا تجفيف النسيج باستخدام الكحول.
مع أن المصدر النباتي لساليسيلات الميثيل ليس نعناعا حقيقيا، إلا أنه يستخدم أيضا كنعناع في بعض أنواع العلك والحلويات كبديل عن زيوت النعنع الفلفي (Peppermint) والنعنع الأخضر (Mentha spicata). ويمكن أن يوجد كمنكه في بيرة الجذور (Root beer). كما يستخدم كبديل في مواد التسلية التي تستخدم مبدأ الضيائية الاحتكاكية عندما يمزج مع السكر ويجف حيث يمكنه أن يكون شحنة إلكترونية عندما يؤرض.[6][7]
الاستخدامات الطبية وملاحظات السلامة
ساليسيلات الميثيل سامة عندما تكون نقية وخصوصا إذا دخلت إلى باطن الجسم. ملعقة شاي صغيرة من ساليسيلات الميثيل تحتوي على 7 غ من الساليسيلات[8]، وهي التي تكافئ أكثر من 23 حبة أسبرين ذات 300 ملغ. أقل جرعة مميتة منشورة هي 101 ملغ/كغ من وزن جسم الإنسان البالغ.[9] وقد ثبت أنه مميت للأطفال بجرعات أقل من 4 مل.[4] ولقد توفيت عداءة (17 سنة) في سباق أكاديمية نوتردام في جزيرة ستاتن الأمريكية في 3 أبريل 2007 بعد أن استخدمت كميات كبيرة من ساليسيلات الميثيل الموجود في منتجات تخفيف ألم العضلات.[10]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/4133 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : methyl salicylate — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/4133
- بطاقة السلامة الكيميائية العالمية 119-36-8
- Wintergreen at Drugs.com نسخة محفوظة 19 مارس 2018 على موقع واي باك مشين.
- Schiestl, F.P.; Roubik, D.W. (2004). "Odor Compound Detection in Male Euglossine Bees". Journal of Chemical Ecology. 29: 253–257. doi:10.1023/A:1021932131526. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - E.N. Harvey, "The luminescence of sugar wafers," Science magazine, 14 July 1939: Vol. 90. no. 2324, pp. 35–36.
-
"Why do Wint-O-Green Life Savers spark in the dark?". HowStuffWorks. مؤرشف من الأصل في 17 أغسطس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Salicylate Poisoning - Patient UK نسخة محفوظة 12 فبراير 2012 على موقع واي باك مشين.
- Safety data for methyl salicylate, Physical & Theoretical Chemistry Laboratory, Oxford University نسخة محفوظة 13 أكتوبر 2007 على موقع واي باك مشين. [وصلة مكسورة]
- "Muscle-Pain Reliever Is Blamed For Staten Island Runner's Death". نيويورك تايمز. 2007-06-10. مؤرشف من الأصل في 18 يناير 2018. اطلع عليه بتاريخ 09 يونيو 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم النبات
- بوابة الكيمياء
- بوابة الكيمياء الحيوية