رابطة ثلاثية المركز ثنائية الإلكترون
الرابطة ثلاثية المركز ثنائية الإلكترون (يرمز لها 3c-2e) هي رابطة كيميائية ذات نقص إلكتروني، حيث تشترك ثلاث ذرات بزوج إلكتروني. يؤدي وجود ثلاث مدارات ذرّيّة إلى نشوء ثلاث مدارات جزيئية، أحدها رابط، والثاني غير رابط، في حين أن الثالث مضاد للترابط. يتموضع الإلكترونان في المدار الجزيئي الرابط، مما يؤدي إلى حدوث الرابطة الكيميائية بين الذرات الثلاث، وغالباً ما ينزاح المدار الرابط تجاه اثنتين من الذرات الثلاث، بدل من أن تنتشر بشكل متساوي على الذرات الثلاث.
إن أبسط الأمثلة على الرابطة ثلاثية المركز ثنائية الإلكترون هي في كاتيون ثلاثي الهيدروجين +H3 [1] من الأمثلة الأخرى على تلك الرابطة معقّدات ثنائي الهيدروجين مع الفلزات الانتقالية.
مركبات البورون
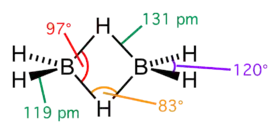
تلاحظ الروابط ثلاثية المركز ثنائية الإلكترون في العديد من مركبات البورون مثل ثنائي البوران B2H6. إن المركب البادئ في البورانات هو BH3، وهو مركب غير مستقر، إذ أن ذرة البورون تكون محاطة بست إلكترونات تكافؤ، وبالتالي، لتشكيل ترتيب إلكتروني مستقر قريب من قاعدة الثمانيات، يحدث اشتراك مع رابطة B-H لذرة بورون أخرى، مما يؤدي إلى تشكيل رابطة B-H-B، وهي رابطة ثلاثية المركز ثنائية الإلكترون. في ثنائي البوران هناك رابطتين من هذا النوع، حيث تقوم ذرتا هيدروجين بتشكيل روابط جسرية بين ذرتي البورون، في حين أن ذرتي الهيدروجين المتبقيتين تشكلان روابط B-H نمطية مع كل ذرة بورون.
ينتشر الإلكترونان في المدار الجزيئي الرابط في رابطة B-H-B عبر الفضاءات بين النووية للذرات الثلاث.[2] إن رتبة الرابطة تبلغ 0.5 لكل ارتباط من النوع B-H،[3] بحيث أن الروابط B−H الجسرية أضعف وأطول من الروابط B−H الطرفية.
المراجع
- IUPAC Gold Book نسخة محفوظة 25 ديسمبر 2019 على موقع واي باك مشين. [وصلة مكسورة]
- I. Mayer (1989). "Bond orders in three-centre bonds: an analytical investigation into the electronic structure of diborane and the three-centre four-electron bonds of hypervalent sulphur". Journal of Molecular Structure. 186: 43–52. doi:10.1016/0166-1280(89)87037-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - F. Albert Cotton, Geoffrey Wilkinson and Paul L. Gaus, Basic Inorganic Chemistry, 2nd ed. (Wiley 1987), p.113
- بوابة الكيمياء