داء كلابية الذنب
داء كلابية الذنب أو " العمى النهري"،، مرض طفيلي تتسبب به الدودة الطفيلية الخيطية المسماة كلابية الذنب المتلوية، [1] ومن أعراضه الحكة الشديدة وكُتَل تحت الجلد والعمى؛[1] حيث أنه يعدّ ثاني أكبر مسبب للعمى بعد التراخوما.[2]
| داء كلابية الذنب | |
|---|---|
| معلومات عامة | |
| الاختصاص | أمراض معدية ، وطب المناطق الحارة |
| من أنواع | داء الخيطيات ، وداء ديداني ، والأمراض المدارية المهملة |
| الأسباب | |
| الأسباب | كلابية الذنب المتلوية |
| طريقة انتقال العامل المسبب للمرض | انتقال عبر الحشرات |
| المظهر السريري | |
| الأعراض | عمى ، وطفح ، وعقيدة ، وإزالة الانصباغ ، وتحزز |
| الإدارة | |
| أدوية | |

تنتقل الدودة الطفيلية بواسطة اللدغات المتكررة من الذبابة السوداء من نوع الذلفاء؛[1] عادة يتطلب لدغات متكررة لحدوث العدوى، [3] حيث تعيش وتتكاثر مثل هذه الذبابات في الأنهار والمجاري المائية السريعة الجريان ؛ ومن هنا اشتق اسم هذا المرض.[2]
وفي جسم الإنسان تنتج الديدان البالغة يرقات جنينية تنتقل إلى الجلد والعينين وأعضاء أخرى,[1] وعندما تلدغ أنثى الذبابة السوداء شخصاً مصاباً بالعدوى لتتغذى على دمه، فإنها تبتلع أيضا الديدان الخيطية المجهرية التي تواصل النمو داخل الذبابة السوداء ثم تنقل العدوى لشخص آخر تلدغه.[1]
هنالك عدة طرق لتشخيص المرض، كأخذ نسيج من الجلد ووضعه في محلول ملحيّ ومشاهدة اليرقات تخرج، أو بالبحث عن الديدان البالغة في الكتل تحت الجلد.[4]
لا وجود للقاح فعّال أمام هذا المرض، [1] والطريقة الوحيدة لتجنبه هو من خلال الوقاية منه، كتجنب الحشرات[5] واستخدام المبيدات لها وارتداء ما يكفي من الملابس .[5] وتوجد جهود عالمية مبذولة للقضاء على المرض من خلال معالجة مجموعات من الناس مرتين سنوياً ويجري في عدد من مناطق العالم[1]، ويكون من خلال تعريض المصابين لعلاج الإيفرميكتين كل ستة إلى اثنتي عشرة شهراً ؛[1][6] لكن هذا العلاج أبدى فعاليته أمام اليرقات ولم يبدها أمام الديدان البالغة,[7] لذلك يتم استخدام علاج الدوكسيسيكلين ؛ والذي يستخدم في القضاء على البكتيريا المصاحبة تسمى الولبخيات ؛ للتخلص من الديدان البالغة، [7] كما يتم أيضاً القيام ببعض العمليات الجراحية للتخلص من التشوهات في طبقات الجلد لوجود الكتل تحتها.[6]
يوجد حوالي 17 إلى 25 مليون شخص يعاني من العمى النهري، مع ما يقرب من 0.8 مليون شخص لديهم نسبة من العمى.[3][7] وتحدث معظم الإصابات في أفريقيا جنوب الصحراء الكبرى، كما تم الإبلاغ عنه في اليمن والمناطق المعزولة من أمريكا الوسطى والجنوبية .[1] في عام 1915، كان الطبيب رودولفو روبليس أول من ربط الدودة بأمراض العيون، [8] وهي مدرجة من قبل منظمة الصحة العالمية على أنها واحدة من أمراض المناطق المدارية المهملة.[9]
الأعراض والعلامات
تبقى الديدان البالغة في العقيدات تحت الجلد مما يجعلها في منأى عن جهاز المناعة للجسد المضيف، ولكن في المقابل المكروفيلارية تستطيع تهييج جهاز المناعة حتى بعد موتها ؛ حيث وجد أن الفصيلة اللوبخية هي معايش جواني (تعيش بداخل جسم) لكلابية الذنب، ويتم الاعتقاد بأنها المسبب وراء حالات الوفاة من كلابية الذنب ؛ حيث وجد مؤخرا أنها تفرز بروتينا من اللوبخيا على سطحها حيث يتحفز جهاز المناعة الطبيعي وينتج الإلتهاب والأمراض المرتبطة معه، وترتبط به شدة الإصابة من حيث عدد المكروفيلارية المنتقلة وشدة الاستجابة المناعية.[10]
يكون تأثّر الجلد عادة بوجود حكة شديدة، وتورّم، والتهاب [11] وقد تم تطوير نظام الدرجات في تصنيف درجة تأثّر الجلد.[12][13]
- التهابات حادة واحمرار في الجلد بكلابية الذنب تنتج بثور متفرقة تسبب الحكة.
- التهابات مزمنة في الجلد بكلابية الذنب ... تنتج بثور أكبر وأشد، مما يؤدي إلى فرط التصبّغ.
- التهاب الجلد بكلابية الذنب الذي ينتج عنه ازدياد في سمك الجلد، بثور شديدة التصبّغ بالإضافة لوذمات بالعقد الليمفاويّة والتهابات بكتيرية ناتجة عن الحكة الشديدة.
- ضمور الجلد وفقدان مرونته، يصبح مثل المناديل الورقية، كمظهر جلد السحلية.
- زوال اللون وظهور شكل "جلد النمر"، عادة ما تكون على أسفل الساق الأمامية.
- ظهور تأثير الماء الأزرق – خلل بوظائف العيون، نبدأ في رؤية الظلال أو لا شيء.
يوفر ارتباط العين بالمرض الاسم الشائع لداء كلابية الذنب وهو "العمى النهري"، ويمكن أن ينطوي على أي جزء من العين من الملتحمة والقرنية للعنبيَّة والجزء الخلفي، بما في ذلك الشبكية والعصب البصري ,[11] ثم إن الميكروفلاريا تهاجر إلى سطح القرنية ويحدث في المنطقة المصابة التهاب القرنية النقطيّ, أما إذا كانت العدوى مزمنة فمن المتوقع أن يحدث الْتِهابُ القَرْنِيَّةِ المُصَلِّب مما يجعل المنطقة المصابة معتمة لا تمرر الضوء. مع مرور الوقت، قد تصبح القرنية بأكملها معتمة، مما يؤدي بالنهاية إلى العمى. بعض النظريات تقترح أن التأثير على القرنية ينتج بسبب الاستجابة المناعية للبكتيريا المتواجدة في الديدان . الجلد يثير الحكة، مع طفح جلدي شديد يسبب تلف دائم لبقعات من الجلد.
تفاعل مازوتي (mazzotti reaction)
تم وصفه لأول مرة عام 1948 ،عبارة عن مجموعة أعراض تظهر في المرضى بعد خضوعهم لعلاج داء كلابية الذنب مع دواء ثنائي إيثيل كاربامازين (DEC). يمكن أن يكون هذا التفاعل مهدداً لحياة المريض، وتتميز بالحمى والشرى وتضخم الغدد الليمفاوية وعدم انتظام دقات القلب وانخفاض ضغط الدم وآلام بالمفاصل ووذمات وآلام في البطن تحدث خلال سبعة أيام من العلاج من المكروفيلاريات.
هذا التفاعل شائع جداً حيث أن ذلك العلاج يستخدم كأساس لاختبار صحة التشخيص، فإذا كان الشخص مصاباً بتلك الدودة ستظهر الحكة الموضعية والشرى بموقع البقع.[14]
متلازمة الإيماء بالرأس (nodding disease)
مرض يرتبط ارتباطاً وثيقاً بكلابية الذنب، وتبدو أعراضها كالصرع تقتل الأطفال جسدياً وعقلياً وتؤدي لإصابتهم بحالة من الذهول,[15] وقد وثّقت لأول مرة في تنزانيا على يد الطبيب لويس جويك آال خلال فترة تطبيقه فيها، وخلال فترة الستينيات من القرن المنصرم كانت أكثر انتشاراً في أوغندا وجنوب السودان.
وغالباً ما يكون الأطفال بعمر 5-15 عام بحالة جيدة دون ظهور أعراض، لكن يتم تفعيله عن طريق بعض أنواع الأطعمة وانخفاض درجات الحرارة ؛ ويصاحبه اختلالات عقلية وتشنجات ونوبات ربما يصعب السيطرة عليها. سيظهر تخطيط أمواج الدماغ نتائج طبيعية على خلاف السائل الدماغي الشوكي وصورة الرنين المغناطيسي اللتان لن تظهرا أي تغير ملحوظ. لكن في حال تواجد أمر غير طبيعي في صورة الرنين المغناطيسي فسيكون في منطقة قرن آمون. تفاعل البوليميراز المتسلسل لن يظهر وجود الطفيلي (كلابية الذنب) .
التصنيف
يقسم داء كلابية الذنب إلى مراحل وأنواع عدة :[16] حُمْرَةُ السّواحل وهي المرحلة الحادة ويتميز بتورم الوجه وحكة مع حُمْرة[16]، كلابية الذنب تتسبب بتغيرات جلدية تختلف باختلاف المنطقة الجغرافية، وتعد حُمْرَةُ السّواحل الأكثر شيوعاً بين الضحايا في أمريكا الوسطى والجنوبية.[17]
مال موراندو(mal morando)-- وتتميز هذه المرحلة بالتهاب يرافقه فرط تصبغ[16] سَوْدَة (مظاهر جلدية لداء كلابية الذنب)— وهي حالة جلدية موضعية من كلابية الذنب [16]
- يوجد 3 أشكال للتغيرات الجلدية المصاحبة للمرض :[16]
جلد النمر : جلد مرَقَط (بسبب فقد صبغة الجلد) باختلاف لون بعض أماكنه.[16] جلد الفيل : زيادة سمك جلد الانسان.[16] جلد السحليّة : جلد سميك ومجعّد.[16] المسبب: كلابيّة الذنب المتلوّية
دورة الحياة
يمكن تتبع حياة الطُفيل عن طريق الذبابة السوداء والمضيفان البشريان في الخطوات التالية : تأخذ أنثى الذبابة السوداء الذلفاء وجبة دماء بعد لدغها للشخص المصاب وتبتلع معها المكروفيلاريات. ثم تدخل المكروفيلاريات إلى القناة الهضمية وعضلات الطيران الصدرية للذبابة السوداء، فتنضج إلى مرحلة اليرقات الأولى ((J1. تنضج إلى مرحلة اليرقات الثانية (J2)، ثم تنتقل إلى الخرطوم واللعاب في دورته الثالثة (J3). يستغرق النضج حوالي سبعة أيام. ثم تأخذ الذبابة السوداء وجبة دماء أخرى، وتَمُر اليرقات إلى دم الإنسان المضيف الجديد. تهاجر اليرقات إلى أنسجة تحت الجلد، وتشكل عقيدات بنضوجها إلى ديدان بالغة بفترة من ستة أشهر إلى 12 شهراً . بعد النضج والبلوغ، تتزاوج الديدان الذكور مع الديدان الإناث في النسيج تحت الجلد لإنتاج ما بين 700 و1500 مكروفيلارية يوميا . تهاجر المكروفيلارية إلى البشرة خلال النهار وكذلك الذباب الأسود لا يتغذى إلا بالنهار، لذلك فان الطفيل في حالة تسمح بابتلاعه وأخذه في حالة لدغ أنثى الذبابة السوداء للشخص المصاب ؛ وتبدأ الدورة من جديد .
الوقاية
وتهدف برامج التحكم المختلفة لوقف داء كلابية الذنب من كونه مشكلة صحية عامة، وكان اوّلها برنامج مكافحة داء كلابية الذنب (OCP) والذي تم إطلاقه عام 1974 حيث وصل ذروته بتغطية 30 مليون شخص ب 11 بلدا ؛ باستخدام مبيدات اليرقات ونشرها في الأنهار للسيطرة على الذبابة السوداء، ومن العام 1988 فصاعداً تم استخدام علاج الايفرمكتين لعلاج المصابين، وهذا البرنامج هو جهد مشترك لمنظمة الصحة العالمية والبنك الدولي وبرنامج الأمم المتحدة الإنمائي، ومنظمة الأغذية والزراعة للأمم المتحدة، ووصل إلى نهايته عام 2002 والرصد المستمر أكد عدم عودة الداء إلى مناطق البرنامج OCP.[18]
في عام 1992، تم إطلاق برنامج القضاء على داء كلابية الذنب للأمريكتين، والتي يعتمد أيضاً على الإيفرميكتين.[19]
في عام 1995، بدأ البرنامج الأفريقي لمكافحة داء كلابية الذنب الذي يغطي 19 بلدا آخراً، ويعتمد أساساً على استخدام الايفرمكتين، هدفه تعريض المجتمع للإيفرميكتين مع أولئك المصابين. وبهذه الطريقة انخفض انتقال المرض.[20]
في 29 يوليو 2013، أعلنت منظمة الصحة للبلدان الأمريكية (PAHO) أنه بعد 16 سنة من الجهود، كولومبيا قد أصبحت أول دولة في العالم نقضي على المرض طفيلي" كلابية الذنب".[21]
لا يوجد لقاح متاح للوقاية من عدوى داء كلابية الذنب في البشر، وهناك لقاح لمنع عدوى داء كلابية الذنب للماشية في الطور الثالث من التجارب، تحقن الماشية بشكل معدّل ومضَعَّف من اليرقات O. ochengi قد أوجدت بمستويات عالية جداً من الحماية ضد العدوى، وتشير النتائج إلى أنه من الممكن تطوير لقاح يحمي الناس من العمى النهاري باستخدام نهج مماثل. ولكن للأسف طوال الفترة الماضية لم يكن يوجد لقاح يحمي البشر من هذا الداء.
العلاج
.jpg.webp)
في برامج إدارة الأدوية الجماعية (MDA)، علاج داء كلابية الذنب هو الإيفرميكتين (الاسم التجاري: مكتيزان) ؛ يمكن علاج المصابين مع جرعتين من الإيفرميكتين، كل ستة أشهر منفصلة، تتكرر كل ثلاث سنوات. الدواء يشلّ ويقتل الميكروفلاريا التي تسبب الحمى والحكة، وربما وذمة، والتهاب المفاصل واعتلال العقد اللمفية. ويتخلّص من الحكّة الجلدية الكثيفة في نهاية العلاج، وتوقف تقدّم المرض نحو العمى. بالإضافة إلى ذلك، في حين أن الدواء لا يقتل الديدان البالغة، فإنّها تمنعهم من إنتاج ذرية إضافية لفترة محدودة فقط، لذلك العلاج يحد كلّ من موت المريض وانتقال المرض وانتشاره لمدة تصل إلى عدة أشهر. علاج الإيفرميكتين يعد فعالاً بشكل خاص لأنه يحتاج إلى أن يؤخذ مرة واحدة أو مرتين فقط في السنة ولا يحتاج إلى التبريد وله مدى واسع من السلامة، ونتيجة لذلك فقد أعطي على نطاق واسع من قبل العاملين في صحة المجتمع المدربين ولو بشكل قليل.[22]
المضادات الحيوية
يتم استخدام الدوكسيسيكلين لقتل البكتيريا الولبخية التي تعيش في الديدان البالغة، وقد تبيّن أنّ هذا العلاج قد خفّض كثيراً من أعداد الميكروفيلاريا في حامل المرض، ويمكن أن يكون فعّالا ضد الديدان البالغة وذلك بسبب العلاقة التكافلية بين الولبخية والدودة[23][24] ففي أربع مراجعات منفصلة (تجارب على الدواء) على مدى 10 أعوام مع مختلف نظم الجرعات من الدوكسيسيكلين لعلاج حالات فردية، فقد أثبت فعّاليته في تعقيم وقتل الديدان الإناث وخفض أعدادها على مدى فترة من 4-6 أسابيع وفي أبحاث عن مضادات حيوية أخرى مثل ريفامبيسين فقد أظهرت أنها كانت فعّآلة في النماذج الحيوانية في الحد من الولبخية على حد سواء كبديل وكعامل مساعد للدوكسيسيكلين .[25] ومع ذلك علاج الدوكسيسيكلين يتطلب جرعات يومية على الأقل لفترة 4-6 أسابيع مما يجعل الأمر أكثر صعوبة لإدارة المناطق المتضررة.[22]
إيفرميكتين
إيفرمكتين يقتل الطفيليات عن طريق التدخّل بوظائف الجهاز العصبي والعضلات وعلى وجه الخصوص من خلال تعزيز التثبيط العصبي فيرتبط الدواء وينشّط قنوات الكلورايد المتحكّم بها عن طريق الغلُوتامات,[22] هذه القنوات موجودة في الخلايا العصبية والخلايا العضليّة وهي ليست محددة لللافقاريات ولكنها محمية في الفقاريات من عمل الإيفرميكتين من قبل حاجز الدم في الدماغ.[22]
ويعتقد أن الإيفرميكتين ينشّط هذه المستقبلات تنشيطاً دائما، فيتسبب في تثبيط جهد الفعل بمنطقة ما بعد التشابكي، ففرصة عمل جهد فعل بين الخلايا العصبية في المستقبل تتضاءل فتعاني الديدان الخيطية من الشلل التام ثم يتبعه الموت.[26][27][28]
الإيفرميكتين فعّال مباشرة ضد اليرقات من كلابية الذنب المتلوية فهي مشلولة ويمكن أن يتم قتلها عن طريق الخلايا الحامضيّة والخلايا البَلْعَميّة, إلا أنه لا يقتل الديدان البالغة (الإناث) لكنه يقوم بايقاف إنتاج الميكروفيلاريات، غالباً عن طريق أحداث شلل في الجهاز التناسلي .[22]
علم الأوبئة
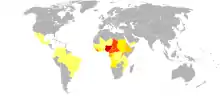
يصاب حوالي 37 مليون نسمة بهذا الطفيلي .[29] حوالي 300.000 من هؤلاء قد أصيبوا بالعمى بشكل دائم.[30] كما في عام 2008 فقد وقعت حوالي 99٪ من حالات العمى النهري في أفريقيا.[31] يتوطّن داء كلابية الذنب حاليا في 30 بلدا أفريقيا واليمن ومناطق معزولة في أمريكا الجنوبية.[32] ويعيش أكثر من 85 مليون شخص في المناطق الموبوءة، ونصف هؤلاء يقيمون في نيجيريا.
120 مليون شخص معرضون أيضاً لخطر الإصابة بهذا المرض، وذلك بسبب توطّن نواقل المرض حولهم، وهذا المرض هو أكثر شدة على طول الأنهار الرئيسية في المناطق الشمالية والوسطى من القارة، وتنخفض شدته في القرى بعيداً عن الأنهار. تم القضاء على داء كلابية الذنب في الجزء الشمالي في ولاية تشياباس، المكسيك، [33] ومنطقة أواكساكا، المكسيك، حيث كانت موجودة، فقد تم تحديد كلابية الذنب المتلوية، وبعد عدة سنوات من العلاج بالأيفرمكتين تم إنهاؤه.[34] وفقاً لتقرير منظمة الصحة العالمية عام 2002, أن داء كلابية الذنب لا يسبب الموت دفعة واحدة، ولكن عبئه العالمي تجاوز 987.000 حالة عجز (سنوات العمر)" هو مقياس لعبء المرض الإجمالي كنسبة من عدد السنوات المفقودة بسبب اعتلال الصحة أو الإعاقة أو الموت المبكر" فالحكة الشديدة وحدها مسؤولة عن 60٪ من حالات العجز بسنوات العمر وبذلك العدوى تقلل من مناعة المضيف ومقاومته للأمراض الأخرى، مما يؤدي إلى انخفاض المقدرة في متوسط العمر المتوقع 13 عاما.[32] وفقا لمنظمة الصحة الأمريكية، في يوليو-تموز 2013، أصبحت كولومبيا أول بلد يقضي نهائيا على هذا المرض من داخل حدودها.
تاريخ
باستخدام دراسة حالة لعمال زراعة البن في غواتيمالا، افترض روبلز أن الناقل للمرض هو الحشرات القارضة بالنهار، وبشكل أكثر تحديدا فقد وجد ان اثنين من أنواع ذباب الذلفاء مستوطنة في المناطق التي زارها. وقال انه نشر استنتاجاته على أساس "مرض جديد" من غواتيمالا المرتبط بالعقيدات تحت الجلد وإصابات الرؤيا (العين) الأمامية والتهاب الجلد والميكروفلاريا في عام 1917.
المجتمع وثقافته
منذ عام 1988 ، قدمت شركة ميرك الإيفرميكتين مجاناً لاستخدامه في البشر من خلال برنامج التبرع مكتيزان (MDP). وMDP تعمل جنباً إلى جنب مع وزارات الصحة والمنظمات غير الحكومية الإنمائية، مثل منظمة الصحة العالمية، لتوفير الإيفرميكتين مجاناً لأولئك الذين في حاجة إليه في المناطق الموبوءة.[35]
الأبحاث
النماذج الحيوانية للمرض محدودة إلى حد ما، حيث أن الطفيلي يعيش فقط في الرّئِيسات. ولكن هناك أوجه شبه وثيقة, ochengi كلابية الذنب أقرب قريب من كلابية الذنب المتلوية وتعيش في تجاويف داخل الأدمة في الماشية وينتشر أيضاً عن طريق الذباب الأسود. هذا النظام مفيد ولكن ليس كدقة النماذج الحيوانية.[36]
وأظهرت دراسة شملت 2501 شخص في غانا تضاعف معدل الانتشار بين عامي 2000 و2005 على الرغم من العلاج، مما يشير إلى طفيل ينمو مقاوماً للدواء.[25][37][38] تجربة سريرية أخرى لمواد مضادة للطفيليات، موكسيدكتين (المصنعة من قبل وايث)، بدأت في 1 يوليو 2009.[39]
المراجع
- "Onchocerciasis Fact sheet N°374". World Health Oragnization. March 2014. مؤرشف من الأصل في 22 أبريل 2018. اطلع عليه بتاريخ 20 مارس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Onchocerciasis (also known as River Blindness)". Parasites. CDC. May 21, 2013. مؤرشف من الأصل في 19 أبريل 2019. اطلع عليه بتاريخ 20 مارس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Parasites – Onchocerciasis (also known as River Blindness) Epidemiology & Risk Factors". CDC. May 21, 2013. مؤرشف من الأصل في 19 أبريل 2019. اطلع عليه بتاريخ 20 مارس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Onchocerciasis (also known as River Blindness) Diagnosis". Parasites. CDC. May 21, 2013. مؤرشف من الأصل في 19 أبريل 2019. اطلع عليه بتاريخ 20 مارس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Onchocerciasis (also known as River Blindness) Prevention & Control". Parasites. CDC. May 21, 2013. مؤرشف من الأصل في 19 أبريل 2019. اطلع عليه بتاريخ 20 مارس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Murray, Patrick (2013). Medical microbiology (الطبعة 7th). Philadelphia: Elsevier Saunders. صفحة 792. ISBN 9780323086929. مؤرشف من الأصل في 6 أغسطس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brunette, Gary W. (2011). CDC Health Information for International Travel 2012 : The Yellow Book. Oxford University Press. صفحة 258. ISBN 9780199830367. مؤرشف من الأصل في 13 أبريل 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lok, James B.; Walker, Edward D.; Scoles, Glen A. (2004). "9. Filariasis". In Eldridge, Bruce F.; Edman, John D.; Edman, J. (المحررون). Medical entomology (الطبعة Revised). Dordrecht: Kluwer Academic. صفحة 301. ISBN 9781402017940. مؤرشف من الأصل في 6 أغسطس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Reddy M, Gill SS, Kalkar SR, Wu W, Anderson PJ, Rochon PA (October 2007). "Oral drug therapy for multiple neglected tropical diseases: a systematic review". JAMA. 298 (16): 1911–24. doi:10.1001/jama.298.16.1911. PMID 17954542. مؤرشف من الأصل في 21 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Baldo L, Desjardins CA, Russell JA, Stahlhut JK, Werren JH (2010-02-17). "Accelerated microevolution in an outer membrane protein (OMP) of the intracellular bacteria Wolbachia". BMC Evol Biol. 10: 10:48. doi:10.1186/1471-2148-10-48. PMC 2843615. PMID 20163713. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wani, MG (February 2008). "Onchocerciasis". Southern Sudan Medical Journal. مؤرشف من الأصل في 15 يناير 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) نسخة محفوظة 15 يناير 2011 على موقع واي باك مشين. - Ali MM, Baraka OZ, AbdelRahman SI, Sulaiman SM, Williams JF, Homeida MM, Mackenzie CD (15 February 2003). "Immune responses directed against microfilariae correlate with severity of clinical onchodermatitis and treatment history". Journal of Infectious Diseases. 187 (4): 714–7. doi:10.1086/367709. JSTOR 30085595. PMID 12599094. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Murdoch ME, Hay RJ, Mackenzie CD, Williams JF, Ghalib HW, Cousens S, Abiose A, Jones BR (September 1993). "A clinical classification and grading system of the cutaneous changes in onchocerciasis". Br J Dermatol. 129 (3): 260–9. doi:10.1111/j.1365-2133.1993.tb11844.x. PMID 8286222. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - microblog.me.uk نسخة محفوظة 06 نوفمبر 2018 على موقع واي باك مشين.
- Dowell SF, Sejvar JJ, Riek L, Vandemaele KA, Lamunu M, Kuesel AC, Schmutzhard E, Matuja W, Bunga S, Foltz J, Nutman TB, Winkler AS, Mbonye AK (2013). "Nodding syndrome". الأمراض المعدية الناشئة. 19 (9): 1374–3. doi:10.3201/eid1909.130401. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - James, William D.; Berger, Timothy G.; Elston, Dirk M; Odom, Richard B. (2006). Andrews' Diseases of the Skin: clinical dermatology (الطبعة 10th). Saunders Elsevier. ISBN 0-7216-2921-0. OCLC 62736861. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Marty AM. "Filariasis". eMedicine. مؤرشف من الأصل في 28 أبريل 2019. اطلع عليه بتاريخ 22 أكتوبر 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Onchocerciasis Control Programme (OCP)". Programmes and Projects. منظمة الصحة العالمية. مؤرشف من الأصل في 19 يناير 2014. اطلع عليه بتاريخ 15 يونيو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Onchocerciasis Elimination Program for the Americas (OEPA)". Programmes and Projects. منظمة الصحة العالمية. مؤرشف من الأصل في 27 أكتوبر 2013. اطلع عليه بتاريخ 15 يونيو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "African Programme for Onchocerciasis Control (APOC)". Programmes and Projects. منظمة الصحة العالمية. مؤرشف من الأصل في 20 ديسمبر 2013. اطلع عليه بتاريخ 15 يونيو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "NEWS SCAN: Columbia ousts river blindness; Vaccine-derived polio in India; Danish Salmonella trends". CIDRAP News. July 30, 2013. مؤرشف من الأصل في 09 سبتمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Rea PA, Zhang V, Baras YS (2010). "Ivermectin and River Blindness". American Scientist. 98 (4): 294–303. مؤرشف من الأصل في 6 يناير 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Trattler, Bill; Gladwin, Mark (2007). Clinical Microbiology Made Ridiculously Simple. Miami: MedMaster. ISBN 0-940780-81-X. OCLC 156907378. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Taylor MJ, Bandi C, Hoerauf A (2005). "Wolbachia bacterial endosymbionts of filarial nematodes". Advances in Parasitology. 60: 245–84. doi:10.1016/S0065-308X(05)60004-8. PMID 16230105. مؤرشف من الأصل في 29 يناير 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Hoerauf A (2008). "Filariasis: new drugs and new opportunities for lymphatic filariasis and onchocerciasis". Current Opinion in Infectious Diseases. 21 (6): 673–81. doi:10.1097/QCO.0b013e328315cde7. PMID 18978537. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yates DM, Wolstenholme AJ (August 2004). "An ivermectin-sensitive glutamate-gated chloride channel subunit from Dirofilaria immitis". International Journal for Parasitology. 34 (9): 1075–81. doi:10.1016/j.ijpara.2004.04.010. PMID 15313134. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harder A (2002). "Chemotherapeutic approaches to nematodes: current knowledge and outlook". Parasitology Research. 88 (3): 272–7. doi:10.1007/s00436-001-0535-x. PMID 11954915. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wolstenholme AJ, Rogers AT (2005). "Glutamate-gated chloride channels and the mode of action of the avermectin/milbemycin anthelmintics". Parasitology. 131 (Suppl:S85–95): S85–95. doi:10.1017/S0031182005008218. PMID 16569295. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fenwick, A (Mar 2012). "The global burden of neglected tropical diseases". Public health. 126 (3): 233–6. doi:10.1016/j.puhe.2011.11.015. PMID 22325616. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "What is river blindness?". Sightsavers International. مؤرشف من الأصل في 15 ديسمبر 2007. اطلع عليه بتاريخ 28 يناير 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Status of onchocerciasis in APOC countries". منظمة الصحة العالمية. 2008. مؤرشف من الأصل في 26 أكتوبر 2013. اطلع عليه بتاريخ 26 أبريل 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Epidemiology". Stanford University. 2006. مؤرشف من الأصل في 6 أبريل 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Peña Flores, G., Richards, F., et al. (2010). Lack of Onchocerca volvulus transmission in the northern focus in Chiapas. Am. J. Trop. Med. Hyg., 83(1), 15-20.
- Peña Flores, G., Richards, F., & Domínguez, A. (2010). Interruption of transmission of Onchocerca volvulus in the Oaxaca focus. Am. J. Trop. Med. Hyg., 83(1), 21-27.
- Thylefors B, Alleman MM, Twum-Danso NA (May 2008). "Operational lessons from 20 years of the Mectizan Donation Program for the control of onchocerciasis". Trop Med Int Health. 13 (5): 689–96. doi:10.1111/j.1365-3156.2008.02049.x. PMID 18419585. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Allen JE, Adjei O, Bain O, Hoerauf A, Hoffmann WH, Makepeace BL, Schulz-Key H, Tanya VN, Trees AJ, Wanji S, Taylor DW (April 2008). Lustigman, Sara (المحرر). "Of Mice, Cattle, and Humans: The Immunology and Treatment of River Blindness". PLoS Negl Trop Dis. 2 (4): e217. doi:10.1371/journal.pntd.0000217. PMC 2323618. PMID 18446236. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- "River blindness resistance fears". BBC News. 2007-06-14. مؤرشف من الأصل في 01 سبتمبر 2017. اطلع عليه بتاريخ 15 يونيو 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Osei-Atweneboana MY, Eng JK, Boakye DA, Gyapong JO, Prichard RK (June 2007). "Prevalence and intensity of Onchocerca volvulus infection and efficacy of ivermectin in endemic communities in Ghana: a two-phase epidemiological study". Lancet. 369 (9578): 2021–9. doi:10.1016/S0140-6736(07)60942-8. PMID 17574093. مؤرشف من الأصل في 9 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - [No author listed] (11 July 2009). "Fighting river blindness and other ills". Lancet. 374 (9684): 91. doi:10.1016/S0140-6736(09)61262-9. PMID 19595328. الوسيط
|CitationClass=تم تجاهله (مساعدة) (editorial)
روابط خارجية
CDC Parasites of public health concern
- بوابة طب
