بروتييز السيرين
بروتياز السيرين أو سيرين ايندوبيبتيداز (بالإنجليزية: Serine protease)هو مجموعة من الانزيمات التي تقوم بلتصق سلسلة سندات الببتيد في البروتينات، تعتبر السيرين بمثابة أليف النواة الأحماض الأمينية في (الإنزيم) في موقع نشط .
| سيرين البروتياز | |||||||||
|---|---|---|---|---|---|---|---|---|---|
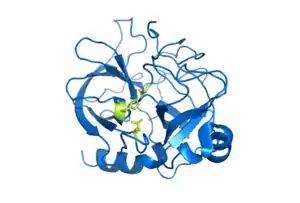 التركيب البلوري للكيموتربسين البقري. وتظهر بقايا الحفاز كما العصي الأصفر. المقدمة من 1CBW. | |||||||||
| أرقام التعريف | |||||||||
| رقم التصنيف الإنزيمي | 3.4.21.- | ||||||||
| قواعد البيانات | |||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||
| إكسباسي | راجع NiceZyme | ||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||
| ميتاسيك | المسار الأيضي | ||||||||
| بريام | ملف التعريف | ||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
المواقع
هذه الانزيمات موجودة بتواجد مطلق في كل من حقيقيات النوى وبدائيات النوى . وتقع سيرين البروتياز في فئتين رئيسيتين على أساس بنيتها: كيموتربسين مثل (التربسين الشبيهة) أو سبتيليزين .[1] في البشر، وهي المسؤولة عن تنسيق وظائف فسيولوجية مختلفة، بما في ذلك الهضم، والاستجابة المناعية لها، تخثر الدم والتكاثر.[2]
آلية التحفيز
يذكر ان اللاعب الرئيسي في آلية التحفيز في الكيموتربسين و سبتيليزين(subtillisin )للانزيمات العشيرة أعلاه هو ثالوث الحفاز . يقع ثالوث في موقع نشط للانزيم، حيث يحدث التحفز، ويتم الحفاظ عليها في جميع الانزيمات لأنزيم سيرين البروتيني. وثالوث التحفيز هو هيكل منسق تتألف من ثلاثة الأساسية الأحماض الأمينية : الحامض الاميني (صاحب 57)، سيرين ( سر 195 ) (ومن هنا جاء اسم "سيرين البروتياز") و حمض الأسبارتيك (ASP 102). هذه الأحماض الأمينية الثلاثة الرئيسية كل تلعب دورا أساسيا في قدرة الشق في البروتياز.[3] في حين أن أعضاء الأحماض الأمينية للثالوث تقع بعيدة عن بعضها البعض على تسلسل البروتين، نظرا للطي، وأنها سوف تكون قريبة جدا من بعضها البعض في قلب الإنزيم. هندسة خاصة من أعضاء ثالوث هي مميزة جدا وظيفتها محددة: فقد تبين أن موقف أربع نقاط فقط من ثالوث تميز وظيفة الانزيم المحتوية.[4]
المراجع
-
Hedstrom, L. (2002). "Serine protease mechanism and specificity". Chem Rev. 102 (12): 4501–24. doi:10.1021/cr000033x. PMID 12475199. الوسيط
|CitationClass=تم تجاهله (مساعدة) -
Madala PK, Tyndall JD, Nall T, Fairlie DP. (2010). "Update 1 of: Proteases universally recognize beta strands in their active sites". Chem Rev. 110 (6): PR1–31. doi:10.1021/cr900368a. PMID 20377171. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Ovaere P, Lippens S, Vandenabeele P, Declercq W. (2009). "The emerging roles of serine protease cascades in the epidermis". Trends Biochem Sci. 34 (9): 453–63. doi:10.1016/j.tibs.2009.08.001. PMID 19726197. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Evnin, Luke B.; Vásquez, John R.; Craik, Charles S. (1990). "Substrate specificity of trypsin investigated by using a genetic selection". Proceedings of the National Academy of Sciences of the United States of America. 87 (17): 6659–63. doi:10.1073/pnas.87.17.6659. JSTOR 2355359. PMC 54596. PMID 2204062. الوسيط
|CitationClass=تم تجاهله (مساعدة)
وصلات إضافية
- The ميروبس online database for peptidases and their inhibitors: Serine Peptidase
- Serine Proteases site at جامعة سانت لويس (SLU)
- Serine proteases في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية
