السيليكتين
على selectins (مجموعة من التمايز 62 أو CD62) هي عائلة من خلية التصاق الجزيئات (أو الحدب). كل selectins هي واحدة من سلسلة الغشاء glycoproteins التي تشترك في خصائص مشابهة ج-نوع يكتينس بسبب المتعلقة الأمينية محطة و الكالسيوم التي تعتمد على الربط.[2] Selectins تربط مع السكر مويتيس و لذلك تعتبر نوع من كتين, التصاق الخلية البروتينات التي تربط السكر بالبوليمرات.[3]
| Selectin | |
|---|---|
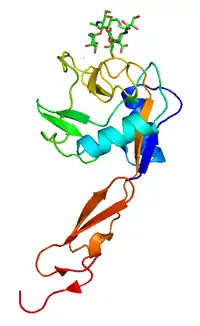 | |
| دراسة البلورات بالأشعة السينية of P-selectin ليكتين bound to sugar, shown in sticks.[1] | |
| معرف | |
| رمز | Selectin |
| إنتربرو | IPR002396 |
| سيليكتين | |
|---|---|
 | |
| دراسة البلورات بالأشعة السينية of P-selectin ليكتين bound to sugar, shown in sticks.[1] | |
| معرف | |
| رمز | سيليكتين |
| إنتربرو | IPR002396 |
البناء
يشترك جميع الأعضاء الثلاثة المعروفين في عائلة سيليكتين (L- و E- و P-selectin) في بنية كاسيت مماثلة: مجال N- طرفي ، يعتمد على الكالسيوم ، وعامل نمو البشرة (EGF) مثل المجال ، متغير عدد وحدات تكرار الإجماع (2 و 6 و 9 لـ L- و E- و P-selectin ، على التوالي) ، ومجال الغشاء (TM) والذيل السيتو بلازمي داخل الخلايا (العصارة الخلوية). لا يتم حفظ الأجزاء الغشائية والسيتوبلازمية عبر سيليكتينز كونها مسؤولة عن استهدافها لأجزاء مختلفة. [4] على الرغم من أنها تشترك في عناصر مشتركة ، إلا أن توزيع الأنسجة وحركية الربط الخاصة بها مختلفة تمامًا، مما يعكس أدوارها المتباينة في العمليات الفيزيولوجية المرضية المختلفة. [5]
الأنواع
هناك ثلاث مجموعات فرعية من المحددات:
- سيليكتين E (في الخلايا البطانية )
- L- سيليكتين (في الكريات البيض )
- P-selectin (في الصفائح الدموية والخلايا البطانية)
L-selectin هي أصغر مجموعة مختارة من الأوعية الدموية ، والتي يتم التعبير عنها في جميع الخلايا المحببة والوحيدات وفي معظم الخلايا الليمفاوية ، ويمكن العثور عليها في معظم الكريات البيض. يتم تخزين P-selectin ، وهو أكبرسيليكتين ، في حبيبات ألفا من الصفائح الدموية وفي أجسام Weibel – Palade للخلايا البطانية ، ويتم نقلها إلى سطح الخلية للخلايا البطانية والصفائح الدموية المنشطة. لا يتم التعبير عن E-selectin في ظل الظروف الأساسية ،الا باستثناء الأوعية الدقيقة للجلد ، ولكن يتم تحفيزها بسرعة بواسطة السيتوكينات الالتهابية.
تشترك هذه الأنواع الثلاثة في درجة كبيرة من التماثل المتسلسل فيما بينها (باستثناء المجالات الغشائية والسيتو بلازمية) وبين الأنواع. كشف تحليل هذا التنادد أن مجال الليكتين ، الذي يربط السكريات، هو الأكثر حفظًا ، مما يشير إلى أن المنتخبات الثلاثة تربط هياكل سكر مماثلة. يتم حفظ المجالات السيتو بلازمية والغشاء بشكل كبير بين الأنواع ، ولكن لا يتم حفظها عبرالسيليكتينز. هذه الأجزاء من جزيئات سيليكتين مسؤولة عن استهدافها لأجزاء مختلفة: P-selectin إلى الحبيبات الإفرازية ، و E-selectin إلى غشاء البلازما ، و L-selectin إلى أطراف microfolds على الكريات البيض. [4]
علم أصول الكلمات
يأتي اسم selectin من الكلمتين "المختار" و " الليكتين " ، وهما نوعان من بروتينات "التعرف على الكربوهيدرات". [6]
الوظيفة
تشارك سيليكتينز في توجيه الخلايا الليمفاوية التأسيسية ، وفي عمليات الالتهاب المزمن والحاد ، بما في ذلك التهاب ما بعد نقص تروية العضلات والكلى والقلب والتهاب الجلد وتصلب الشرايين والتهاب كبيبات الكلى والذئبة الحمامية [4] والورم الخبيث السرطاني.
أثناء الاستجابة الالتهابية ، يتم التعبير عن P-selectin على , انها الخلايا البطانية أولاً ، متبوعًا بـ E-selectin لاحقًا. تسبب المنبهات مثل الهيستامين والثرومبين الخلايا البطانية لتعبئة الإفراج الفوري عن P-selectin المشكل من أجسام Weible-Palade داخل الخلية. تحفز السيتوكينات مثل TNF-alpha النسخ والترجمة لـ E-selectin واختيار P الإضافي ، والذي يفسر التأخير لعدة ساعات. [7]
عندما تتدحرج الكريات البيض على طول جدار الأوعية الدموية ، يرتبط المجال البعيد الشبيه بالكتين من سيليكتين بمجموعات كربوهيدرات معينة مقدمة على البروتينات (مثل PSGL-1 ) على الكريات البيض ، مما يؤدي إلى إبطاء الخلية ويسمح لها بمغادرة الأوعية الدموية وادخل موقع الإصابة. إن الطبيعة منخفضة التقارب لسيليكتينز هي التي تسمح بعمل "التدحرج" المميز المنسوب إلى الكريات البيض أثناء سلسلة التصاق الكريات البيض . [2]
يحتوي كل selectin على مجال التعرف على الكربوهيدرات الذي يتوسط الارتباط بجليكانات معينة على الخلايا المناسبة. لديهم طيات بروتينية متشابهة بشكل ملحوظ وبقايا ملزمة للكربوهيدرات ، مما يؤدي إلى التداخل في الجليكانات التي ترتبط بها.
ترتبط Selectins بمُحدد sialyl Lewis X (SLe x ) "NeuAcα2-3Galβ1-4 (Fucα1-3) GlcNAc." ومع ذلك ، فإن SLe x ، في حد ذاته ، لا يشكل مستقبلًا فعالًا للتحديد. بدلاً من ذلك ، فإن SLe x وما يرتبط بها من جليكانات sialylated و fucosylated هي مكونات لمحددات ربط أكثر شمولاً. [8]
أفضل اللجينات المميزة لثلاثة سيليكتينز هي P-selectin glycoprotein ligand-1 ( PSGL-1 ) ، وهو بروتين سكري من النوع mucin معبر عنه في جميع خلايا الدم البيضاء.
ترتبط العدلات والحمضات بـ E-selectin. أحد الروابط التي تم الإبلاغ عنها لـ E-selectin هو مستضد Lewis X sialylated (SLe x ). تستخدم الحمضات ، مثل العدلات ، هياكل مقاومة للبروتياز ومقاومة للبروتياز للارتباط بـ E-selectin ، على الرغم من أن الحمضات تعبر عن مستويات أقل بكثير من هذه الهياكل على سطحها. [9]
Ligands لـ P-selectin على الحمضات والعدلات هي هياكل متشابهة ومقاومة للبروتياز ومقاومة إندو بيتا جالاكتوزيداز ، تختلف بشكل واضح عن تلك التي تم الإبلاغ عنها لـ E-selectin ، وتقترح أدوارًا متباينة لـ P-selectin و E-selectin أثناء التوظيف خلال الاستجابات الالتهابية. [10]
آليات الترابط
تحتوي Selectins على مجالات مفصلية ، مما يسمح لها بالخضوع لتغييرات مطابقة سريعة في نطاق نانوثانية بين المطابقات "المفتوحة" و "المغلقة". يؤدي إجهاد القص على جزيء سيليكتين إلى تفضيله للتشكيل "المفتوح". [11]
في دحرجة كريات الدم البيضاء ، يسمح الشكل `` المفتوح '' لـ Selectin له بالارتباط بجزيئات sialyl Lewis الداخلية بعيدًا على طول سلسلة PSGL-1 ، مما يزيد من تقارب الارتباط الكلي - إذا انكسر رابط selectin-sialyl Lewis ، فيمكنه الانزلاق وتشكيل جديد روابط مع جزيئات sialyl Lewis الأخرى أسفل السلسلة. ومع ذلك ، في التشكل "المغلق" ، يكون سيليكين قادرًا فقط على الارتباط بجزيء سياليل لويس واحد ، وبالتالي يقلل بشكل كبير من تقارب الارتباط.
والنتيجة هي أن سيليكتين تظهر سلوك ارتباط الانزلاق والانزلاق - في ظل ضغوط القص المنخفضة ، تزداد تقاربات الترابط الخاصة بهم عن طريق زيادة قوة الشد المطبقة على الرابطة بسبب المزيد من التحديدات التي تفضل التشكل "المفتوح". عند الضغوط العالية ، لا تزال تقاربات الربط منخفضة لأن رابطة سيليكتين - يجند لا تزال رابطة انزلاق عادية. يُعتقد أن عتبة إجهاد القص هذه تساعد في تحديد القطر الصحيح للأوعية الدموية لبدء تسرب الكريات البيض ، وقد تساعد أيضًا في منع تراكم الكريات البيض غير المناسب أثناء ركود الأوعية الدموية. [12]
الدور في السرطان
أصبح من الواضح أن سيليكين قد يلعب دورًا في الالتهاب و تطور السرطان. [4] تستغل الخلايا السرطانية الآليات المعتمدة على سيليكين التي تتوسط ربط الخلايا والتفاعلات الدوارة من خلال التعرف على روابط الكربوهيدرات على الخلية الورمية لتعزيز ورم خبيث في الأعضاء البعيدة ، [13] [14] تظهر "محاكاة الكريات البيض". [15]
أظهر عدد من الدراسات زيادة التعبير عن روابط الكربوهيدرات على الورم النقيلي ، [16] تعزيز التعبير E-selectin على سطح الأوعية البطانية في موقع ورم خبيث ، [17] وقدرة الخلايا السرطانية النقيلية على الالتفاف والالتصاق إلى الخلايا البطانية ، مما يشير إلى دور سيليكتينز في ورم خبيث. [18] بالإضافة إلى E-selectin ، تم اقتراح دور P-selectin (المعبر عنه في الصفائح الدموية) و L-selectin (على الكريات البيض) في انتشار السرطان بالطريقة التي تتفاعل بها مع الخلايا السرطانية المنتشرة في مرحلة مبكرة من ورم خبيث. [19] [20]
انتقائية العضو
يحدد كل من Selectins و selectin ligands انتقائية الأعضاء للورم الخبيث. قد تفسر عدة عوامل نظرية البذور والتربة أو توجيه ورم خبيث. على وجه الخصوص ، قد يؤدي التنظيم الجيني وتنشيط أنواع معينة من الكيموكينات والسيتوكينات والبروتياز إلى توجيه ورم خبيث إلى عضو مفضل. في الواقع ، يتطلب تسرب الخلايا السرطانية المنتشرة في العضو المضيف تفاعلات لاصقة متتالية بين الخلايا البطانية وروابطها أو المستقبلات المضادة الموجودة على الخلايا السرطانية. تلتصق الخلايا النقيلية التي تظهر ميلًا كبيرًا للانتشار إلى أعضاء معينة بمعدلات أعلى بالخلايا البطانية الوريدية المعزولة من هذه المواقع المستهدفة. علاوة على ذلك ، فإنها تغزو الأنسجة المستهدفة بمعدلات أعلى وتستجيب بشكل أفضل لعوامل النمو paracrine الصادرة من الموقع المستهدف.
عادةً ما تشير تفاعلات الخلايا السرطانية / الخلايا البطانية أولاً إلى ارتباط أولي بوساطة انتقائية ودحرجة الخلايا السرطانية المنتشرة على البطانة. ثم يتم تنشيط الخلايا السرطانية المتدحرجة عن طريق الكيموكينات المنبعثة محليًا الموجودة على سطح الخلايا البطانية. يؤدي هذا إلى تنشيط الإنتجرينات من الخلايا السرطانية مما يسمح لها بالتصاق أقوى بأعضاء عائلة Ig-CAM مثل ICAM ، مما يؤدي إلى بدء عمليات الترحيل عبر البطانة الداخلية وعمليات التسرب. [72]
في بعض الأحيان لا يتم التعبير عن المجموعة المناسبة من المستقبلات البطانية بشكل أساسي ويجب على الخلايا السرطانية أن تحفز التعبير عنها. في هذا السياق، يمكن أن تؤدي المواد الطافية المزروعة للخلايا السرطانية إلى التعبير عن E- سيليتين بواسطة الخلايا البطانية مما يشير إلى أن الخلايا السرطانية قد تطلق من تلقاء نفسها السيتوكينات مثل TNF-α أو IL-1β أو INF-γ التي ستنشط الخلايا البطانية مباشرة إلى Express E-selectin أو P-selectin أو ICAM-2 أو VCAM. من ناحية أخرى ، تظهر العديد من الدراسات أيضًا أن الخلايا السرطانية قد تبدأ في التعبير عن جزيئات الالتصاق البطاني بطرق غير مباشرة.
نظرًا لأن التصاق العديد من الخلايا السرطانية بالبطانة يتطلب وجود سيليكتينات بطانية بالإضافة إلى كربوهيدرات سياليل لويس على الخلايا السرطانية ، فإن درجة التعبيرعن سيليكتينز على جدار الأوعية الدموية ووجود الترابط المناسب على الخلايا السرطانية هما العاملان المحددان لالتصاقهما والتسرب إلى عضو معين. يعد ملف تعريف التعبير الانتقائي التفاضلي على البطانة والتفاعلات المحددة للمنتخبات التي يتم التعبير عنها بواسطة الخلايا البطانية للأعضاء المستهدفة المحتملة وروابطها المعبر عنها على الخلايا السرطانية من المحددات الرئيسية التي تكمن وراء توزيع النقائل الخاصة بالأعضاء.
ابحاث
تشارك سيليكتينز في مشاريع لعلاج هشاشة العظام ، وهو مرض يحدث عندما تصبح الخلايا المكونة للعظام والتي تسمى بانيات العظم نادرة للغاية. تتطور بانيات العظم من الخلايا الجذعية ، ويأمل العلماء أن يتمكنوا في النهاية من علاج هشاشة العظام عن طريق إضافة الخلايا الجذعية إلى نخاع عظام المريض. طور الباحثون طريقة لاستخدام سيليكتينز لتوجيه الخلايا الجذعية التي يتم إدخالها في نظام الأوعية الدموية إلى نخاع العظام. [21] يتم التعبير عن E-selectins بشكل أساسي في نخاع العظام ، وقد أظهر الباحثون أن تمييز الخلايا الجذعية ببروتين سكري معين يؤدي إلى هجرة هذه الخلايا إلى نخاع العظام. وبالتالي ، قد تكون سيليتينات ذات يوم ضرورية للعلاج التجديدي لهشاشة العظام. [22]
انظر أيضًا
- مجال السوشي
المراجع
- ببب: 1G1R; "Insights into the molecular basis of leukocyte tethering and rolling revealed by structures of P- and E-selectin bound to SLe(X) and PSGL-1". Cell. 103 (3): 467–79. October 2000. doi:10.1016/S0092-8674(00)00138-0. PMID 11081633. S2CID 12719907. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cotran; Kumar, Collins (1998). Robbins Pathologic Basis of Disease. Philadelphia: W.B Saunders Company. ISBN 978-0-7216-7335-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Parham, Peter (2005). The immune system (الطبعة 2nd). New York: Garland Science. صفحات 244–245. ISBN 978-0-8153-4093-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The role of selectins in inflammation and disease". Trends in Molecular Medicine. 9 (6): 263–8. June 2003. doi:10.1016/S1471-4914(03)00071-6. PMID 12829015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Biophysics of selectin-ligand interactions in inflammation and cancer". Physical Biology. 8 (1): 015013. February 2011. Bibcode:2011PhBio...8a5013S. doi:10.1088/1478-3975/8/1/015013. PMID 21301059. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The Interaction of Selectins and PSGL-1 as a Key Component in Thrombus Formation and Cancer Progression". BioMed Research International. 2017: 6138145. 2017. doi:10.1155/2017/6138145. PMID 28680883. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jennette, J. Charles; Falk, Ronald J. (2008). "Immunologic Mechanisms of Vasculitis". Seldin and Giebisch's the Kidney. صفحات 2315–2338. doi:10.1016/B978-012088488-9.50085-1. ISBN 9780120884889. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "E-selectin receptors on human leukocytes". Blood. 112 (9): 3744–52. November 2008. doi:10.1182/blood-2008-04-149641. PMID 18579791. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Differences between human eosinophils and neutrophils in the function and expression of sialic acid-containing counterligands for E-selectin". Journal of Immunology. 152 (2): 774–82. January 1994. PMID 7506734. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Comparison of human eosinophil and neutrophil ligands for P-selectin: ligands for P-selectin differ from those for E-selectin". American Journal of Respiratory Cell and Molecular Biology. 12 (3): 315–9. March 1995. doi:10.1165/ajrcmb.12.3.7532979. PMID 7532979. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "For catch bonds, it all hinges on the interdomain region". The Journal of Cell Biology. 174 (7): 911–3. September 2006. doi:10.1083/jcb.200609029. PMID 17000873. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Catch bonds govern adhesion through L-selectin at threshold shear". The Journal of Cell Biology. 166 (6): 913–23. September 2004. doi:10.1083/jcb.200403144. PMID 15364963. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Targeting selectins and selectin ligands in inflammation and cancer". Expert Opinion on Therapeutic Targets. 11 (11): 1473–91. November 2007. doi:10.1517/14728222.11.11.1473. PMID 18028011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Interactions between endothelial selectins and cancer cells regulate metastasis". Frontiers in Bioscience. 16: 3233–51. June 2011. doi:10.2741/3909. PMID 21622232. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Tumor-Microenvironment Interactions". Tumor-microenvironment interactions: the selectin-selectin ligand axis in tumor-endothelium cross talk. 130. 2006. صفحات 125–40. doi:10.1007/0-387-26283-0_6. ISBN 978-0-387-26282-6. PMID 16610706. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Involvement of carbohydrate antigen sialyl Lewis(x) in colorectal cancer metastasis". Diseases of the Colon and Rectum. 40 (4): 420–31. April 1997. doi:10.1007/BF02258386. PMID 9106690. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Increased concentration of soluble E-selectin in the sera of breast cancer patients". Anticancer Research. 17 (2B): 1367–72. 1997. PMID 9137500. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Death receptor-3, a new E-Selectin counter-receptor that confers migration and survival advantages to colon carcinoma cells by triggering p38 and ERK MAPK activation". Cancer Research. 66 (18): 9117–24. September 2006. doi:10.1158/0008-5472.CAN-05-4605. PMID 16982754. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Synergistic effects of L- and P-selectin in facilitating tumor metastasis can involve non-mucin ligands and implicate leukocytes as enhancers of metastasis". Proceedings of the National Academy of Sciences of the United States of America. 99 (4): 2193–8. February 2002. Bibcode:2002PNAS...99.2193B. doi:10.1073/pnas.261704098. PMID 11854515. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Progressive loss of endothelial P-selectin expression with increasing malignancy in colorectal cancer". Laboratory Investigation; A Journal of Technical Methods and Pathology. 85 (2): 248–56. February 2005. doi:10.1038/labinvest.3700217. PMID 15640834. الوسيط
|CitationClass=تم تجاهله (مساعدة) - In the lab of Robert Sackstein Harvard University
- Sackstein Lab نسخة محفوظة 2019-09-29 على موقع واي باك مشين.
روابط خارجية
- مختبر ساكستين للأبحاث
- فيلم تم إنشاؤه بواسطة الكمبيوتر لتعبئة P-selectin داخل خلية بيضاء في mcb.harvard.edu
- بوابة علم الأحياء الخلوي والجزيئي
