أحادي فلوروفوسفات الصوديوم
أحادي فلوروفوسفات الصوديوم (يختصر بالعادة MFP)، هو مركب غير عضوي له الصيغة الكيميائية Na2PO3F،[3] وهو عديم الرائحة واللون، وقابل للذوبان في الماء.
| أحادي فلوروفوسفات الصوديوم | |
|---|---|
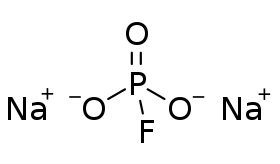 أحادي فلوروفوسفات الصوديوم | |
| الاسم النظامي (IUPAC) | |
فلورو-ثنائي أكسيد-أوكسوفوسفوران ثنائي الصوديوم | |
| المعرفات | |
| رقم CAS | 10163-15-2 |
| بوب كيم | 24266 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | Na2FPO3 |
| الكتلة المولية | 143.95 غ/مول |
| المظهر | بلورات عديمة اللون |
| الكثافة | غ/سم3 |
| نقطة الانصهار | 625 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
هذا الملح هو عنصر مكوّن في معاجين الأسنان.[4]
التحضير
يتم إنتاج أحادي فلوروفوسفات الصوديوم صناعياً من خلال تفاعل فلوريد الصوديوم مع ميتافوسفات الصوديوم وفق المعادلة التالية:[4]
وتنطوي العملية على انفصال الرابطة ما بين جزيء الفوسفات الثنائي (بيروفوسفات) بطريقة مماثلة لعملية الحلمهة.
يمكن أن يحضر المركب أيضاً عن طريق معالجة بيروفسفات الصوديوم الرباعي أو فوسفات ثنائي الصوديوم مع فلوريد الهيدروجين.[4] يمكن إعداد المركب في المختبر عن طريق حلمهة أيونات ثنائي فلوروالفوسفات مع هيدروكسيد الصوديوم المخفف وفق المعادلة التالية:
الخواص
أحادي فلوروفوسفات صوديوم مادة عديمة اللون والرائحة ومنحلة بالماء. تنصهر بلورات أحادي فلوروفوسفات صوديوم عند 625° س.
بنية الأيون السالب للفلوروفوسفات مكوّن من الفوسفور في مركز لشكل رباعي الأسطح يحدّها ثلاث ذرات أكسجين وذرة فلور واحدة. تصوّر التمثيلات الرسمية رابطة مضاعفة بين ذرة أكسجين واحدة مع الفوسفور، ورابطة أحادية لذرتي الأكسجين الأخريين مع الفلور. في هذا الوصف الرسمي الأساسي، تتوضع الشحنة السالبة على ذرات (O) الذي في رابطة (P-O) الأحادية، هي مماثلة ومتكافئة إلكترونياً مع (Na2SO4)، ويمتلك الأيون السالب تناظراً من نوع C3v.
الاستخدامات
من المعروف أن(MFP) عنصر مكوّن في معاجين الأسنان،[5] وهو يعمل كمصدر للفلوريد وفقاً لمعادلة التحلل التالية:[4]
الفلورايد يحمي طبقة المينا من هجوم البكتيريا التي تسبب نخر الأسنان (تسوس الأسنان). على الرغم من أنه تم تطويره من قبل كيميائي في شركة (بروكتر وغامبل)، فإن إستخدامه في معجون الأسنان من نوع (كولجيت) قد حصل على براءة الاختراع من خلال (كولجيت بالموليف)، كما تشارك شركة (بروكتر وغامبل) في تسويق معجون الأسنان (كريست) (التي تحتوي على الفلورايد القصديري، والمسوّقة على أنها (Fluoristan). في بداية الثمانينات من القرن الماضي، أعيدت صياغة (كريست) بشكل يتيح استخدام (MFP)، تحت العلامة التجارية (Fluoristat)، وفي هذه الأيام تستخدم معاجين الأسنان (كريست) فلوريد الصوديوم.
يستخدم MFP أيضا في بعض الأدوية لعلاج هشاشة العظام.[4] في عام 1991، توصل (كالغون) إلى أن الصوديوم الأحادي الفلورية الفوسفاتي ثبّط تفكك الرصاص في مياه الشرب عند تواجده بتركيزات تتراوح بين 0.1 ملغم / لتر و 500 ملغم / لتر.[6]
تسوس الاسنان
يتسبب تسوس الأسنان عن طريق البكتيريا الموجودة بشكل طبيعي في الفم، هذه البكتيريا تكوّن شريط لزج ليّن عديم اللون على الأسنان تسمى اللويحة السنّية. عندما يتم تناول الأطعمة التي تحتوي على الكربوهيدرات (النشويات والسكريات)، تستخدم البكتيريا التي تشكل اللويحة السنّية السكر كمصدر للطاقة وتحوّل السكّر أيضاً إلى مادة تشبه الغراء تساعدهم على التمسك بسطح الأسنان، تنتج اللويحات السنّية أحماضاً تقوم بمهاجمة مينا الأسنان.[7]
كيمياء الاضمحلال والتحلل
يتكون مينا الأسنان معظمهم من (هيدروكسي فوسفات الكالسيوم)، (Ca5(PO4)3OH)، المعروف أيضا باسم (هيدروكسي أباتيت المعدني). الأباتيت هو مركب قاس غير قابل للذوبان. الأحماض (+H) الناتجة خصوصا بعد تناول وجبة تحتوي مستويات عالية من السكر، تهاجم (الأباتيت) وفق المعادلة:
كيمياء فلورة ميناء الأسنان
تآكل (الأباتيت) الناتج عن فقدان أيونات -OH يسبب تحلل المينا الخاص بالأسنان، ويتم عكس هذه العملية عندما يقوم اللعاب بتزويد أيونات -OH لإصلاح (الأباتيت) وإعادة تكوينه، في حال توافر أيونات الفلوريد -F في اللعاب ينشأ لفلوروأباتيت Ca5(PO4)3F وفق المعادلة:
يقاوم الفلورواباتيت الهجمات التي تشنّها الأحماض faög أفضل من الأباتيت نفسه، وبالتالي فإن طبقة المينا تقاوم التسوس بشكل أفضل من المينا الذي لا يحتوي على الفلورايد.[8]
الاكتشاف والتطور
كان أول وصف لأحادي فلوروفوسفات الصوديوم في عام 1929 من قبل الكيميائي الألماني (فيلي لانغه Willy Lange)، الذي كان آنذاك في جامعة برلين. محاولاته العقيمة لإعداد حمض أحادي فلورو الفوسفوريك الحر قادت به نحو التحقق من استقرار روابط الايستر التي تكونها؛ جنبا إلى جنب مع (جيردا فون كروجر)، الذي كان أحد طلابه، قام لانج بتصنيع مركّب (ثنائي ايثيل فلوروفسفات) وبعض النظائر الأخرى، والتي ثبت فيما بعد أنها سامة جدا، كونها متعلقة بالنواقل العصبية، وفي الثلاثينيات من القرن الماضي، قام (غيرهارد شريدر) بمحاولة تطوير المبيدات الحشرية الاصطناعية وركز عمله على استرات حمض الفوسفوريك وأدت إلى اكتشاف عرضي لبعض النواقل العصبية الأخرى مثل: فلوروفوسفات ثنائي إيزوبروبيل ، تابون، سومان، وسارين، في هذه الأثناء؛ لانج الذي كان متزوجا من امرأة يهودية، هاجر من ألمانيا إلى الولايات المتحدة وبدأ العمل لصالح شركة (بروكتر وغامبل)، وفي عام 1947نشر هو و(رالف ليفينغستون) من شركة (مونسانتو) طريقة إعداد أحماض الفلوروفوسفوريك الحرة وذكروا استخدام بعض استرات حمض أحادي فلورو الفوسفوريك السامة مثل: DFP)) في علاج الجلوكوما والوهن العضلي الوبيل. أدت معرفة سمّية هذه الاسترات إلى مخاوف من أن بعض الأملاح البسيطة قد تكون أيضا سامة، وهذه المخاوف حالت دون أي استخدام تجاري للأملاح على نطاق واسع، وفي عام 1950 برعاية من الشركة المصنعة للمركبات، شركة (أوزارك) الكيميائية، تم دراسة سمية الصوديوم الأحادي الفلورية الفوسفاتي من قبل (هارولد هودج) في جامعة (روتشستر) الذي كان من بينهم اختبار المضادة للتجويف، وفي عام 1967قدم (كولجيت بالموليف) العديد من براءات الاختراع على استخدام الصوديوم الأحادي الفلورية الفوسفات في معجون الأسنان.[6]
السلامة
المحتوى المعتاد لل(MFP) في معجون الأسنان هو 0.76 ٪. يستخدم المركب عوضاً عن فلوريد الصوديوم لأنه أقل شدة في السمية، على الرغم من أن كلاهما سام، وال(LD50) في الفئران هو 0.9 جم / كجم، حيث أن الملح يسبب سمّية محدودة لكل من الجهاز العضلي الهيكلي والجهاز التنفسي.[9]
المصادر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24266 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : SODIUM MONOFLUOROPHOSPHATE — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24266
- Chambers, Michael. "ChemIDplus - 10163-15-2 - BFDWBSRJQZPEEB-UHFFFAOYSA-L - Sodium monofluorophosphate [USP] - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.nlm.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 14 أبريل 2020. اطلع عليه بتاريخ 28 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann’s Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. doi:10.1002/14356007.a19_465.pub3
- Wolfgang Weinert "Oral Hygiene Products" in Ullmann’s Encyclopedia of Industrial Chemistry 2000, Wiley-VCH, Weinheim. doi:10.1002/14356007.a18_209
- Peter Meiers Monofluorophosphate History نسخة محفوظة 03 يونيو 2017 على موقع واي باك مشين.
- Healthy Teeth نسخة محفوظة 23 يوليو 2017 على موقع واي باك مشين.
- Davis, R. E., Ph.D., Metcalfe, H. C., Williams, J. E., Castka, J. F. (1999). Modern Chemistry. Austin, TX: Harcourt Brace & Company.
- Sodium monofluorophosphate, Environmental Working Group Skin Deep Cosmetics Database (retrieved 17 November 2012) نسخة محفوظة 27 ديسمبر 2017 على موقع واي باك مشين.
- بوابة الكيمياء
- بوابة صيدلة