آلية جروتاس
آلية جروتاس (بالإنجليزية: Grotthuss mechanism) هي قيام بروتون زائد بالتأثير على شبكة الروابط الهيدروجينية لجزيأت الماء أو السوائل الأخرى ذات روابط هيدروجينية من خلال انقسام أو تشكيل روابط تساهمية. نشر جروتاس في 1806 كتاب "نظرية تحليل السوائل عن طريق التيار الكهربائي", قدم ثيودور جروتاس نظرية توصيل الماء للكهرباء.[1] حيث تصور ردة الفعل الكهربائية كنوع من "bucket line" حيث تمر كل ذرة أكسجين في وقت واحد وترتبط مع ذره هيدروجين. وكان يعتقد أن جزيأت الماء عبارة عن OH وليس H2O, ولم يُفهم وجود الأيونات بشكل جيد في ذلك الوقت. وبعد مرور 200 سنة قام كيوكيرمان بمراجعه مقالة.[2]
- OHOHOH ? O-HOHO H+
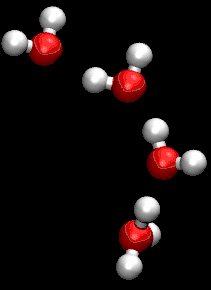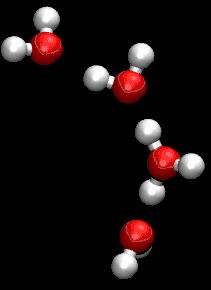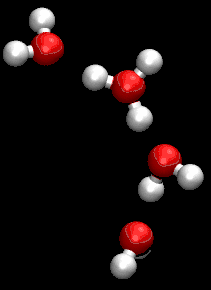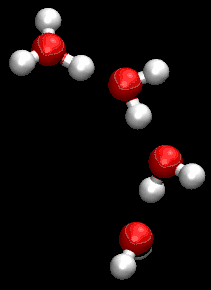
على الرغم من أن جروتاس كان يستخدم صيغة مجملة غير صحيحة للماء، كان وصفة لمرور البروتونات من خلال التعاون بين جزيئات الماء المجاورة دقيق للغاية.
آلية نقل البروتون وآلية قفز البروتون
تعتبر آلية جروتاس اسماً عاماً لآلية قفز البروتونات العامة. في الماء السائل تتم اذابة البروتون الزائد بطريقتين: H9O4 + (إيغين الموجبة) أو H5O2 + (زوندل الموجبة). بينما يعتقد أن آلية التنقل تقوم بإشراك التحويل بين هاتين الاذابتين. وما زالت تفاصيل التنقل والقفس تحت المناقشة. حالياً يوجد آليتان معقولتان:
- Eigen to Zundel to Eigen (E–Z–E),تعتمد على البيانات التجريبية للرنين المعناطيسي النووي.[3]
- Zundel to Zundel (Z–Z), تعتمد على محاكاة الجزيئات الدينماكية.
وتم قياس طاقة الهيدرونيوم المذاب في 2007 وأقترح ان طاقة تفعيل الآليتان لا تتفق مع القوة المحسوبة من روابط الهيدوجين، لكن الآلية الأولى أفضل مرشح من الإثني.[4] بالإضافة إلى ذلك: بلاستخدام وظائف التوزيع الشعاعي (RDF) المشروطه والزمنية، تبين ان وظائف التوزيع الشعاعي للهيدرونيوم يمكن أن يتحلل إلى مساهمات من تركيبتين متميزين,Eigen and Zundel. أول قمة في الـ g(r) من تركيبة Eigen شبيهة بالتوازن,RDF القياسي أكثر تنظيما بقليل، بينما أول قمة لتركيبه Zundel تنقسم إلى قمتين. ثم يتم تتبع عمليات التنقل للبروتون (بعد مزامنة كل احداث الـ PT حيث t=0 وهو وقت الحدث), يكشف ان الهيدرونيوم يبداء من حالة Eigen وينتقل بسرعة إلى حالة Zundel بينما ينتقل البروتون، مع أول قمة g(r) تنفصل إلى اثنتين.[5]
الانتشار الشاذ للبروتونات
آلية جروتاس، مع حفة وزن النسبة وصغر حجم البروتون، تفسر الانتشار الغير عادي للبروتون بالنسبة لانتشار الايونات للكاتيونات الأخرى (جدول 1) والذي يرجع ببساطة إلى الحركة الحرارية العشوائية مثل: الحركة البراونية. يصبح النفق الكمي أكثر احتمالاً كلما صغرت كتلة الكاتيون, والبروتون هو الحالة الاخف والأكثر استقراراً للكاتيون, لكن هناك تاثر بسيط النفق الكمي,بالرغم من أنة يظهر ويسيطر في درجات الحرارة المنخفضة.
جدول 1
| الكاتيون | التنقل / سم2 V−1 s−1 |
| NH4+ | 0.763×10−3 |
| Na+ | 0.519×10−3 |
| K+ | 0.762×10−3 |
| H+ | 3.62×10−3 |
المرجع
- de Grotthuss, C.J.T. (1806). "Sur la décomposition de l'eau et des corps qu'elle tient en dissolution à l'aide de l'électricité galvanique". Ann. Chim. 58: 54–73. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cukierman, Samuel (2006). "Et tu Grotthuss!". Biochimica et Biophysica Acta. 1757: 876–8. doi:10.1016/j.bbabio.2005.12.001. PMID 16414007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Agmon, Noam (1995). "The Grotthuss mechanism". Chem. Phys. Lett. 244: 456–462. doi:10.1016/0009-2614(95)00905-J. مؤرشف من الأصل في 11 سبتمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Markovitch, Omer (2007). "Structure and energetics of the hydronium hydration shells". J. Phys. Chem. A. 111 (12): 2253–6. doi:10.1021/jp068960g. PMID 17388314. مؤرشف من الأصل في 11 أكتوبر 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Markovitch, Omer (2008). "Special Pair Dance and Partner Selection: Elementary Steps in Proton Transport in Liquid Water". J. Phys. Chem. B. 112 (31): 9456–9466. doi:10.1021/jp804018y. PMID 18630857. مؤرشف من الأصل في 14 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء