يودات الكالسيوم
يودات الكالسيوم مركب كيميائي له الصيغة Ca(IO3)2، ويكون على شكل صلب أبيض، وهي مادة مؤكسدة.
| يودات الكالسيوم | |
|---|---|
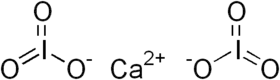 يودات الكالسيوم | |
| الاسم النظامي (IUPAC) | |
يودات الكالسيوم | |
| المعرفات | |
| رقم CAS | 7789-80-2 |
| بوب كيم (PubChem) | 24619 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | CaI2O6 |
| الكتلة المولية | 389.88 غ/مول |
| المظهر | صلب أبيض |
| الكثافة | 4.519 غ/سم3 (أحادي هيدرات) |
| نقطة الانصهار | 540 °س (أحادي هيدرات) |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | 0.24 غ/100 مل ماء |
| المخاطر | |
| ترميز المخاطر |  O O
 Xi Xi |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
التحضير
يحضر يودات الكالسيوم من تفاعل محلول مائي من نترات الكالسيوم مع يودات الصوديوم حسب المعادلة:
Ca(NO3)2 + 2NaIO3 → Ca(IO3)2 + 2NaNO3
يكون الناتج على شكل هيدرات (شكل مائي)، ويحصل على الشكل الخالي من الماء بتسخين الناتج عند 160°س.[3]
الاستخدامات
- يستعمل كمضاف غذائي في الصناعات الغذائية، كما يستعمل كمضاف إلى علف الحيوانات.[4]
طالع أيضاً
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24619 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : CALCIUM IODATE — الرخصة: محتوى حر
- "صفحة البيانات الكيميائية من Sigma-Aldrich". مؤرشف من الأصل في 26 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Holmberg B. (1981). "Solubility and complexation of calcium iodate in (K,Na)NO3 melts". Journal of Inorganic and Nuclear Chemistry. 43 (1): 5–8. doi:10.1016/0022-1902(81)80428-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Is the feed additive calcium iodate regulated in the EU? (EUFIC) نسخة محفوظة 05 مارس 2016 على موقع واي باك مشين.
- بوابة الكيمياء
في كومنز صور وملفات عن: يودات الكالسيوم
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.