هيليسين
الهيليسينات في الكيمياء العضوية هي مركبات عطرية متعددة الحلقات تندمج فيها الحلقات في الموقع أورثو بحيث يتحلق البنزين أو العطريات الأخرى بشكل زاوي لتعطي جزيئات ذات شكل لولبي.

جذبت كيمياء مركبات الهيليسين اهتماماً كبيراً بسبب خواصها البصرية والمطيافية.[1][2][3][4][5][6][7]
التحضير
ورد ذكر بنية الهيليسين لأول مرة من قبل الكيميائي ياكوب مايزنهايمر Jakob Meisenheimer سنة 1903 كناتج اختزال لمركب 2-نترونفثالين.[8] ثم حُضّر [5]هيليسين سنة 1918؛[9] تلا ذلك تحضير [6]هيليسين سنة 1955 من قبل ميلفن سبنسر نيومان Melvin Spencer Newman وزميله ليدنايسر Lednicer بأسلوب تضمن إغلاق حلقتين مركزيتين عن طريق تفاعل فريدل-كرافتس لمركبات أحماض كربوكسيلية.[10][11] ومنذ ذلك الحين ظهرت عدة وسائل وطرق لتحضير الهيليسينات بأطوال ومستبدلات مختلفة.
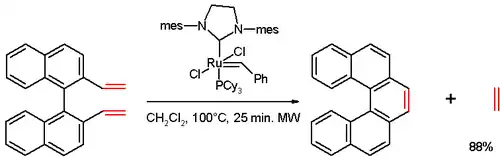
فعلى سبيل المثال استخدمت طريقة التفاعل الحلقي الإلكتروني المؤكسد المحفز ضوئياً لمركب طليعي من /نمط الستيلبين من أجل تحضير [14]هيليسين. كما يمكن استخدام طريقة تفاعل التبادل الأوليفيني، والتي استخدمت لتحضير [5]هيليسين من تفاعل مركب ثنائي الفاينيل (يحضر من 1،1'-بي-2-نفثول (BINOL) بعدة خطوات) مع حفاز غرابز من الجيل الثاني:[12]
هناك أيضاً أسلوب آخر لا يعتمد على التحفيز الضوئي ومبني على تجميع مركبات بيفينيليل النفثالين وإجراء تفاعل تحلق تصاوغي مضاعف بشكل يؤدي إلى الحصول على عدة مركبات من [6]هيليسين:[13]
مجالات الاستخدام
درست مركبات الهيليسين وخواصها من أجل تطبيقات محتملة لها في البصريات اللاخطية،[14] والاستقطاب الدائري،[15][16] والتحفيز العضوي،[17] والتحليل البنيوي الشكلي واليدوي للمركبات العضوية،[18][19] وفي مجال المستشعرات الكيميائية،[20] بالإضافة إلى تطبيقات كيميائية مخبرية مثل تفاعلات الاستبدال بذرات غير متجانسة.[21][22][23][24]
اقرأ أيضاً
المراجع
- Martin, R. H. (1974), The Helicenes. Angew. Chem. Int. Ed. Engl., 13: 649–660. doi:10.1002/anie.197406491
- Helicenes: Synthesis and Applications Yun Shen and Chuan-Feng Chen Chemical Reviews Article ASAP doi:10.1021/cr200087r
- Diels–Alder Additions of Benzynes within Helicene Skeletons David Zhigang Wang, Thomas J. Katz, James Golen, and Arnold L. Rheingold J. Org. Chem.; 2004; 69(22) pp 7769–7771 doi:10.1021/jo048707h
- One hundred years of helicene chemistry. Part 1: non-stereoselective syntheses of carbohelicenes Marc Gingras Chem. Soc. Rev., 2013,42, 968-1006 doi:10.1039/C2CS35154D
- One hundred years of helicene chemistry. Part 2: stereoselective syntheses and chiral separations of carbohelicenes Marc Gingras, Guy Félix and Romain Peresutti Chem. Soc. Rev., 2013,42, 1007-1050 doi:10.1039/C2CS35111K
- One hundred years of helicene chemistry. Part 3: applications and properties of carbohelicenes Marc Gingras Chem. Soc. Rev., 2013,42, 1051-1095 doi:10.1039/C2CS35134J
- Recent Development of Helicene Synthesis Ken Kamikawa Journal of Synthetic Organic Chemistry, Japan Vol. 72 (2014) No. 1 p. 58-67 doi:10.5059/yukigoseikyokaishi.72.58
- Meisenheimer, J. and Witte, K. (1903), Reduction von 2-Nitronaphtalin. Berichte der deutschen chemischen Gesellschaft, 36: 4153–4164. doi:10.1002/cber.19030360481
- Synthese der isomeren Kohlenwasserstoffe 1, 2–5, 6-Dibenzanthracen und 3, 4–5, 6-Dibenzphenanthren Richard Weitzenböck and Albert Klingler Monatshefte für Chemie / Chemical Monthly Volume 39, Number 5, 315–323, doi:10.1007/BF01524529
- A NEW REAGENT FOR RESOLUTION BY COMPLEX FORMATION; THE RESOLUTION OF PHENANTHRO-[3,4-c]PHENANTHRENE Melvin S. Newman, Wilson B. Lutz, and Daniel Lednicer Journal of the American Chemical Society 1955 77 (12), 3420–3421 doi:10.1021/ja01617a097
- The Synthesis and Resolution of Hexahelicene Melvin S. Newman and Daniel Lednicer Journal of the American Chemical Society 1956 78 (18), 4765–4770 doi:10.1021/ja01599a060
- Preparation of Helicenes through Olefin Metathesis Shawn K. Collins, Alain Grandbois, Martin P. Vachon, Julie Côté, Angewandte Chemie International Edition, Volume 45, Issue 18 , Pages 2923–2926 2006 doi:10.1002/anie.200504150
- Synthesis of Hexahelicene and 1-Methoxyhexahelicene via Cycloisomerization of Biphenylyl-Naphthalene Derivatives. Storch J., Sýkora J., Čermák J., Karban J., Císařová I., Růžička A. J. Org. Chem. 2009, 74, 3090. doi: 10.1021/jo900077j نسخة محفوظة 17 ديسمبر 2019 على موقع واي باك مشين.
- Helquat Dyes: Helicene-like Push–Pull Systems with Large Second-Order Nonlinear Optical Responses Benjamin J. Coe, Daniela Rusanova, Vishwas D. Joshi, Sergio Sánchez, Jan Vávra, Dushant Khobragade, Lukáš Severa, Ivana Císařová, David Šaman, Radek Pohl, Koen Clays, Griet Depotter, Bruce S. Brunschwig, and Filip Teplý The Journal of Organic Chemistry 2016 81 (5), 1912-1920 doi:10.1021/acs.joc.5b02692
- Synthetic Control of the Excited-State Dynamics and Circularly Polarized Luminescence of Fluorescent “Push–Pull” Tetrathia[9]helicenes Y. Yamamoto, H. Sakai, J. Yuasa, Y. Araki, T. Wada, T. Sakanoue, T. Takenobu, T. Kawai, T. Hasobe, Chem. Eur. J. 2016, 22, 4263. doi:10.1002/chem.201504048
- Controlled Excited-State Dynamics and Enhanced Fluorescence Property of Tetrasulfone[9]helicene by a Simple Synthetic Process Yuki Yamamoto, Hayato Sakai, Junpei Yuasa, Yasuyuki Araki, Takehiko Wada, Tomo Sakanoue, Taishi Takenobu, Tsuyoshi Kawai, and Taku Hasobe The Journal of Physical Chemistry C 2016 120 (13), 7421-7427 doi:10.1021/acs.jpcc.6b01123
- Tetrathia[7]helicene Phosphorus Derivatives: Experimental and Theoretical Investigations of Electronic Properties, and Preliminary Applications as Organocatalysts D. Dova, L. Viglianti, P. R. Mussini, S. Prager, A. Dreuw, A. Voituriez, E. Licandro, S. Cauteruccio, Asian J. Org. Chem. 2016, 5, 537. doi:10.1002/ajoc.201600025
- Synthesis and Structural Features of Quadruple Helicenes: Highly Distorted π Systems Enabled by Accumulation of Helical Repulsions Takao Fujikawa, Yasutomo Segawa, and Kenichiro Itami Journal of the American Chemical Society 2016 138 (10), 3587-3595 doi:10.1021/jacs.6b01303
- Inherently Chiral Azonia[6]helicene-Modified β-Cyclodextrin: Synthesis, Characterization, and Chirality Sensing of Underivatized Amino Acids in Water Qinfei Huang, Liangwei Jiang, Wenting Liang, Jianchang Gui, Dingguo Xu, Wanhua Wu, Yoshito Nakai, Masaki Nishijima, Gaku Fukuhara, Tadashi Mori, Yoshihisa Inoue, and Cheng Yang The Journal of Organic Chemistry 2016 81 (8), 3430-3434 doi:10.1021/acs.joc.6b00130
- Electrochemical Capacitive K+ EMIS Chemical Sensor Based on the Dibromoaza[7]helicene as an Ionophore for Potassium Ions Detection M. Tounsi, M. BenBraiek, A. Baraket, M. Lee, N. Zine, M. Zabala, J. Bausells, F. Aloui, B. BenHassine, A. Maaref, A. Errachid, Electroanalysis 2016, 28, 2892. doi:10.1002/elan.201600104
- Radical Cation and Neutral Radical of Aza-thia[7]helicene with SOMO–HOMO Energy Level Inversion Ying Wang, Hui Zhang, Maren Pink, Arnon Olankitwanit, Suchada Rajca, and Andrzej Rajca Journal of the American Chemical Society 2016 138 (23), 7298-7304 doi:10.1021/jacs.6b01498
- Synthesis and study of the structural properties of oxa[5]helicene derivatives M. Shyam Sundara, Sibaprasad Sahoob, Ashutosh V. Bedekara, Tetrahedron: Asymmetry Volume 27, Issue 16, 1 September 2016, Pages 777–781 doi:10.1016/j.tetasy.2016.06.020
- Synthesis and Photophysical Properties of Aza[n]helicenes Gourav M. Upadhyay, Harish R. Talele, and Ashutosh V. Bedekar The Journal of Organic Chemistry 2016 81 (17), 7751-7759 doi: 10.1021/acs.joc.6b01395
- Sultam-Based Hetero[5]helicene: Synthesis, Structure, and Crystallization-Induced Emission Enhancement. Tarunpreet S. Virk, Niranjan V. Ilawe, Guoxian Zhang, Craig P. Yu, Bryan M. Wong, Julian M. W. Chan. ACS Omega 2016; 1(6), 1336–1342 doi:10.1021/acsomega.6b00335
- بوابة الكيمياء
