هيبوكلوريت الكالسيوم
هيبوكلوريت الكالسيوم مركب كيميائي له الصيغة Ca(OCl)2، ويكون على شكل مسحوق بلوري أبيض مصفر، له رائحة الكلور.
| هيبوكلوريت الكالسيوم | |
|---|---|
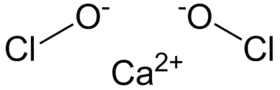 هيبوكلوريت الكالسيوم | |
| الاسم النظامي (IUPAC) | |
هيبوكلوريت الكالسيوم | |
| المعرفات | |
| رقم CAS | 7778-54-3 |
| بوب كيم | 24504 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | Ca(OCl)2 |
| الكتلة المولية | 142.98 غ/مول |
| المظهر | مسحوق بلوري أبيض |
| الكثافة | 2.35 غ/سم3 |
| نقطة الانصهار | 100 °س >177 °س يتفكك |
| الذوبانية في الماء | 21 غ/100 مل ماء يتفاعل |
| المخاطر | |
| ترميز المخاطر |  O O
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| LD50 | 850 مغ/كغ (جرذان، فموي) [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- ينحل تحت كلوريت الكالسيوم بشكل جيد في الماء، وتكون محاليله المائية المركزة ذات لون أصفر مخضر.
- يتميز تحت كلوريت الكالسيوم بخواصه المؤكسدة القوية، وهو يحرر غاز الكلور عند التماس مع الحموض. فعلى سبيل المثال عند التفاعل مع حمض هيدروكلوريك يتحرر غاز الكلور ويتشكل كلوريد الكالسيوم حسب المعادلة:
- Ca(ClO)2 + 4 HCl → CaCl2 + 2 H2O + 2 Cl2
كما يتحرر غاز الكلور عند التفاعل مع غاز ثنائي أكسيد الكربون ويتشكل كربونات الكالسيوم:
- 2 Ca(ClO)2 + 2 CO2 → 2 CaCO3 + 2 Cl2 + O2
تتراوح نسبة الكلور الفعال في العينات التجارية من تحت كلوريت الكالسيوم من 35–80 %.
التحضير
يحضر تحت كلوريت الكالسيوم من تمرير غاز الكلور على مستعلق هيدروكسيد الكالسيوم المائي عند درجات حرارة منخفضة (-20°س)، وذلك لأن التفاعل ناشر للحرارة:
2 Ca(OH)2 + 2 Cl2 → Ca(ClO)2.2H2O + CaCl2 + 2 H2O
يكون تحت كلوريت الكالسيوم الناتج من هذه العملية عبارة عن هيدرات ثنائية، ويحوي مزيجاً من كلوريد الكالسيوم القلوي Ca(OH)2, H2O، بالإضافة إلى الكلس غير المتفاعل.[4]
الاستخدامات
- يستخدم كمادة قاصرة (مبيضة) في الصناعات النسيجية، كما يستخدم لقصر عجينة الورق.
- يستخدم تحت كلوريت الكالسيوم في تعقيم مياه المسابح.
طالع أيضاً
مصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24504 — تاريخ الاطلاع: 14 أكتوبر 2016 — العنوان : CALCIUM HYPOCHLORITE — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24504
- http://www.merck-chemicals.com/documents/sds/emd/eng/en/8417/841799.pdf
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- بوابة الكيمياء
- بوابة صيدلة
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

