مخلقة الغلوتامين
مخلِّقة الغلوتامين (بالإنجليزية: Glutamine synthetase) (GS) ( ر.ت.إ 6.3.1.2 )[2] هو إنزيم يلعب دورا أساسيا في أيض النيتروجين بتحفيز تكثيف الغلوتامات والأمونيا لتشكيل الجلوتامين:
غلوتامات + ATP + NH3 ← جلوتامين + ADP + فوسفات
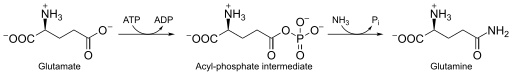
تستخدم مخلقة الغلوتامين الأمونيا المنتَجَة بواسطة اختزال النترات، تحلل الحمض الأميني والتنفس الضوئي.[3] مجموعة الأميد في الغلوتامات هي مصدر للنيتروجين في المسار الأيضي لمستقلب الغلوتامين.[4]
يمكن أن تحدث تفاعلات أخرى عبر مخلقة الغلوتامين. المنافسة بين أيون الأمونيوم والماء، ألفة ارتباطهما وتركيز أيون الأمونيوم عوامل تؤثر في تخليق الغلوتامين وحلمأته. يتشكل الغلوتامين إذا هاجم أيون أمونيوم وسيط أسيل-فوسفات، أو حين تتم إعادة تكوين الغلوتامات إذا هاجم الماء الوسيط.[5][6] يرتبط أيون الأمونيوم بشكل أقوى من الماء مع مخلقة الغلوتامين بسبب القوى الإلكتروساتية بين كاتيونٍ وجيب ارتباط سالب الشحنة.[3] تفاعل آخر محتمل تقوم به مخلقة الغلوتامين هو عند ارتباط NH2OH بها بدل NH4+ وينتج γ-غلوتاميل هيدروكسيمات.[5][6]
مراجع
- ببب: 1FPY; Gill HS, Eisenberg D (February 2001). "The crystal structure of phosphinothricin in the active site of glutamine synthetase illuminates the mechanism of enzymatic inhibition". Biochemistry. 40 (7): 1903–12. doi:10.1021/bi002438h. PMID 11329256. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eisenberg D, Almassy RJ, Janson CA, Chapman MS, Suh SW, Cascio D, Smith WW (1987). "Some evolutionary relationships of the primary biological catalysts glutamine synthetase and RuBisCO". Cold Spring Harb. Symp. Quant. Biol. 52: 483–90. doi:10.1101/sqb.1987.052.01.055. PMID 2900091. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Liaw SH, Kuo I, Eisenberg D (Nov 1995). "Discovery of the ammonium substrate site on glutamine synthetase, a third cation binding site". Protein Sci. 4 (11): 2358–65. doi:10.1002/pro.5560041114. PMC 2143006. PMID 8563633. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Liaw SH, Pan C, Eisenberg D (Jun 1993). "Feedback inhibition of fully unadenylylated glutamine synthetase from Salmonella typhimurium by glycine, alanine, and serine". Proc. Natl. Acad. Sci. USA. 90 (11): 4996–5000. doi:10.1073/pnas.90.11.4996. PMC 46640. PMID 8099447. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eisenberg D, Gill HS, Pfluegl GM, Rotstein SH (Mar 2000). "Structure-function relationships of glutamine synthetases". Biochim Biophys Acta. 1477 (1–2): 122–45. doi:10.1016/S0167-4838(99)00270-8. PMID 10708854. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Liaw SH, Eisenberg D (Jan 1994). "Structural model for the reaction mechanism of glutamine synthetase, based on five crystal structures of enzyme-substrate complexes". Biochemistry. 33 (3): 675–81. doi:10.1021/bi00169a007. PMID 7904828. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي