قانون شارل
في التحريك الحراري والكيمياء الفيزيائية يعتبر قانون شارل على أنه أحد قوانين الغازات وبشكل خاص الغاز المثالي والذي ينص على مايلي:
| عند ضغط ثابت، فإن حجم كتلة معينة من غاز مثالي يزداد أو ينقص بنفس المقدار عند زيادة ونقصان درجة حرارته (كلفن) |
| ان حجم كمية معينة من الغاز تحت ضغط ثابت تتغير طرديا مع درجة الحرارة |
| قانون شارل | |
|---|---|
| النوع | قانون |
| الصيغة | |
| جزء من | ديناميكا حرارية |
| سميت بأسم | جاك شارل |
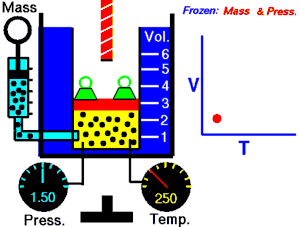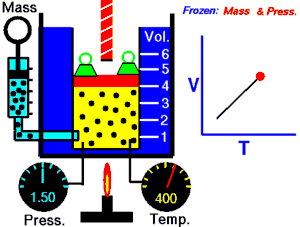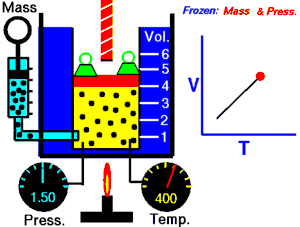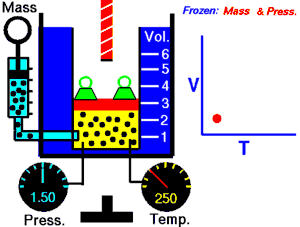
رسم متحرك يوضح العلاقة بين الحجم (V) والحرارة (T).
تم نشر هذا القانون من قبل جوزيف لويس غاي-لوساك في العام 1802، ولكنه أشار إلى أعمال غير منشورة تعود إلى جاك شارل من عام 1787.[1][2][3]
القانون
قام العالم تشارل بتثبيث ضغط الغاز ودرس العلاقة بين درجة الحرارة وحجم الغاز. واكتشف العالم جاك شارل عام 1787م ان عند ثبات ضغط كتلة معينة من غاز يتناسب حجمها تناسبا طرديا مع درجة حرارتها المطلقة ونستنتج القانون التالي:
حيث أن:
ومنه ينتج أن:
- .
تجربة
نأتي بإناء يحتوي على ماء ذو درجة منخفضة..وكذلك بالونة مطاطية ممتلئة بغاز،عندما نغمس البالونة في الماء ينكمش البالون ولكن لماذا؟ذلك بسبب أن مع انخفاض درجة الحرارة البالون تقترب جزيئات الغاز قرب بعضها البعض..وعند إبعاد البالون يعود إلى حالته الطبيعية.
مراجع
- "معلومات عن قانون شارل على موقع ne.se". ne.se. مؤرشف من الأصل في 5 أكتوبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "معلومات عن قانون شارل على موقع zthiztegia.elhuyar.eus". zthiztegia.elhuyar.eus. مؤرشف من الأصل في 25 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "معلومات عن قانون شارل على موقع enciclopedia.cat". enciclopedia.cat. مؤرشف من الأصل في 3 فبراير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة كيمياء فيزيائية
- بوابة الكيمياء
- بوابة الفيزياء
- بوابة غوص
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
